【CACA前沿周刊】92期 常见EGFR-TKI类药物选择及不良反应解析(上篇)
本期看点
序言
表皮生长因子受体是原癌基因c-erbB-1的表达产物,分子量170 kDa,是一个单体跨膜糖蛋白,具酪氨酸激酶活性,属HER/ErbB家族的首个成员,亦称HER1或ErbB1 [1] 。通常情况下,EGFR在与相应的配体结合后形成同源二聚体或与其他HER家族成员形成异源二聚体。随后,二聚化的受体发生交联磷酸化,激活胞内区的TK区,并触发下一级信号传导 [2] 。EGFR具有三个主要结构域,其中胞外结构域在蛋白质的N末端,负责与配体结合。跨膜结构域是单链α螺旋疏水结构。胞内结构域由近膜区、酪氨酸激酶区、C末端区构成 [3] 。

在人类肿瘤中,EGFR异常包括突变、扩增和过表达。这些改变在NSCLC、头颈部鳞状细胞癌、结直肠癌、胶质母细胞瘤、乳腺癌、膀胱癌、妇瘤、肝癌等多种肿瘤中常见 [4,5] 。中国人群中,EGFR突变率达39.0% ~ 57.7% [6] 。女性高于男性(43.7% vs 24.0%),非吸烟者高于吸烟者(49.3% vs 21.5%),腺癌高于非腺癌(38.0% vs 11.7%) [7] 。
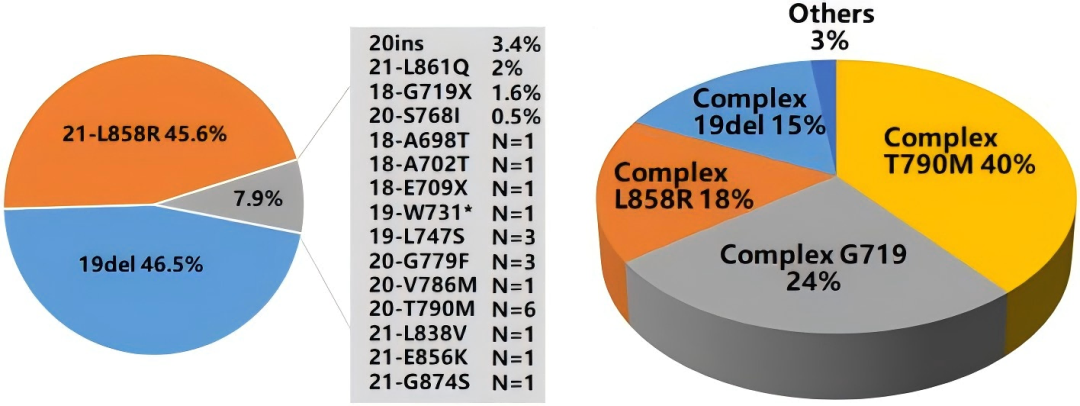
一项纳入中国21324例NSCLC患者的EGFR突变谱研究指出,EGFR阳性平均检出率45.1%。93.3%携带单一突变,6.7%携带复杂突变。单一突变中,92.1%为经典/常见/敏感突变(19del 或 L858R),7.9%为罕见突变 [8] 。
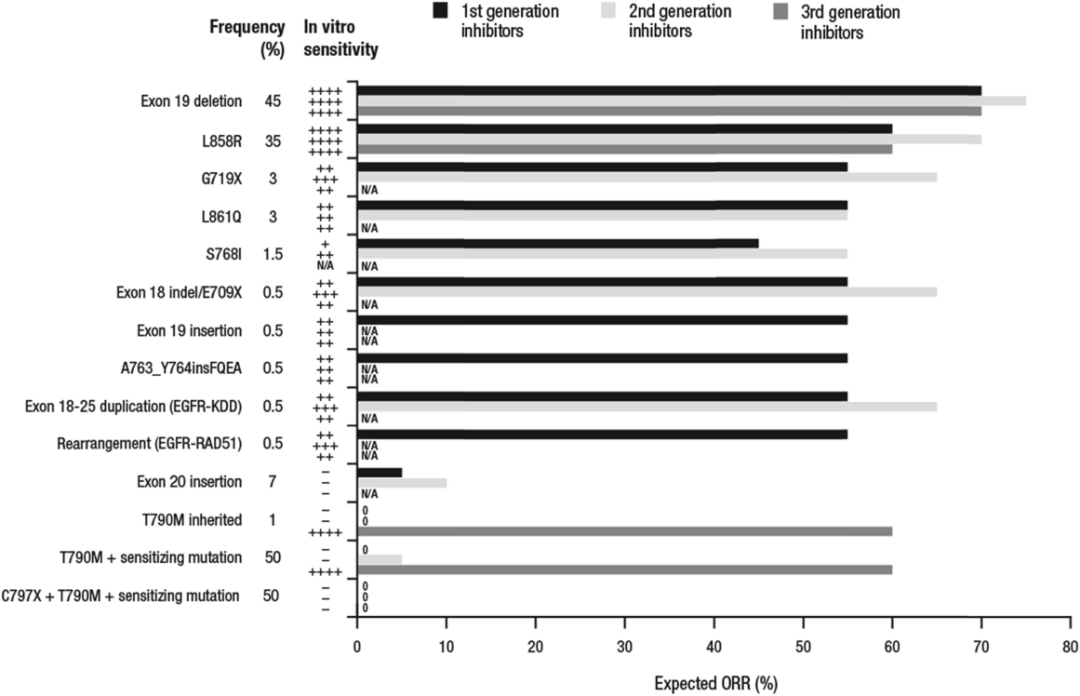
各代EGFR-TKI对常见突变的有效率 [9] 不尽相同。第1代TKI是EGFR-TK的可逆抑制剂。常由T790M导致耐药。第2代TKI旨在通过泛活性、不可逆抑制以改善1代TKI的耐药性。但耐受较差,皮肤和胃肠道毒性增加。第3代TKI旨在克服由T790M突变介导的1、2代TKI耐药,疗效令人满意,且药物间存在差异化优势,适合患者个体化选择。
关于EGFR-TKI,逃不开的话题就是耐药。常见EGFR-TKI耐药方式包括旁路信号激活和EGFR继发突变。
前者涉及其他RTK的失调或下游化合物的异常激活,这些异常通过触发磷脂酰肌醇3-激酶(PI3K)/Akt和丝裂原活化蛋白激酶(MAPK)信号轴对EGFR的抑制具有补偿作用 [10]。
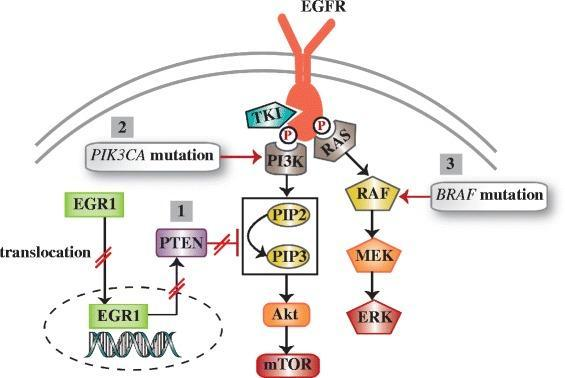
后者是TKI治疗过程中较为常见的耐药方式,如第一代EGFR-TKI治疗9~12个月后,60%的患者产生获得性耐药突变——T790M突变。第二代EGFR-TKI对T790M突变活性有限。第三代EGFR-TKI对T790M突变效果好但仍存在C797S、L718Q和L792H等耐药突变 [11]……
因此,TKI药物的合理使用就成为提升患者生存率的重要手段。此外,第四代TKI也已摩拳擦掌跃跃欲试了。
我们回看各代TKI,一起领略逐步攻克EGFR过程中的匠心巧思。
一代TKI治疗效果有限,一、二线治疗缓解率分别为35%和8%,平均进展时间为4~6个月,代表作是吉非替尼。诸多研究已经证实,一代TKI联合化疗通常不会带来更多获益 [12]。亚洲Ⅲ期IPASS研究 [13]指出,吉非替尼与双药化疗疗效类似,但具有更优的QoL。

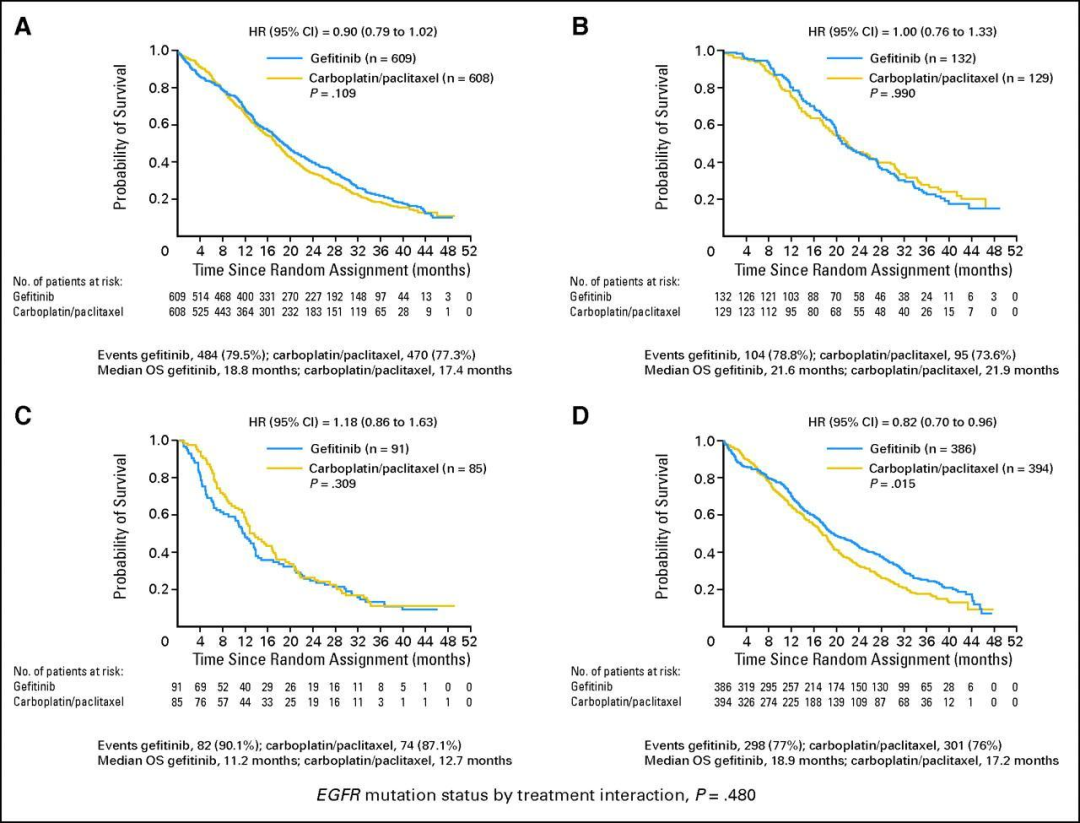
中国一项CNS转移研究 [14]提出,对于CNS转移患者,接受40 Gy/20 f/4 w WBRT联合250 mg/d吉非替尼,CR率19%,PR率62%,ORR达81%,PFS和OS分别为10.0个月和13.0个月。这是为当时化疗为主的有限治疗选择提供了新的活力。
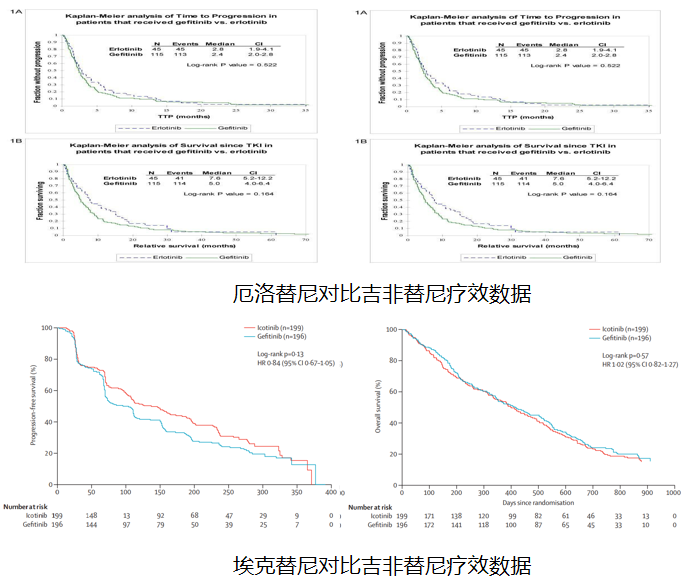
除吉非替尼外,常见一代TKI还包括厄洛替尼和埃克替尼。相比吉非替尼,厄洛替尼在生存数据上更优但无统计学差异。二者安全性类似,厄洛替尼有更高的3级皮疹发生率,更低的3或4级AST和ALT升高发生率和更低的肝功能毒性。间质性肺病发生率类似,但厄洛替尼高级别比例更高 [15]。125 mg/d埃克替尼不劣于250 mg/d吉非替尼(HR 0.84,PFS 4.6个月 vs 3.4个月),药物相关AE特别是皮疹和腹泻均有所改善,药物相关腹泻发生率为19% vs 28% [16]。
二代EGFR-TKI试图通过不可逆的泛ErbB活性来克服一代TKI耐药问题。如阿法替尼不可逆抑制EGFR和HER2,可更有效地阻断ErbB家族同二聚体与异二聚体引发的EGFR通路信号,对T790M也具有活性 [17] 。而达可替尼增强了对19Del和L858R的靶向性,新增对T790M的靶向性。由于达可替尼也对野生型HER2等具有较强抑制作用,因此毒性较高 [18] 。

LUX-Lung3、6、7研究 [19,20]是阿法替尼几个关键的大规模研究。相比双药化疗,40 mg/d阿法替尼显著改善了19del患者的OS(全球33.3个月 vs 21.1个月,亚洲31.4个月 vs 18.4个月)。对比吉非替尼,阿法替尼在PFS和治疗失败时间上均优于吉非替尼(HR均为0.73)。亚洲人群常见3~4级AE包括皮疹(16%)、腹泻(5%)、口腔炎或黏膜炎(5%),但肝毒性低。
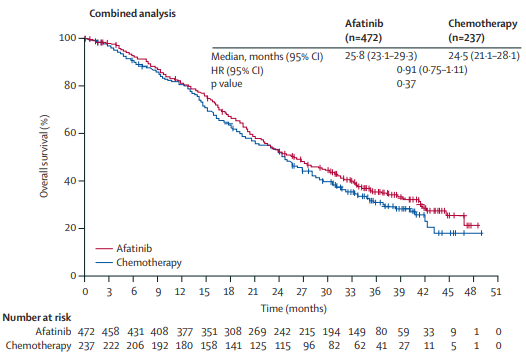
CNS转移对肺癌患者威胁巨大,也是考核TKI的重要指标。在EGFR突变阳性的CNS转移患者中,一线阿法替尼在cFAS集中实现了48.8%的ORR和8.9个月的cDOR,cPFS达12.7个月。特别地,阿法替尼对常见EGFR突变的cORR为57.7%,不常见突变为35.3%;前者PFS更长,可达14.4个月,后者仅6.1个月 [21]。
达可替尼在其Ⅲ期研究中也展现出优于吉非替尼的数据。在EGFR阳性晚期NSCLC患者一线治疗中,45 mg/d达可替尼优于吉非替尼:两组间ORR相当(75% vs 72%),PFS为14.7个月 vs 9.2个月,HR为0.59。最常见3~4级不良反应为皮疹(14% vs 0)、腹泻(8% vs 1%)和ALT升高(1% vs 8%) [22]。
此外,达可替尼展现出优秀的CNS控制能力。中国一项研究在基线脑转移患者中观察到92.9%的ORR和100%的DCR,85.7%的患者观察到可测量的颅内反应。不过,1例脑膜转移患者对达可替尼反应不佳 [23]。
然而,T790M突变依旧是一二代的痛。
为解决一代TKI的耐药和二代TKI的毒性问题,三代TKI顺势而生。三代旨在全面涵盖敏感突变和T790M,解决前两代TKI的耐药性的同时减弱对野生型EGFR的抑制,改善脱靶毒性,实现疗效和安全性的双重迭代升级。第三代TKI在设计时更关注颅内控制,以进一步改善CNS控制、提升患者预后数据和生存质量。基于精准分型,第三代TKI与化疗、抗血管生成、免疫等治疗方案的联合将为患者提供更多生存获益。而像“药物假期”“降阶升阶”等治疗新理念也在保障疗效的前提下进一步改善生存质量。此外,目前上市的多款TKI之间存在差异化优势,有利于患者个体化选择药物。
下一期,我们将为大家带来第三代EGFR-TKI的解析,敬请期待!
医术观澜
……
1-
JAMA :OPTIMUM研究证明,显微超声引导下前列腺活检不劣于MRI引导活检 [24]。
活检是前列腺癌患者风险分层、制定合理治疗计划、预测预后的重要方法。而多参数MRI用于未接受过活检的男性诊断提高了对有临床意义(Gleason分级≥2)的前列腺癌的检测,减少过度诊断。但是,MRI在使用上有诸多限制,可及性差。此外,MRI与活检的分开进行也引入了误差。随着技术的发展,高分辨率显微超声设备将分辨率提升至70微米,并可实时显示前列腺癌,消除配准误差。因此,该研究旨在确定显微超声引导下的活检在检测具有临床意义的前列腺癌方面不劣于MRI/常规超声融合引导活检以及MRI/显微超声引导下的活检不劣于MRI/常规超声。
研究在8个国家进行,参与者按照1:2:3的比例随机接受显微超声、MRI/显微超声以及软件辅助MRI/常规超声引导活检。入组患者为未接受过活检的男性,因PSA水平升高或直肠指检异常由泌尿科医生判断需要前列腺活检。
在主要结局方面,显微超声引导下活检与MRI/常规超声引导下的活检在检测有临床意义的前列腺癌时检出率分别为46%和43%。次要结局方面,MRI/显微超声引导下联合活检与MRI/常规超声引导下活检检测有临床意义的前列腺癌检出率分别为47%和43%。
1级癌症检出率在各组间无显著差异,显微超声组为11.6%,MRI/常规超声组为15.4%,MRI/显微超声组为17.3%。显微超声组活检检出率为38%,MRI/常规超声组为34%,MRI/显微超声组为40%。
根据以上结果,显微超声引导下活检在检测初治男性中具有临床意义的前列腺癌方面不劣于MRI/常规超声融合引导活检。此外,MRI/显微超声融合引导活检也不劣于MRI/常规超声融合引导活检。
3-
The Lancet Oncology :食管癌新辅助放化疗后pCR患者可用主动监测代替标准手术 [25]。
相当一部分食管癌患者在新辅助放化疗和食管切除术后实现pCR。但目前仍不清楚主动监测是否可以用于新辅助放化疗后pCR患者的替代方案。
该研究纳入新辅助放化疗后pCR的局晚期食管癌患者,接受主动监测或标准手术。主要终点是OS,非劣效性定义为2年生存率低15%及以上。
研究共纳入309例患者,198例接受主动监测,111例接受标准手术。在改良的意向治疗分析中,主动监测的2年OS为74%,不劣于标准手术的71%。在意向治疗分析中,主动监测依然为非劣效性(75% vs 70%)。两种分析中HR分别为1.14和0.83,OS无显著差异。标准手术或主动监测后推迟手术的术后并发症和术后死亡率类似。
因此,研究认为食管癌患者pCR后主动监测的2年OS不劣于标准手术。
医谷回声
……
1-
Cancer Communications :复旦大学附属妇产科医院刘海鸥教授发现免疫抑制性JAG2肿瘤相关中性粒细胞通过介导效应调节性T细胞的分化来阻碍卵巢癌中的PD-1阻断反应 [26]。
肿瘤相关中性粒细胞在调节免疫反应中起到关键作用,并表现出显著的异质性。既往研究表明,JAG2配体与高级别浆液型卵巢癌中的免疫抑制微环境相关,但仍不清楚背后的机制。
为解决此问题,研究利用270个样本构成两个独立队列(训练和验证),其余30个样本用于构建患者来源的肿瘤类器官。研究发现,JAG2 +TAN高表达免疫抑制分子,包括PD-L1和CD14,对患者的OS具有独立预后价值。scRNA-seq分析显示JAG2 TAN表现出终末成熟表型,JAG2 TAN的浸润与效应调节性T细胞丰度正相关。CD4 +T细胞与JAG2 TAN相互作用,偏向效应调节性T细胞表型。这一过程可被Notch抑制剂LY3039478抑制。此外,研究者还发现,JAG2 TAN增强了Notch信号激活,最终促进了RBPJ诱导的初始CD4 +T细胞分化为效应调节性T细胞。临床上,JAG2 TAN可作为评估各种实体瘤免疫治疗耐药性的生物标志物。用LY3039478或JAG2中和抗体靶向Notch信号可增强PD-1单抗在异种移植和肿瘤类器官中的疗效。
研究者认为,JAG2 TAN对于效应调节性T细胞的分化至关重要,后者会触发免疫逃逸和对抗PD-1疗法的耐药。而靶向Notch信号传导可克服该耐药。
高峰科讯
……
1-
Molecular Cancer :北京工业大学李虹雨教授发现环状RNA circDCUN1D4通过靶向miR-590-5p/TIMP3轴抑制肝细胞癌的发展 [27]。
目前,肝细胞癌需要更多创新疗法。一些环状RNA已经被证明在HCC组织中的表达水平发生特定变化,如circMTO1、circRHOT1和circARSP91。一些环状RNA充当致癌因子,另一些则充当肿瘤致癌因子。这种二元性调节凸显了环状RNA介导的调节复杂性及其对HCC进展的影响,充分理解这些机制有助于临床转化。
circDCUN1D4是DCUN1D4基因反向剪接形成的。RT-qPCR结果显示,其在HCC组织中表达下调,其表达水平与患者生存率呈现负相关。研究发现,circDCUN1D4在HCC中起miR-590-5p海绵的作用。通过miR-590-5p/TIMP3转录轴,circDCUN1D4间接降低了MMP9和Vimentin的表达,同时上调E-cadherin的表达,从而抑制了HCC的增殖、侵袭和迁移。

2-
Advanced Materials :复旦大学浦东医院张凡教授利用MicroRNA-21无创检测早期结直肠癌 [28]。
低丰度生物分子异常表达的准确、灵敏与原位检测对于早期结直肠癌检测至关重要。然而,临床上使用结肠镜检查和活检的方法是侵入性的,并且对于早期结直肠癌敏感性不高。因此,本研究希望通过整合DNAzyme触发的信号放大技术和发光传感系统,在第2个近红外波长亚区域(NIR-Ⅱ-L)开发一种放大传感策略。
在早期CRC中,过表达的microRNA-21启动上述发光信号,以1.26 pm的高灵敏度实现无创可视化原位结肠癌病变。
3-
Cell Research :天津市肿瘤医院郝继辉教授发现伤害感受器神经元通过与癌症相关成纤维细胞相互作用和抑制NK细胞来促进PDAC进展和癌症疼痛 [29]。
近期许多研究表明,神经系统在肿瘤发生和发展中起到了关键作用。PDAC具有神经周围浸润的特点,并且受到自主神经和感觉神经的支配。因此,PDAC的进展可能与神经系统相关。
研究者发现,在PDAC的肿瘤微环境中,伤害感受神经元通过CGRP和NGF与肿瘤相关CAF相互作用,导致CAF的IF-15表达被抑制,进而导致NK细胞和浸润和细胞毒作用被抑制,最终导致PDAC进展和癌痛。在PDAC患者中,肿瘤组织的伤害性神经支配与NK细胞浸润呈负相关,与癌痛强度呈正相关。该关联是PDAC患者OS和RFS的独立预后因素。
该研究证明了靶向伤害感受器神经元或CGRP信号传导来治疗PDAC或干预癌痛提供了临床前证据。
刊后语
大风泱泱,大潮滂滂;大道如砥,医者无疆。
积跬步以至千里,每一期周刊都是恶性肿瘤学科发展的剪影;积小流以成江海,一年周刊浓缩肿瘤领域各科前沿进展的精华!关注CACA周刊,带你领略恶性肿瘤学科发展的四季花开。
CACA周刊,我们下周不见不散!
编辑 | 李瑞源
排版 | 晓晓
审核 | 李瑞源
链接:http://www.lewenyixue.com/2025/04/08/%E3%80%90CACA%E5%89%8D%E6%B2%BF%E5%91%A8%E5%88%8A%E3%80%9192%E6%9C%9F%20%E5%B8%B8%E8%A7%81EGFR/






赶快来坐沙发