STTT丨中国医学科学院王洁/白桦合作研究发现靶向肿瘤内源性S100钙结合蛋白A1可增强抗肿瘤免疫并增强免疫治疗效果

近年来,ICB带来了重大进步重塑了各种癌症的治疗格局,其中靶向程序性细胞死亡蛋白1(PD-1)及其配体(PD-L1)的免疫检查点抑制剂(ICI)作为单一疗法或联合疗法已成为标准方案。 这些疗法的重点是克服TME中的免疫逃避机制,以重振T细胞介导的抗肿瘤免疫。ICB的成功通常与“发炎”TME的存在有关,其特征是触发有效细胞毒性免疫反应所需的肿瘤特异性CD8+T细胞的显著浸润。然而,治疗反应是异质性的,只有一小部分患者实现了长期、持续的反应,晚期癌症的反应率通常在10%到25%之间。对ICIs的总体反应不满意,加上个体患者结果的显着差异,强调了提高免疫治疗疗效和开发预测性生物标志物的必要性。
越来越多的证据表明,免疫抑制性TME或免疫学上“冷”TME是有效免疫治疗的主要障碍。 这种类型的TME的特点是缺乏免疫效应细胞浸润。相反,它显示免疫抑制调节性T细胞(Tregs)、耗竭的CD8+T细胞、未成熟或致耐受性的DC、抗炎M2样TAM和髓源性抑制细胞的存在增加。然而,目前对癌细胞和免疫细胞之间通信网络的理解仍然有限,驱动这些不同免疫调节情景的因素仍不清楚。最近的研究揭示了肿瘤介导的免疫抑制在免疫逃避和ICB反应中的重要作用。癌基因、肿瘤抑制基因或DNA修复基因的肿瘤内在遗传变化可以调节免疫环境。重要的是,肿瘤细胞内在因素还通过各种机制影响与免疫隔室的通讯。此外,肿瘤细胞内在特征可在肿瘤组织中识别,并显示出作为指导免疫治疗的生物标志物的潜力。然而,缺乏临床适用和有效的生物标志物,并且可以通过液体活检评估以进行动态监测的基于血液的生物标志物尚未探索以克服组织活检的局限性。这些发现强调了从肿瘤细胞内在机制的角度发现潜在生物标志物和开发免疫“冷”肿瘤治疗方法的重要性。
Ca2+是细胞内重要的第二信使,在细胞增殖、分化、细胞死亡以及各种细胞信号转导途径中发挥重要作用。 Ca2+信号和稳态及其对肿瘤形成、进展、转移和TME的影响引起了广泛关注越来越多的证据表明,肿瘤细胞通过改变Ca2+稳态促进多种恶性生物学行为。钙稳态的调节涉及多种分子调控机制,其中Ca2+结合蛋白是执行Ca2+相关生理功能的关键介质。值得注意的是,S100A1对于调节细胞内Ca2+信号传导和内环境稳定至关重要。S100A1包含两个EF手型Ca2+结合域,使其能够通过改变构象来响应细胞内外钙浓度的变化,并与兰尼碱受体、肌浆/内质网钙ATP酶和p53等多种靶点相互作用,从而发挥多种生物学功能。最近的研究表明,S100A1在多种类型的实体瘤中异常表达。参与细胞周期调节、凋亡、恶性侵袭和转移等生物学过程。然而,由于S100A1的免疫学和生化特性,靶向S100A1的治疗具有挑战性。S100A1不仅作为一种细胞内信号分子,而且作为一种分泌性蛋白,使治疗方法复杂化。此外,它的许多相互作用的靶点最近才被发现s100a1 -靶点复合物及其功能,特别是在调节TME、抗肿瘤免疫和增强肿瘤免疫治疗中的作用尚未完全明确。
在这项研究中,旨在评估S100A1作为免疫治疗的生物标志物和新治疗靶点的潜力。 研究发现S100A1的表达与ICB反应和患者生存率有关。功能和机制研究表征了肿瘤内在S100A1/泛素特异性蛋白酶7(USP7)/p65/GM-CSF调节轴促进M1样巨噬细胞极化中的作用,从而增强T细胞介导的抗肿瘤免疫并增强免疫治疗疗效。动物模型研究表明,S100A1是联合GM-CSF和ICI治疗免疫学“冷”肿瘤的潜在生物标志物。 研究结果强调了S100A1作为对ICB反应的预测因子的潜力,并为GM-CSF与ICB联合治疗S100A1表达升高的肿瘤提供了基本原理。
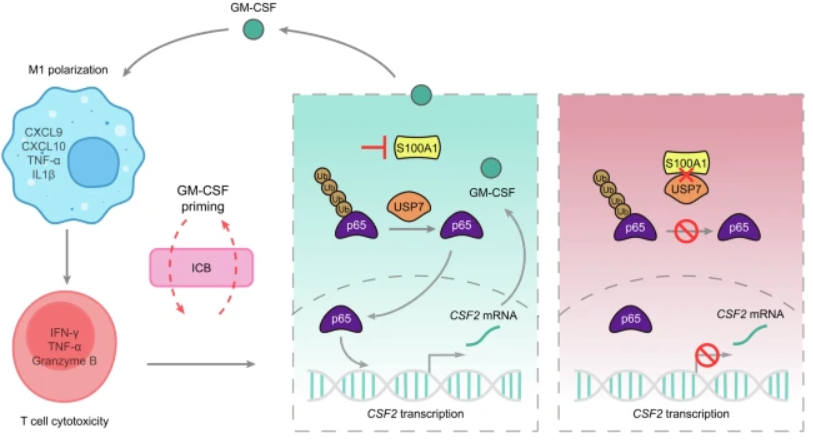
图1 描述S100A1/USP7/p65/GM-CSF调节轴在调节免疫逃逸和增强免疫治疗疗效中的总结图(摘自 Signal Transduction and Targeted Therapy )
参考消息:
https://doi.org/10.1038/s41392-025-02190-2

— END —
链接:http://www.lewenyixue.com/2025/04/07/STTT%E4%B8%A8%E4%B8%AD%E5%9B%BD%E5%8C%BB%E5%AD%A6%E7%A7%91%E5%AD%A6%E9%99%A2%E7%8E%8B%E6%B4%81-%E7%99%BD%E6%A1%A6%E5%90%88%E4%BD%9C%E7%A0%94/




 知道|国家药品不良反应监测年度报告(2024年)
知道|国家药品不良反应监测年度报告(2024年)
赶快来坐沙发