Cell重磅:华人团队开发“超声波遥控”的CAR-T细胞,精准爆破实体瘤,疗效大幅提高,脱靶毒性归零

撰文丨王聪
编辑丨王多鱼
排版丨水成文
CAR-T 细胞疗法 在白血病等 血液肿瘤 中已展现“治愈”潜力,然而,在占据癌症绝大多数的 实体瘤 中, CAR-T 细胞疗法却屡屡碰壁—— 脱靶毒性 、 T 细胞耗竭 、 疗效短暂 等问题成为难以逾越的高墙。
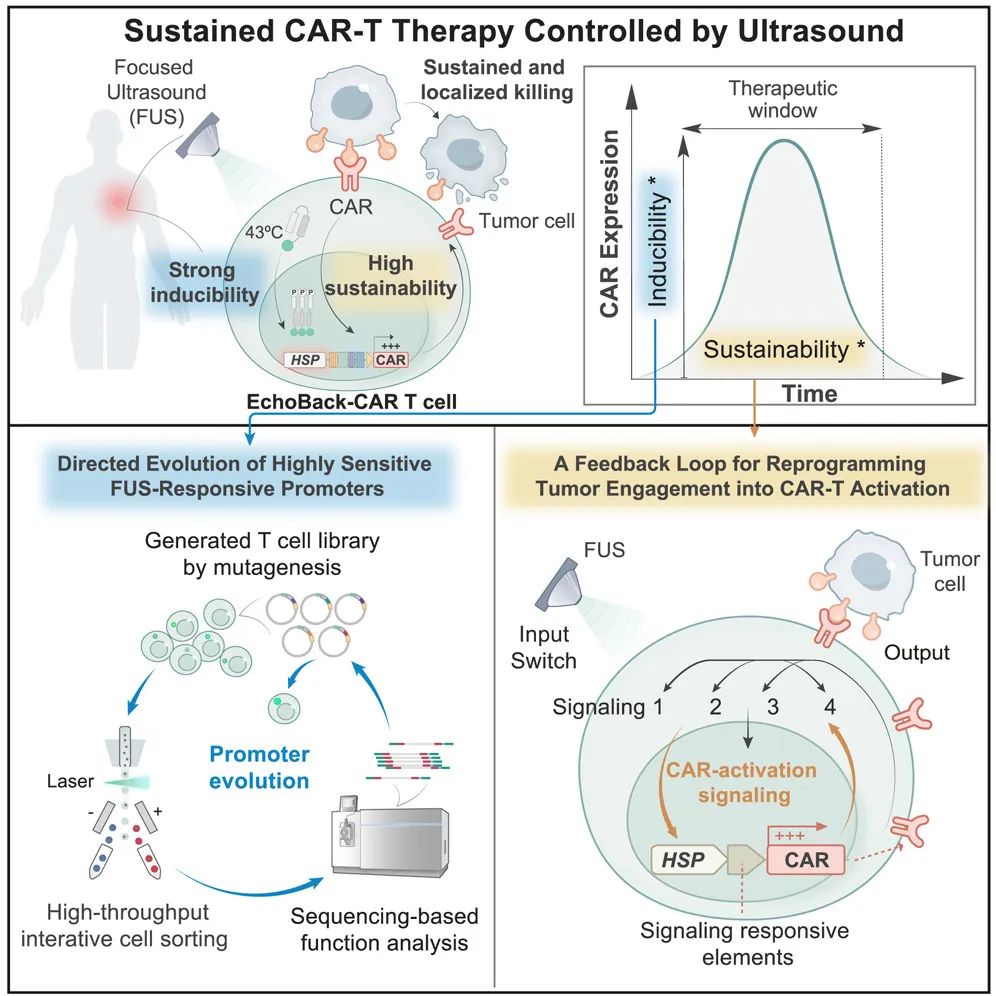
近日, Cell 期刊发表的一项突破性研究为 CAR-T 细胞治疗实体瘤带来了全新答案—— EchoBack-CAR-T 细胞 ,通过超声波遥控,让 CAR-T 细胞精准锁定肿瘤,持久发挥治疗作用,为实体瘤治疗开启了全新篇章。
2025年4 月 2 日,南加州大学 王英晓 团队 ( 刘龙伟 博士为第一作者兼共同通讯作者, 博士生 何沛祥 、 王禹萱 为共同第一作者 ) 在国际顶尖学术期刊 Cell 上 发表了题为: Engineering Sonogenetic EchoBack-CAR T Cells 的研究论文 。
该研究开发了一种基于 声遗传学 ( Sonogenetic ) 的新型 CAR-T 细胞 疗法—— EchoBack-CAR-T 细胞 ,可通过超声波精准调控,实现了对实体瘤的精准、持久治疗,且大幅提高了安全性,几乎完全消除了脱靶毒性。
传统 CAR-T 细胞疗法的困境
1、脱靶毒性 :CAR-T 细胞可能误伤正常组织,甚至引发致命副作用。
2、细胞耗竭 :持续激活会导致 T 细胞难以避免地进入“疲劳”状态,失去战斗力。
3、疗效短暂 :实体瘤的肿瘤微环境抑制 CAR-T 细胞存活,疗效难以持久。
EchoBack-CAR-T的三大技术突破
1、超声波遥控开关:找到最灵敏的“基因开关”
研究团队通过高通量筛选技术,从数百万个候选启动子中成功筛选出了超灵敏热休克启动子。这一“开关”能在 43℃ 的局部加热 (超声波精准控制) 下被激活 ( 相比传统启动子,诱导效率提升5倍,响应速度缩短至15分钟) ,驱动 CAR 蛋白的持久表达,而在正常体温下几乎无泄漏,大幅降低脱靶风险。
2、自我强化的“回声反馈”回路
CAR-T 细胞一旦识别肿瘤,其激活信号 (例如NFAT、NF-κB通路) 会被转化为持续生产 CAR 的指令,形成正反馈循环。这一设计巧妙解决了“激活即耗竭”的难题:
-
体外实验:CAR 表达可持续 3 天以上,而传统 CAR 在 24 小时内消失。
-
3D 胶质母细胞瘤模型:两次超声波刺激后,肿瘤体积缩小 90% (而传统 CAR 仅短暂抑制) 。
3、模块化设计:一石多鸟的通用平台
研究团队将同一技术应用于两种实体瘤靶点—— 胶质母细胞瘤 (靶向 GD2) 和 前列腺癌 (靶向 PSMA) ,均展现显著疗效,证明该平台可快速适配不同癌症类型。
在胶质母细胞瘤小鼠模型中 , EchoBack-hGD2CAR-T 细胞治疗组小鼠的生存力高达 100%,且未出现脱靶毒性,而对照组小鼠在 20 天内全部死亡。 单细胞测序结果显示,与传统 CAR-T 细胞相比, EchoBack-CAR-T 细胞的细胞毒性增强且耗竭减少。
在前列腺癌小鼠模型中, EchoBack-PSMACAR-T 细胞实现了长期肿瘤抑制 ( 肿瘤体积缩小80%) ,且脱靶毒性极小, 远端低表达 PSMA 的组织完全不受攻击,实现了对肿瘤组织的精准攻击。
这些结果表明,声动力型 EchoBack-CAR T 细胞可作为一种通用、高效且安全的实体瘤治疗策略。
为何更安全、更持久?
时空控制 :通过聚焦超声 (FUS) 实现仅在肿瘤局部导致升温,因此,CAR 表达限于目标区域。
周期性休整 :两次刺激间隔让 T 细胞恢复活力,避免慢性耗竭。
临床兼容性 :41℃ (模拟发烧) 下无泄漏,43℃ 短时加热不损伤正常组织。
总的来说,这项研究开发了基于声遗传学的新型 CAR-T 细胞疗法,让 T 细胞成为可远程精准操控的智能战士,解决了 CAR-T 细胞疗法在实体瘤治疗中的核心痛点。
论文链接 :
https://www.cell.com/cell/abstract/S0092-8674(25)00271-5
链接:http://www.lewenyixue.com/2025/04/07/Cell%E9%87%8D%E7%A3%85%EF%BC%9A%E5%8D%8E%E4%BA%BA%E5%9B%A2%E9%98%9F%E5%BC%80%E5%8F%91%E2%80%9C%E8%B6%85%E5%A3%B0%E6%B3%A2%E9%81%A5%E6%8E%A7%E2%80%9D/





 知道|国家药品不良反应监测年度报告(2024年)
知道|国家药品不良反应监测年度报告(2024年)
赶快来坐沙发