Cell 子刊|个性化脑瘤类器官库可以准确预测患者治疗反应
撰文 | 孙丽 责编 | 周叶斌
患者来源的肿瘤类器官(PTOs)是癌症研究重要工具,但现有的脑瘤类器官模型在成功率、功效、肿瘤微环境维持等方面存在不足,限制了其在临床反应中的应用。目前已建立的脑瘤类器官大多针对恶性胶质母细胞瘤,这些类器官虽然能够部分保留肿瘤的形态特征、细胞组成、基因组异常和侵袭性等,但未能充分模拟肿瘤细胞与正常脑组织之间的相互作用。此外,现有模型在体外培养后,免疫细胞及肿瘤相关免疫微环境细胞的数量显著减少,无法真实反映患者肿瘤的病理特征。而针对低级别胶质瘤及脑转移瘤的类器官体系仍为空白。因此需要更有效的模型来研究CNS肿瘤。
近日,来自 上海科技大学和华山医院、德国癌症研究中心 的研究团队在 Cell Stem Cell 上发表了题为 Inpidualized Patient Tumor Organoids Fully Recapitulate Human Brain Tumor Ecosystems and Predict Patient Response to Therapy 的研究论文, 该研究建立了一种新型的个性化患者肿瘤类器官模型,将患者来源的肿瘤样本与iPSC来源的脑类器官共培养, 真实再现了原发性及转移性脑肿瘤的分子病理、细胞病理和肿瘤微环境,能够精准预测患者的药物反应 。
个性化患者肿瘤类器官(IPTO)的建立及特性研究
研究人员将非解离的原发性肿瘤组织外植体,植入人诱导多能干细胞(iPSC)来源的脑类器官中,成功建立了IPTO培养体系。该体系能使肿瘤外植体在1-2周内生长融入宿主iPSC来源的类器官,且IPTO维持了肿瘤组织样的组织学特征,包括血管结构。IPTO中的肿瘤细胞表达多种神经谱系标记,细胞增殖能力与原发性肿瘤(PT)相似,还可观察到肿瘤细胞的迁移,证明IPTO能较好地维持肿瘤细胞的特性。
从不同区域的肿瘤组织获取样本生成IPTO,发现IPTO能保留肿瘤组织不同区域的特征,如肿瘤核心、肿瘤边缘等区域在细胞密度、血管生成等方面的差异,以及各区域特异性的增殖细胞和免疫细胞特征, 表明IPTO模型可忠实保留肿瘤内的空间异质性 。
使用不同类型的脑类器官(如hCOs、hMGEOs和hThOs)与肿瘤组织共培养生成IPTO。结果显示,hCOs和hMGEOs能较好地维持PT的组织学特征,hCOs中的肿瘤细胞增殖率较高;hThOs则表现出细胞密度降低、增殖减少和凋亡增加的现象。这表明未分化的脑类器官可能通过混合脑细胞谱系提供更类似大脑的环境,而分化的脑类器官更适合研究特定脑区的肿瘤调控。
对IPTO进行长期培养和传代实验,通过组织学和细胞定量分析,证实IPTO在培养过程中能保持细胞异质性,为后续长期研究和实验提供了可行性依据。
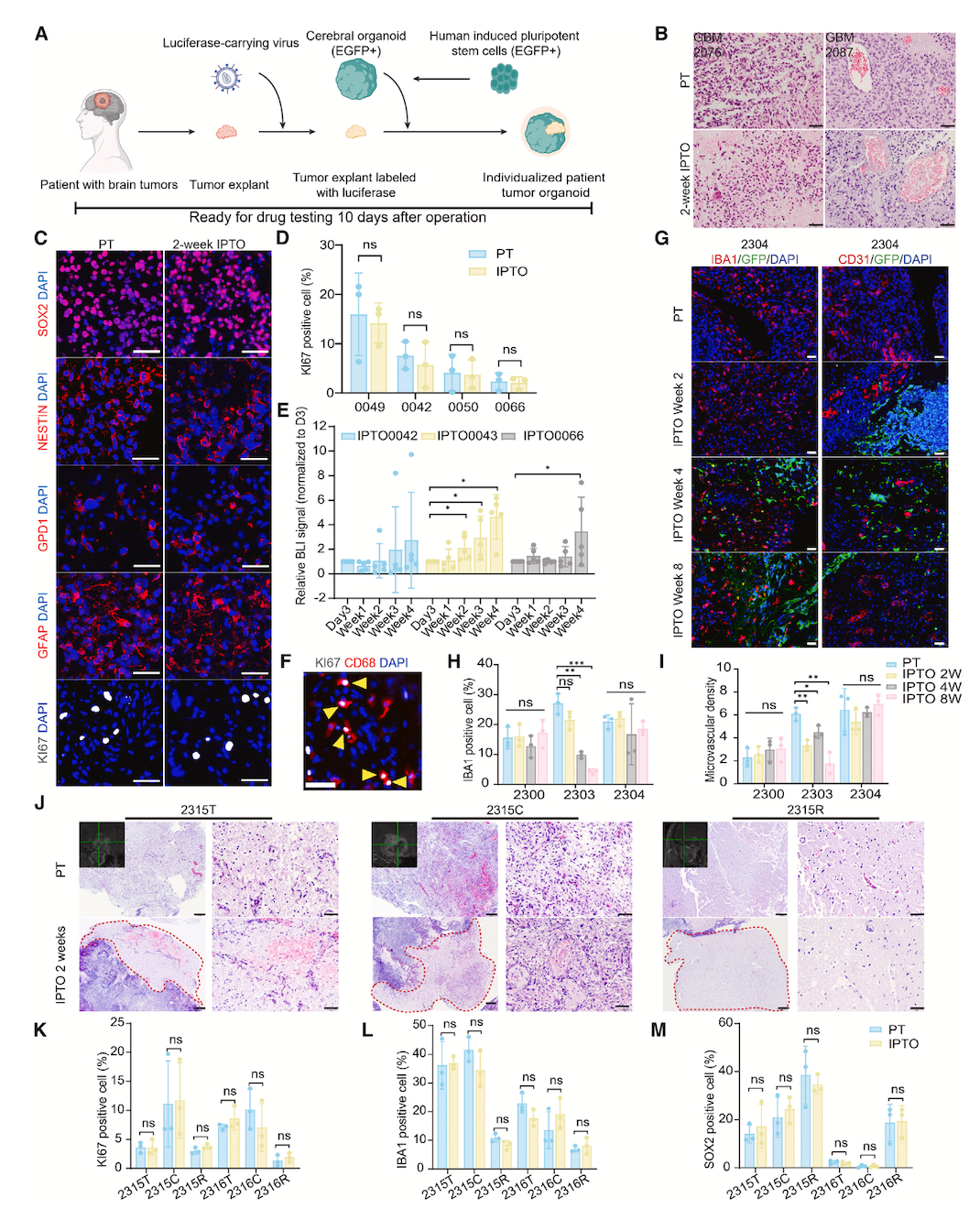
图1 IPTO的建立
IPTO 方法能广泛适用于多种肿瘤,且在多方面展现优势
将IPTO培养方法拓展到多种原发性CNS肿瘤,成功从儿童脑肿瘤(如毛细胞型星形细胞瘤、室管膜瘤、髓母细胞瘤等)和携带IDH突变的胶质瘤中生成IPTOs。这些IPTOs保留了相应肿瘤的典型病理特征,如毛细胞型星形细胞瘤的双相细胞、厚壁透明血管和嗜酸性颗粒体,室管膜瘤的室管膜管、高肿瘤细胞密度等,且IDH突变的IPTOs能表达突变蛋白并分泌相关代谢物,还表现出肿瘤细胞分裂的特性。
研究人员从黑色素瘤、肺癌、结肠癌、乳腺癌等癌症的脑转移瘤中建立了IPTOs。这些脑转移瘤来源的IPTOs能重现其原发性肿瘤的细胞病理和异质性,例如,肺癌和乳腺癌脑转移瘤来源的IPTOs保留了 CK7表达,结肠癌脑转移瘤来源的IPTOs表达上皮膜抗原(EMA)等。同时,IPTOs能稳定培养,维持内皮细胞、B细胞、T细胞和肿瘤相关巨噬细胞(TAMs),其中T细胞在脑肿瘤和脑转移瘤来源的IPTOs中的比例与原发性肿瘤相似,表明IPTOs可用于免疫治疗测试。
对比IPTO、GLICO和GBO三种模型,使用10例患者肿瘤组织进行实验。结果显示,IPTO模型在维持肿瘤病理、免疫微环境和微血管方面表现更优。 IPTOs的形态更规则,与原发性肿瘤的组织学相似性更高,能更好地维持肿瘤细胞的增殖能力、免疫细胞比例和微血管密度 。 而GBO模型在培养部分肿瘤时存在形态差异大、生长信号弱等问题,GLICO模型则难以直接区分肿瘤细胞,且在维持肿瘤微环境方面存在不足。

图2 其他CNS肿瘤和颅内转移瘤的IPTOs的建立
IPTOs 保留 PT 基因组和分子水平病理特征
对9对IPTOs和患者来源的原发肿瘤组织(parental Tumors, PTs)进行全外显子测序(WES),结果显示IPTOs与PTs有相似的肿瘤体细胞突变和拷贝数变异(CNVs)。这表明在基因序列和染色体水平上,IPTOs能够忠实反映PTs的基因组情况,为后续研究肿瘤的遗传特征提供了可靠模型。运用DNA甲基化EPIC阵列分析,通过主成分分析(PCA)发现IPTOs在DNA甲基化层面与PTs紧密聚类。PC1和PC3能够区分IDH野生型和突变型样本,且IPTOs在长期培养过程中保持与PTs相似的DNA甲基化模式。 这意味着IPTOs在表观遗传层面也能很好地模拟PTs,有助于研究肿瘤的表观遗传调控机制 。 使用基于DNA甲基化的CNS肿瘤分类器对IPTOs进行分类,t-SNE分析表明IPTOs紧密聚集在其对应的PT周围,维持了PT的分子亚型信息,涵盖多种肿瘤类型。这进一步证实IPTOs在分子水平上与PTs的高度一致性,对深入研究不同分子亚型肿瘤的特性和治疗策略具有重要意义。
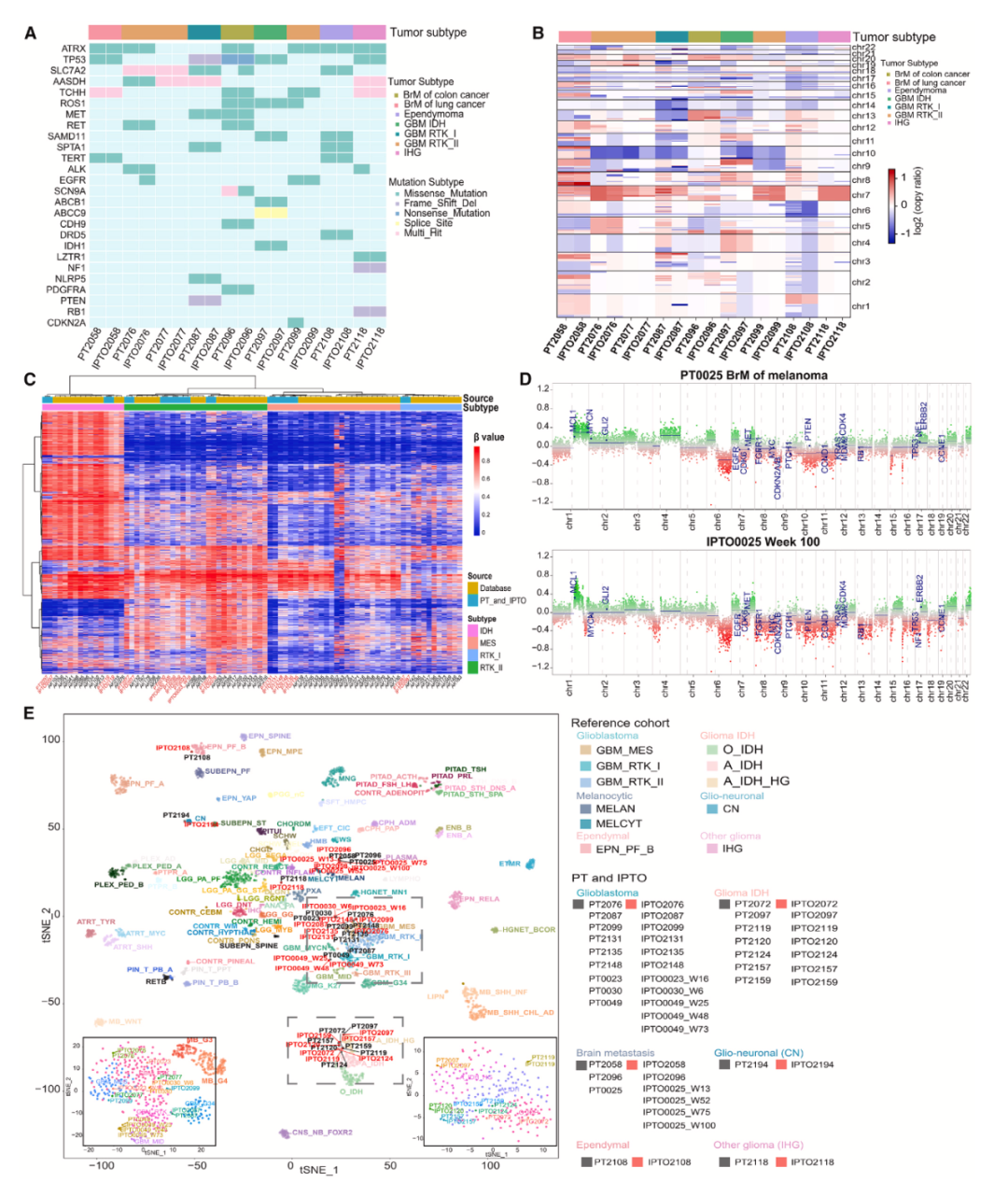
图3 IPTO可以保持患者原发肿瘤(PTs)的基因组图谱特征
在单细胞水平,IPTOs能够维持患者肿瘤的细胞和分子异质性
对包括GBM、LGG和BrM在内的十对IPTOs和PTs进行scRNA-seq分析,发现IPTOs中含有与PT相同的细胞群体,涵盖肿瘤细胞和基质细胞,并且在脑转移瘤来源的IPTOs中也证实了T细胞和B细胞的存在,这表明IPTOs在细胞组成上能维持异质性。
研究人员依据已发表的标记基因,在GBM的IPTOs中鉴定出了与PTs一致的所有细胞类型,如少突胶质细胞祖细胞(OPC)样、神经祖细胞(NPC)样等细胞类型,且IPTOs中GBM细胞亚型的比例与PTs相似,进一步证明IPTOs在肿瘤细胞亚型层面维持了PT的异质性。
通过研究TAM和T细胞的特征基因表达,发现IPTOs和PT中这些基因的表达具有显著一致性,并且IPTOs和PT中免疫细胞的比例呈显著正相关,说明IPTO在免疫相关基因表达和免疫细胞比例方面也能维持PT的特征。
通过计算不同样本间分布的距离评估肿瘤异质性,结果显示IPTO之间以及PT之间的距离分布相似,而IPTO与对应PT之间的距离更短,表明IPTO与PT具有很高的相似性,能够高度重现PT的肿瘤异质性。同时,与其他模型(如PDEs)相比,IPTO在维持患者肿瘤异质性方面表现更优。
对IPTO和PT样本中的肿瘤细胞进行差异表达分析,发现IPTO中仅有少量基因上调或下调,且这些基因集表明IPTO样本所处环境压力较小,这解释了IPTOs养成功率高的原因,同时说明IPTO 的培养环境对肿瘤细胞的基因表达影响较小,有利于维持PT的分子特征。
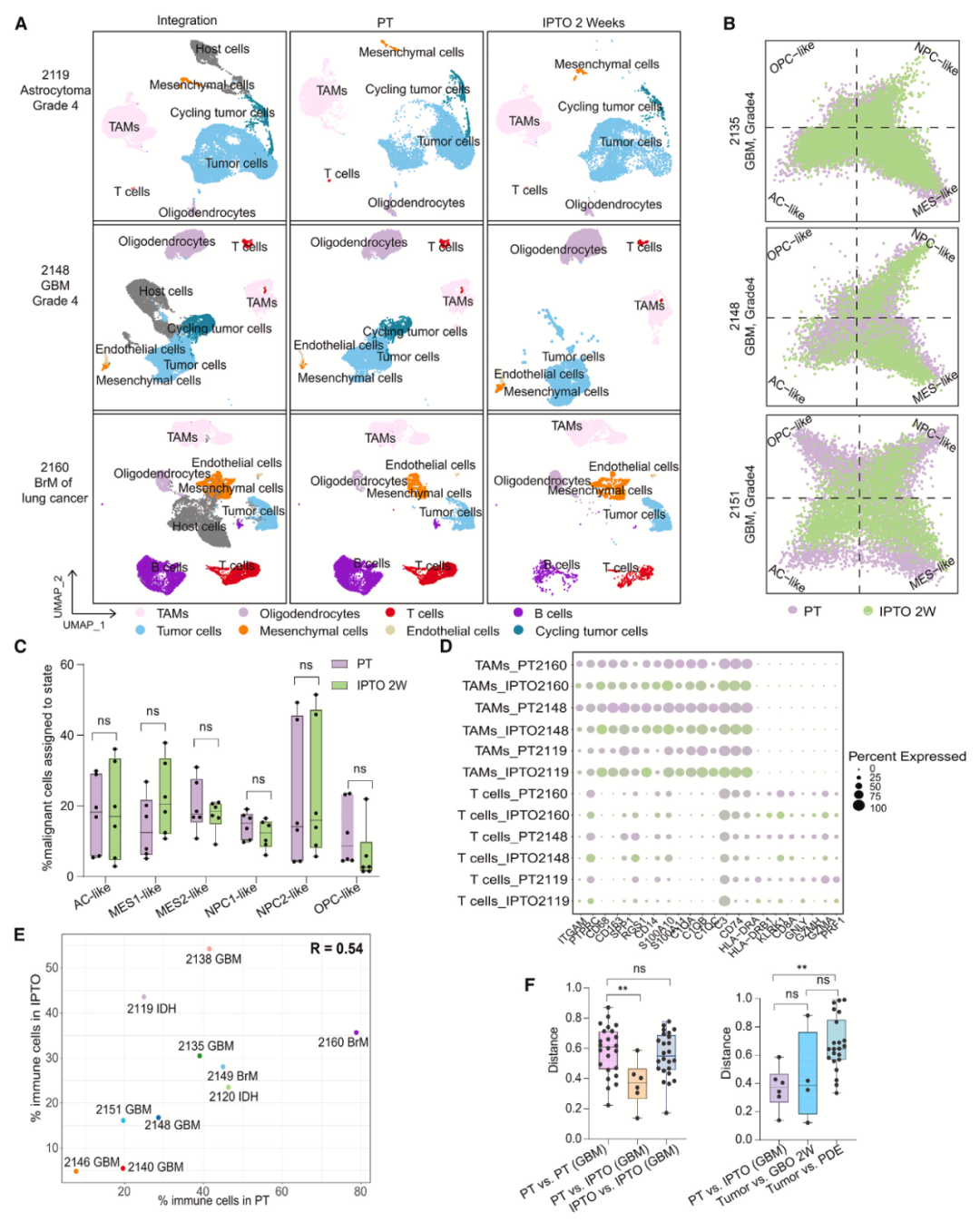
图4 在单细胞水平,IPTOs可以保持PTs在细胞和分子水平的异质性
IPTOs 可以预测患者对替莫唑胺(TMZ)治疗的反应
作者对35例患者的肿瘤样本进行IPTOs培养,并在IPTOs上进行TMZ药物测试。以生物发光信号变化定义IPTOs对TMZ的敏感性,同时分析患者肿瘤样本的MGMT启动子甲基化状态。结果显示,IPTOs对TMZ的反应能够准确预测患者对TMZ治疗的反应,IPTOs敏感的患者进展生存期(PFS)和总生存期(OS)均优于IPTOs耐药的患者,且IPTOs荧光素酶信号的变化与患者PFS呈强烈负相关,表明IPTOs在预测患者对TMZ治疗反应方面具有较高准确性。
评估预测患者对TMZ治疗反应的能力时,发现MGMT启动子甲基化状态在预测患者对TMZ治疗反应方面不如IPTOs的反应准确。这意味着IPTOs在指导临床治疗决策方面可能具有更大的价值。
作者还对非小细胞肺癌脑转移患者来源的IPTOs进行了靶向治疗药物测试。对于携带EGFR L858R或T790M突变的患者,使用奥希替尼治疗,结果显示,IPTOs对奥希替尼的反应与患者的临床结果一致,进一步证明IPTOs在预测患者对不同治疗药物反应方面的有效性,可作为评估患者对靶向治疗敏感性的有效模型。

图5 IPTOs可以预测患者对药物的反应
IPTOs 揭示药物反应及耐药机制
以替莫唑胺(TMZ)处理来自三位胶质母细胞瘤(GBM)患者的IPTOs,通过生物发光成像(BLI)信号变化判断反应。结果显示,IPTO2169对TMZ敏感,而IPTO2167、IPTO2190表现耐药。单细胞RNA测序(scRNA-seq)分析发现,TMZ处理后,所有样本中NPC样肿瘤细胞比例下降,表明其对TMZ敏感;但AC样和MES样肿瘤细胞比例增加,意味着这类干细胞样细胞对TMZ耐药。
研究确定了对TMZ敏感和耐药的细胞簇及其相关基因。敏感簇表达如GAD2、DLX6-AS1等基因,耐药簇则富含SPP1、FTL等基因。对TCGA和CGGA数据库分析发现,患者中敏感相关基因富集的OS明显更好,验证了从IPTO药物反应分析中发现的基因特征与患者预后相关。
运用CellChat分析TMZ处理后的细胞间通讯变化,发现TMZ处理的肿瘤细胞中SPP1-CD44、PTN-PTPRZ1和APP-CD74等信号通路上调,且在TAMs中也观察到这些通路的上调,尤其是SPP1-CD44和APP-CD74相互作用。此外,TMZ处理还介导了TAM-肿瘤细胞相互作用的增强,表明TMZ处理的细胞可能通过上调TAM-肿瘤细胞通讯通路获得耐药性。
用PLX5622(一种CSF1R抑制剂)处理IPTOs,发现低浓度时虽未诱导生物发光信号降低,但下调了CSF1-CSF1R信号通路相关基因。高浓度处理时,免疫荧光染色和定量分析显示IBA1阳性TAMs和KI67阳性增殖细胞数量呈浓度依赖性减少,同时肿瘤细胞状态发生变化,NPC样肿瘤细胞减少,AC样和MES样肿瘤细胞增多,且诱导了与胆固醇生物合成相关基因的表达,表明GBM细胞代谢活动发生重编程。
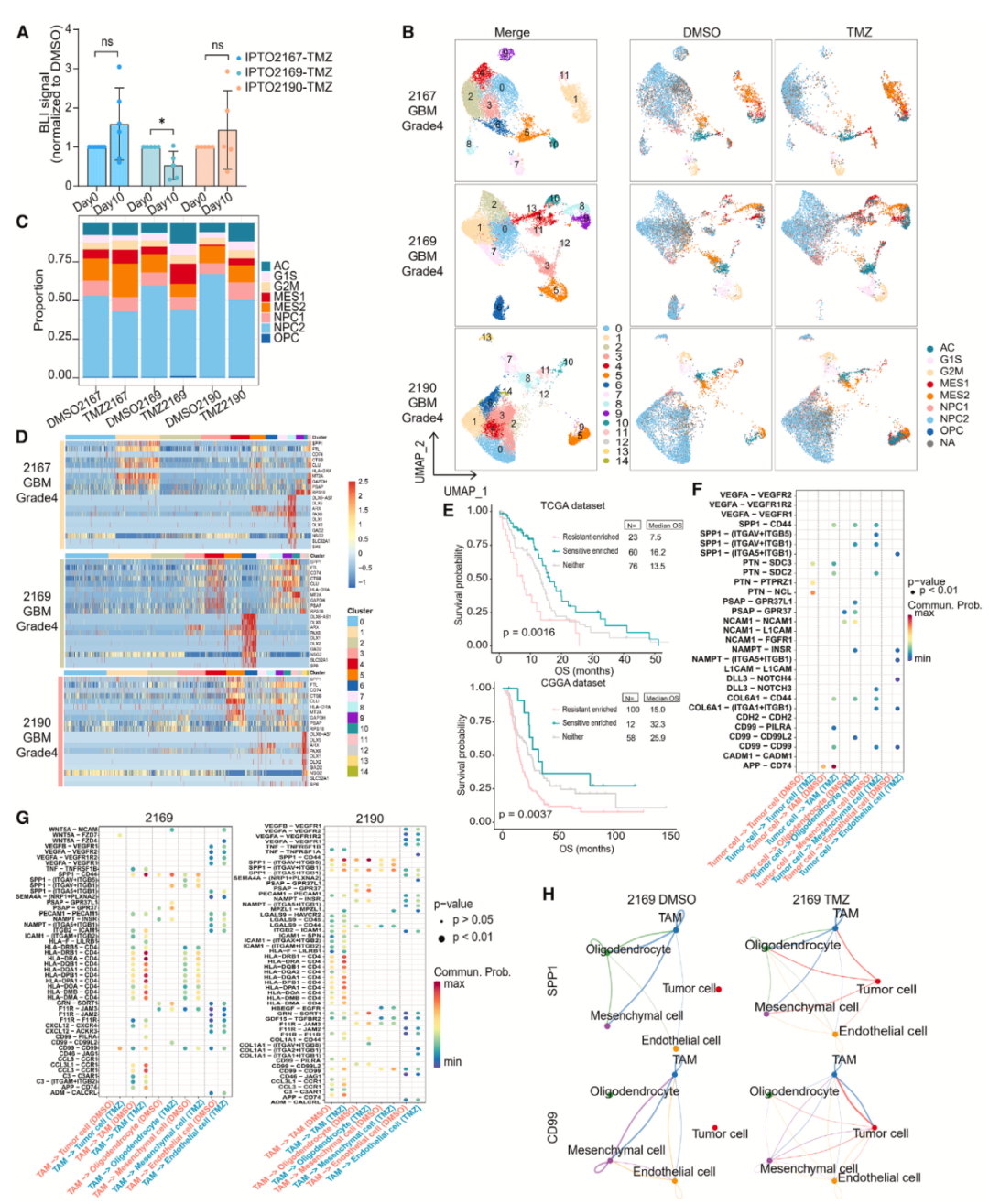
图 6 IPTOs可以在单细胞水平揭示药物反应的机制
文章建立的个性化患者肿瘤类器官模型(inpidualized patient tumor organoid, IPTO),通过创新性地将非解离的患者来源的肿瘤样本植入诱导多能干细胞(iPSC)衍生的脑类器官中并共培养,成功再现了肿瘤的细胞异质性和分子特征,并能够预测患者的药物反应。 IPTO模型具有快速高效、适用范围广、能维持肿瘤微环境和准确预测患者药物反应等优点,为脑癌研究提供了一个强大的工具,有望推动个性化癌症治疗的发展 。
撰文
责编
制作
排版 | Sheila 校对 | uu
▼滑动查看更多▼
DOI: 10.1016/j.stem.2025.01.002
链接:http://www.lewenyixue.com/2025/04/07/Cell%20%E5%AD%90%E5%88%8A%EF%BD%9C%E4%B8%AA%E6%80%A7%E5%8C%96%E8%84%91%E7%98%A4%E7%B1%BB%E5%99%A8%E5%AE%98%E5%BA%93%E5%8F%AF%E4%BB%A5%E5%87%86/







 知道|国家药品不良反应监测年度报告(2024年)
知道|国家药品不良反应监测年度报告(2024年)
赶快来坐沙发