脑瘤的“社交网络”:癌细胞如何“策反”神经元为其打工?
最凶险的脑瘤,为何难以根治? 胶质母细胞瘤 ( GBM ) 是颅内最常见的恶性原发肿瘤,占所有胶质瘤的 57% ,占 中枢神经系统( CNS ) 原发恶性肿瘤的 48% 。尽管针对 GBM 的多模态综合治疗包括手术、放疗、系统治疗(化疗、靶向治疗),在近年取得很大进步,但是由于细胞异质性,胶质母细胞瘤的侵袭性以及对标准治疗的抵抗 , GBM 的总体生存期短,长期生存患者罕见。 近日, 由 Svenja K. Tetzlaff 及其团队的研究成果,发表于《 Cell 》杂志( 2025 年 1 月 23 日) , 旨在揭示胶质母细胞瘤( glioblastoma, GB )与神经网络之间的复杂关系。 近年来,肿瘤细胞与神经网络之间的相互作用成为研究热点,尤其是通过突触连接促进肿瘤的侵袭和进展的机制。然而,由于缺乏合适的技术手段,此类网络的具体特征仍未完全明确。本文通过改良狂犬病毒介导的 逆行示踪技术 ,全面解析了神经元 - 肿瘤网络,并探索其在治疗中的潜在应用。

一、 逆行追踪技术在 GBM 神经元 - 肿瘤网络表征中的应用
1 、 标记与追踪:
通过注射 逆行示踪剂(如荧光染料、病毒载体等) 至 GBM 周围脑组织,可以标记与肿瘤有联系的神经元。这些示踪剂能够沿神经元轴突逆向运输至胞体,从而在显微镜下清晰显示神经元与肿瘤之间的连接。
首先, 研究者们 稳定地转导了胶质母细胞瘤球体(图 1B )使用含有 EnvA 受体 TVA (亚群 A 禽白血病病毒的细胞受体)的 慢病毒 ,用于狂犬病毒进入, 狂犬病毒糖蛋白( oG ) 用于跨互补和传播,以及胞质表达的荧光蛋白 mCherry ( STAR 方法)。 其次,进行了 荧光激活细胞分选( FACS ) ,针对 mCherry 来分离表达 TVA 和 oG 的胶质母细胞瘤细胞。随后,这些细胞被转导了两种伪型化的 EnvA 假病毒 G 蛋白缺失(Δ G )狂犬病毒株,这两种病毒株表达了仅能感染含 TVA 受体的胶质母细胞瘤细胞的胞质 GFP 。 一旦进入并通过狂犬病毒 -oG 蛋白的跨互补,起始的胶质母细胞瘤细胞( GBStarter )预计通过单突触逆向传播标记与肿瘤连接(连接 TUM )的神经元。 连接 TUM 的神经元可以通过表达 GFP 来识别,而患者来源的 GBStarter 细胞同时表达了 mCherry 和 GFP 。此外,由于连接 TUM 的神经元不表达 oG ,因此不可能进一步传播,确保了这种方法对直接连接的神经元 - 肿瘤网络标记的 高度特异性 (图 1A )。
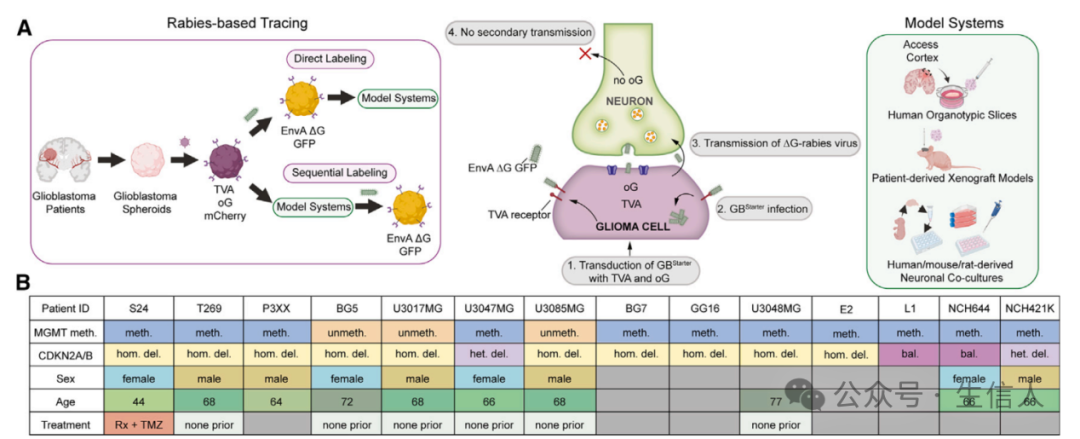
图 1. 基于狂犬病毒的胶质母细胞瘤神经元 - 肿瘤网络追踪
2 、 模型系统的构建 :
为了 评估了这种方法在各种模型系统中的应用。 研究者们建立一个完全 基于人类组织的模型系统 ,采用了一种 器官型切片培养技术 ,使用了手术过程中切除的人类前额叶皮质组织(图 2A )并将 GBStarter 细胞移植到标记人类连接的 TUM 神经元上。这种方法允许对连接的 TUM 神经元进行 超微结构表征 ,包括不同类别的 树突棘 (图 2A 、 2B )。重要的是,连接的 TUM 神经元保持了它们特有的电生理特性(图 2C 、 2D )。并且这项技术具有特异性,因为在共培养中用裂解的 GBStarter 细胞标记或在 PDX 模型 中标记时几乎没有标记发生,活细胞成像在 PDX 和共培养模型中显示了胶质母细胞瘤细胞的快速且动态增加的神经元整合。值得注意的是,在共培养中, GBStarter 细胞在变成 GFP 阳性后数小时内就出现了连接到 TUM 神经元的标记(图 2E )。在 PDX 模型 中,这种标记发生在 1 到 3 天之间,证明了神经元 - 肿瘤连接的快速形成。出乎意料的是,在某些早期胶质母细胞瘤定植的患者来源模型中,大多数标记为 connectedTUM 的肿瘤细胞簇与神经元相连,表明神经元 - 肿瘤结构连接水平较高(图 2F )。研究者们对疑似连接的 TUM 神经元和胶质母细胞瘤细胞在共培养中的全细胞 patch-clamp 电生理进行了配对研究(图 2G ),以检查它们的功能连接性(图 2H-2J )。连接的 TUM 神经元的动作电位与胶质瘤细胞中的 兴奋性突触后电流( EPSCs ) 或 自发性抑制性电流( SICs ) 相关(图 2K ),这表明连接的 TUM 神经元与其对应的 GBS 起始细胞之间存在功能连接。

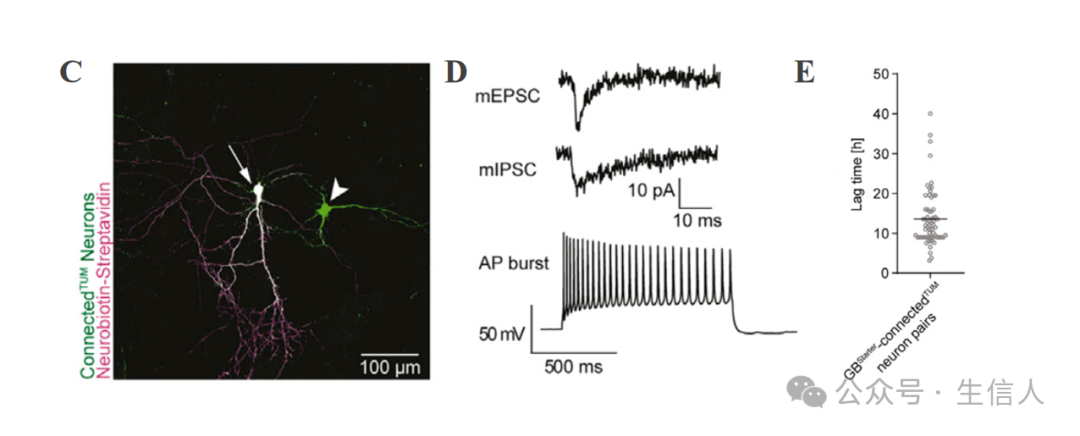

图 2. 神经元 - 肿瘤网络的功能研究
3 、 分子机制探索:
结合分子生物学技术,如 RNA 测序、蛋白质组学等,可以深入分析 GBM 神经元 - 肿瘤网络中关键分子的表达和功能。这有助于揭示神经元如何影响 GBM 的生长、侵袭以及治疗抵抗性的分子机制。
研究者 对人类类器官切片进行了 空间转录组学分析 ,并对共培养进行了 单细胞 RNA 测序 ,在这些实验中 研究者们 研究了连接型 TUM 和非连接型 TUM 神经元亚群的分布(图 3 A –3 D STAR 方法)。 这种方法在所有神经元簇中识别出了一致的连接型 TUM 与非连接型 TUM 神经元比例,表明肿瘤细胞广泛整合到神经网络中,与神经元亚群无关(图 3E 和 3F )。 随着患者特异性和肿瘤细胞状态驱动的异质性是胶质母细胞瘤的一个标志, 研究者们 调查了驱动神经元 - 肿瘤连接的肿瘤内在机制 并整合了通过 逆向追踪分析神经元 - 肿瘤连接 、 PDX 的组织学肿瘤生长模式 以及 来自胶质母细胞瘤患者和 PDX 模型的单细胞 RNA 测序数据 ,以检查这些模型的功能连接性。为了评估来自不同患者来源模型的细胞形成突触网络的能力,研究者们使用与突触发生相关的基因本体( GO )术语的基因来计算单细胞 RNA 测序数据的 突触发生模块评分 ( STAR 方法)。此外,使用基于 单细胞 RNA 测序的侵袭性评分 ,该评分与胶质母细胞瘤患者和患者来源模型中的侵袭性生长相关(图 3G 和 3H )。有趣的是, 具有高突触发生评分的模型也显示出高的侵袭性评分 (图 3I 和 3J )。与这些数据一致,具有高突触发生和侵袭性评分的患者来源模型比那些评分较低的模型显示出显著的平均体动速度(图 3K 和 3L )。肿瘤模型中更倾向于侵袭性的模型也表现出更大的神经元连接性。
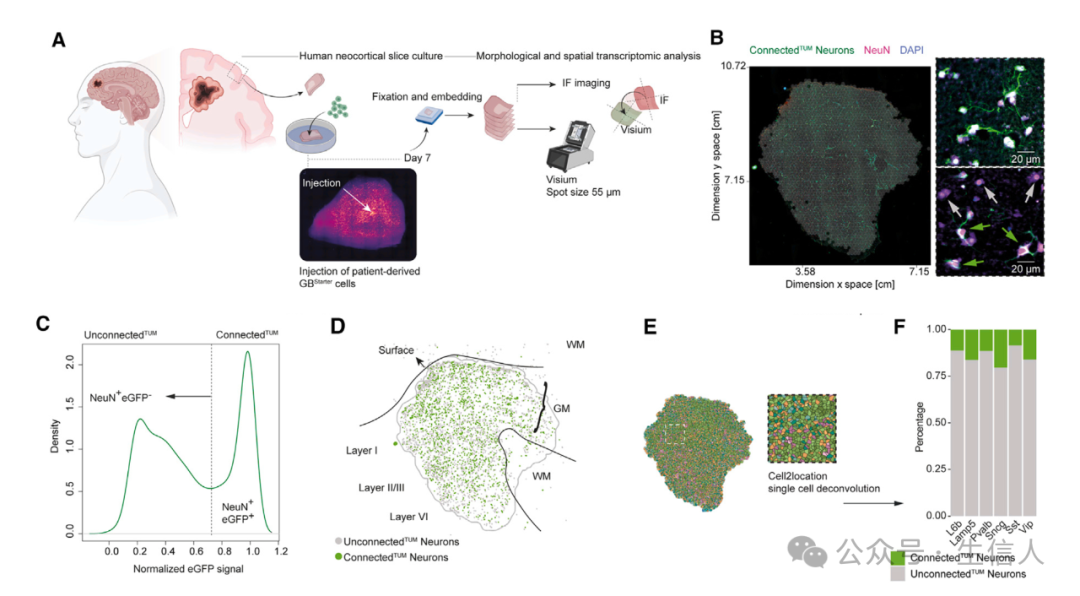
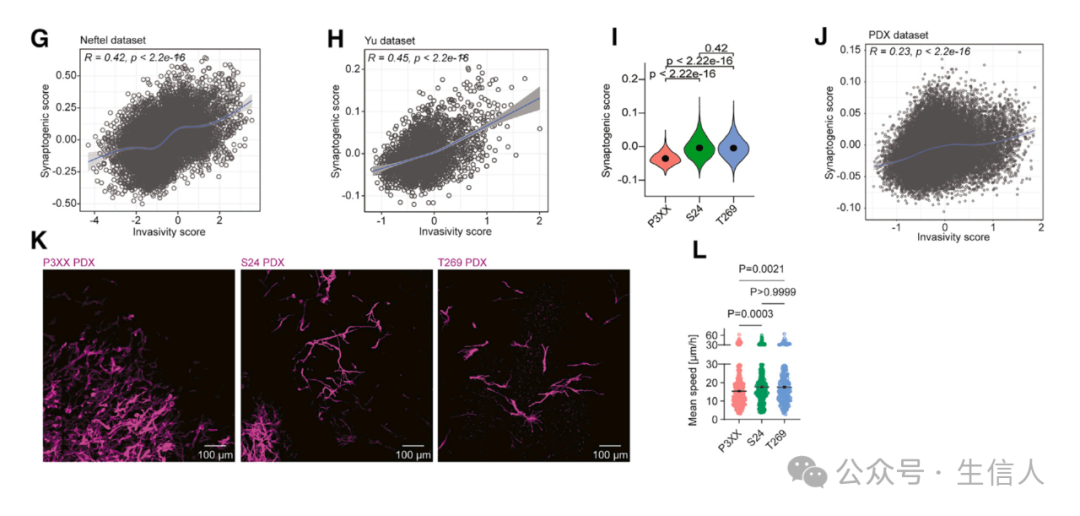
图 3. 神经元到肿瘤网络的神经元可塑性和行为效应
二、 逆行追踪技术在 GBM 治疗中的应用前景
1、 定位肿瘤相关神经网络的连接通路 : 识别肿瘤侵袭的关键神经环路,辅助制定手术或放疗的精准靶区。
2、 靶向药物递送系统的开发 : 递送凋亡诱导剂或溶瘤病毒至肿瘤相关神经元,选择性切断促癌信号。
3、 阻断神经元 - 肿瘤交互的促癌信号 : 结合示踪技术开发抗体或小分子抑制剂,阻断神经元来源的肿瘤支持信号。
4、 个性化治疗与预后评估 : 建立基于神经网络特征的分子分型,指导靶向治疗或免疫治疗策略 ; 建立基于神经网络特征的分子分型,指导靶向治疗或免疫治疗策略 。
三、 结论与展望
本研究从多角度揭示了神经元 - 肿瘤网络在胶质母细胞瘤进展中的关键作用,为探索靶向治疗提供了新思路:
科学意义: 通过整合分子生物学、神经科学和肿瘤学技术,深化了对胶质母细胞瘤侵袭机制的认识,为未来神经 - 肿瘤相互作用的研究奠定了基础。
临床应用价值: 提出了一种基于狂犬病毒的精准示踪和干预平台,展示了其在胶质母细胞瘤患者个性化治疗中的潜力。
未来,研究需进一步探讨神经元 - 肿瘤网络的动态变化及其在不同疾病阶段的作用,并优化病毒系统以减少潜在的神经毒性,从而推进该平台在临床转化中的应用。
链接:http://www.lewenyixue.com/2025/04/07/%E8%84%91%E7%98%A4%E7%9A%84%E2%80%9C%E7%A4%BE%E4%BA%A4%E7%BD%91%E7%BB%9C%E2%80%9D%EF%BC%9A%E7%99%8C%E7%BB%86%E8%83%9E%E5%A6%82%E4%BD%95%E2%80%9C%E7%AD%96%E5%8F%8D%E2%80%9D%E7%A5%9E/




 知道|国家药品不良反应监测年度报告(2024年)
知道|国家药品不良反应监测年度报告(2024年)
赶快来坐沙发