抗肿瘤产品2025:16款ADC、17款双抗、12款CAR-T
【ADC、双抗、CAR-T】

【史上最全ADC、双抗、CAR-T产品大盘点】
随着癌症治疗的不断突破,一些革命性的疗法正在快速发展,成为癌症治疗的新希望。在众多创新疗法中,抗体药物偶联物(ADC)、双特异性抗体(BiTEs)和CAR-T疗法,无疑是近年来最为瞩目的亮点。它们在全球范围内的临床试验中取得了显著进展,部分疗法已经获得批准,进入临床应用。今天,我们将深入探讨这些前沿抗肿瘤治疗产品,看看它们如何重塑癌症治疗的未来。
阅读指南
1、ADC—精准治疗的新时代
2、双特异性抗体—双重打击,精准杀癌
3、CAR-T疗法—颠覆血液肿瘤治疗格局
4、总结与展望

ADC—精准治疗的新时代
ADC疗法通过“生物导弹”模式精准递送细胞毒素,已成为实体瘤和血液肿瘤治疗的颠覆性力量。2025年,全球ADC赛道迎来爆发,16款药物覆盖HER2、Trop-2、CLDN18.2等靶点,技术迭代与应用边界持续突破。
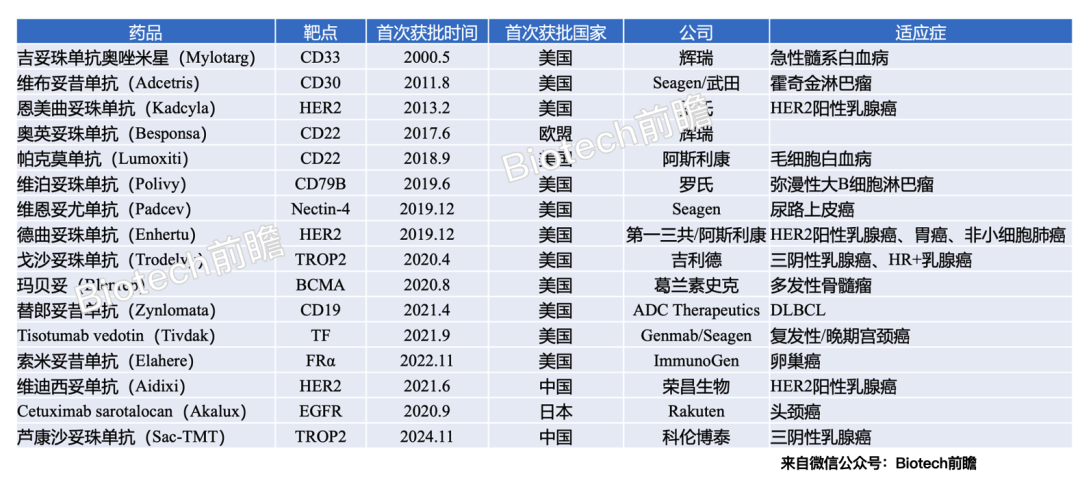
一、经典ADC王者:改写治疗指南
1. Enhertu(德喜曲妥珠单抗,DS-8201)
靶点:HER2(覆盖高/低表达)
适应症:HER2阳性乳腺癌、胃癌、非小细胞肺癌(NSCLC)
关键数据:
HER2低表达乳腺癌:DESTINY-Breast04试验中,中位PFS 9.9个月 vs 化疗组 5.1个月(HR=0.50),总生存期OS延长 6.6个月。
HER2阳性胃癌:ORR 51%,中位OS 12.5个月(标准化疗组仅8.4个月)。
2. Trodelvy(戈沙妥珠单抗,Sacituzumab govitecan)
靶点:Trop-2(实体瘤广谱靶点)
适应症:三阴性乳腺癌(TNBC)、尿路上皮癌(UC)
疗效亮点:TNBC患者中位OS 11.8个月 vs 化疗组 6.9个月(ASCENT试验),死亡风险降低 49%。
3. Padcev(维恩妥尤单抗,Enfortumab vedotin)
靶点:Nectin-4(尿路上皮癌高表达)
适应症:局部晚期/转移性尿路上皮癌(联合Keytruda一线治疗)
数据突破:EV-302试验中,联合组中位PFS 12.5个月 vs 化疗组 6.3个月,OS延长至 31.5个月(化疗组16.1个月)。
二、新兴靶点ADC
1. CLDN18.2 ADC(如CMG901、AZD0901)
靶点:Claudin 18.2(胃癌、胰腺癌高表达)
2025进展:CMG901(康诺亚/乐普)在胃癌中确认ORR 42%,DCR 75%,预计年内获批。
2. B7-H3 ADC(如DS-7300、MGC018)
靶点:B7-H3(泛癌种免疫检查点)
潜力领域:小细胞肺癌(SCLC)、前列腺癌、肉瘤。
早期数据:DS-7300治疗SCLC的ORR 52%,中位DOR 5.6个月。
3. HER3 ADC(如HERTHENA-Lung01)
靶点:HER3(NSCLC等耐药相关靶点)
核心突破:针对EGFR-TKI耐药NSCLC,Patritumab deruxtecan的ORR 29.8%,中位PFS 6.4个月。
三、ADC技术革命:从结构优化到多抗整合
1. “智能连接子”降低毒性
案例:Dato-DXd(Datopotamab deruxtecan)采用可裂解连接子,在TROP2阳性NSCLC中将≥3级间质性肺病发生率降至 <3%(传统ADC约10%-15%)。
2. 双抗ADC崛起
BL-B01D1(EGFR×HER3双抗ADC):实体瘤ORR 45.3%,肺癌亚组ORR 63.2%,预计2026年申报上市。
靶向模式:双靶点结合增强肿瘤选择性,减少脱靶毒性。
3. 核素ADC(放射性偶联药物,RDC)
177Lu-PSMA-617(Pluvicto):治疗前列腺癌,OS延长 4个月(传统疗法15个月 vs Pluvicto 19个月)。
创新方向:放疗与ADC融合,强化局部杀伤。


双特异性抗体—双重打击,精准杀癌
所谓的双特异性抗体是经过工程化设计的,可以同时结合两种不同抗原或表位。这些抗体由于能够增强肿瘤选择性并招募免疫细胞到肿瘤部位,因此在肿瘤免疫治疗中成为下一代的潜力疗法。
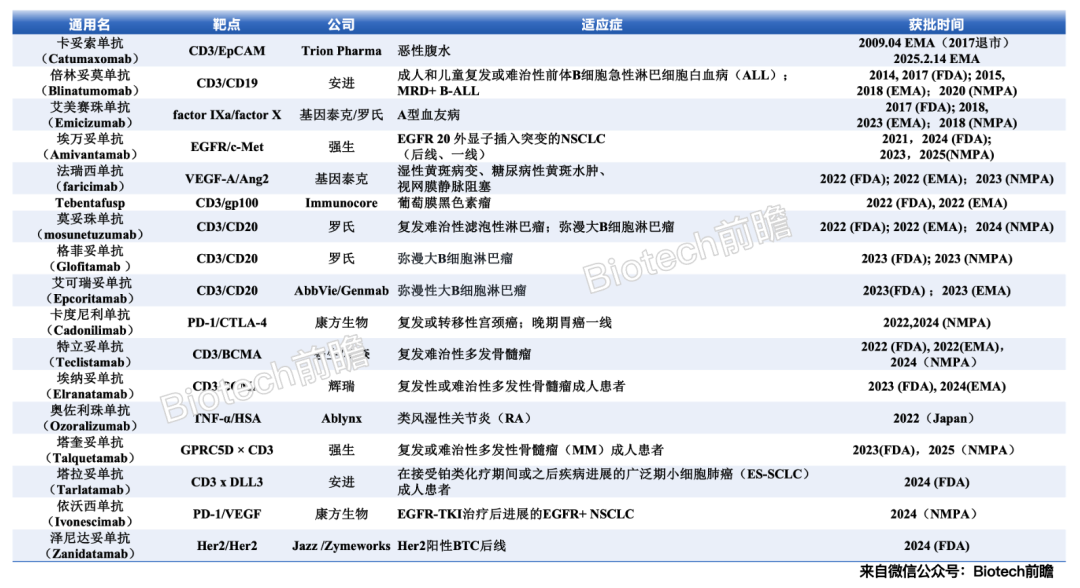
目前超过200种双特异性抗体在临床前或临床评估阶段,其中许多是免疫细胞招募者(TCEs)。
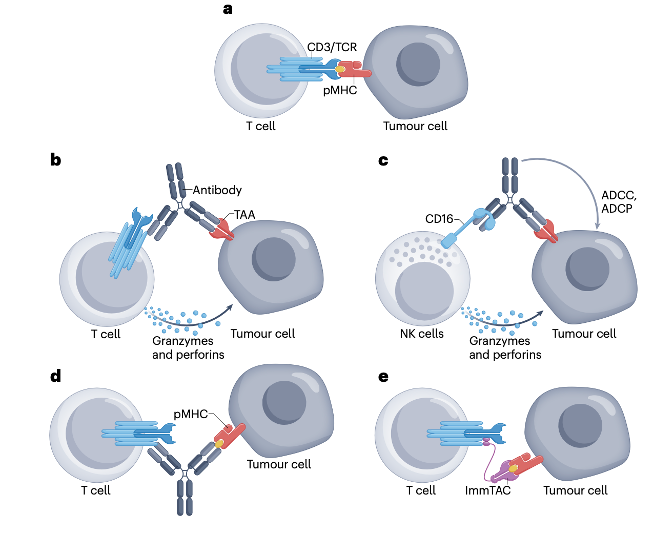
免疫细胞激活双特异性抗体及其作用机制
近年来,国内药企在双抗领域的突破正引发全球制药巨头的密集关注。依托差异化的靶点布局和工程化技术优化,以康方生物、信达生物、科伦博泰和普米斯生物为代表的中国创新力量,已通过数笔高额BD(业务发展)交易,将双抗管线推至国际舞台中央,成为全球新药研发版图上的新势力。
从康方到普米斯:中国双抗“出海”浪潮
2022年底,康方生物以50亿美元的潜在交易总额,将其PD-1/VEGF双抗AK112(依沃奇单抗)的美国、欧盟及日本权益授权给美国公司Summit Therapeutics,创下国产创新药单药授权金额的最高纪录。这并非孤例—普米斯生物的PD-L1/VEGF双抗PM8002也备受关注,其于2024年3月1日被纳入突破性治疗品种名单,适应症为联合白蛋白结合型紫杉醇一线治疗不可手术的局部晚期/复发转移性三阴性乳腺癌。普米斯还与BioNTech达成合作协议,将PM8002的大中华区外全球权益授权给后者,总金额超10.55亿美元。
据不完全统计,2023年国内双抗领域License-out交易总额已突破30亿美元,占中国创新药全年BD交易额的近四成。
为何双抗成全球交易“硬通货”?
全球药企对中国双抗的追捧,核心动力来自技术协同与临床价值的双重红利。一方面,国内企业通过灵活的双抗技术平台(如康方的Tetrabody、百利药业的SMART-Ig),快速构建起差异化的靶点组合——例如康方的PD-1/VEGF双抗,凭借单药替代“PD-1+贝伐珠单抗联合疗法”的潜力,在晚期肺癌、宫颈癌等适应症中疗效直接对标甚至超越K药(Keytruda)。另一方面,双抗的分子设计可突破单抗专利壁垒,为国际大药厂规避专利到期后的市场下滑风险。罗氏、默沙东等企业已明确将双抗视为PD-(L)1之后的核心免疫治疗迭代方向,而中国研发团队的效率和成本优势,恰好为其提供了最佳“技术外包”路径。


CAR-T疗法—颠覆血液肿瘤治疗格局
CAR-T疗法(嵌合抗原受体T细胞疗法)自问世以来,已经彻底改变了血液癌症的治疗格局。它通过将患者的T细胞进行基因工程改造,使其能够识别并攻击肿瘤细胞,从而实现个性化的治疗效果。CAR-T疗法已经取得了显著的疗效,尤其在治疗复发或难治性血癌中表现出惊人的效果。
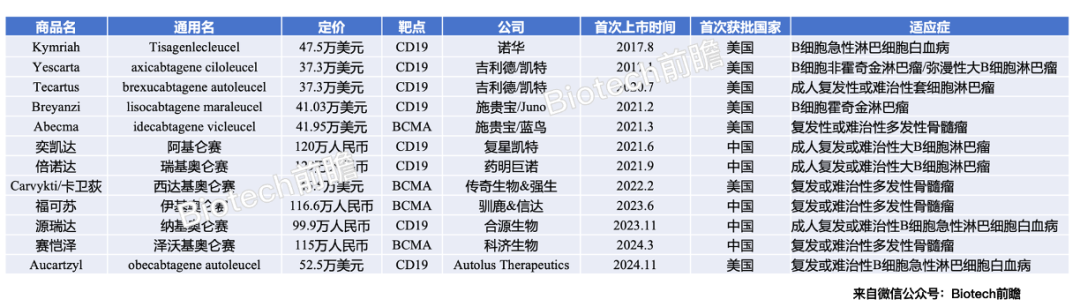
Kymriah(Tisagenlecleucel):
作为CAR-T疗法的领军者之一,已被批准用于治疗急性淋巴细胞白血病(ALL)和大B细胞淋巴瘤(NHL),价格为47.5万美元。尽管价格高昂,但其个性化治疗的独特优势使其成为许多患者的最佳选择。
Yescarta(Axicabtagene ciloleucel):
这款CAR-T疗法专门针对大B细胞淋巴瘤,价格为37.5万美元。根据最新数据,Yescarta在治疗复发或难治性大B细胞淋巴瘤患者中显示出高达83%的总缓解率(ORR)。
Cemacabtagene ansegedleucel(cema-cel):
Allogene Therapeutics的这款现货型CAR-T疗法在治疗复发/难治性大B细胞淋巴瘤(LBCL)患者中的1期试验中显示出100%的完全缓解率(CR)。其中位缓解持续时间(DOR)为23.1个月,无进展生存期(PFS)和总生存期(OS)分别为24个月和尚未达到。
总结与展望
癌症治疗正在经历一场由 CAR-T疗法、ADC药物和双特异性抗体(BiTE) 三者驱动的技术革命。这些疗法以精准性、高效性和创新性为核心,从血液肿瘤向实体瘤跨越,从单药治疗向联合策略升级,正在重新定义“治愈”的边界。

链接:http://www.lewenyixue.com/2025/04/07/%E6%8A%97%E8%82%BF%E7%98%A4%E4%BA%A7%E5%93%812025%EF%BC%9A16%E6%AC%BEADC%E3%80%8117%E6%AC%BE/




 未来|指南共识|广东省药学会发布《医疗机构药品费用科学管理(DES)专家共识》
未来|指南共识|广东省药学会发布《医疗机构药品费用科学管理(DES)专家共识》
赶快来坐沙发