肿瘤治疗中的替代终点:加速药物研发的双刃剑
目前,已有多个肿瘤领域的临床终点被用于寻求监管部门的批准,包括总生存期( OS )、无进展生存期( PFS )和客观响应率( ORR )。与五年生存期、一年生存期、完全缓解期( CR )和缓解持续时间( DoR )一起,这些都属于传统上用于肿瘤临床试验的终点,并且被认为具有确定的价值。
基于 OS 获益批准的产品包括用于结直肠癌的 encorafenib 和用于膀胱癌的 avelumab 。基于 PFS 获益批准的治疗方法包括治疗转移性非小细胞肺癌的 ramucirumab 和治疗胃肠道间质瘤的 ripretinib ;基于 ORR 批准的包括 sacituzumab 治疗转移性三阴性乳腺癌和 selpercatinib 治疗非小细胞肺癌。
近年来,随着科学技术的进步,新药物在缩小肿瘤大小和延缓肿瘤生长方面取得了显著进步,这使得它们倾向使用更多演化的替代终点,以支持传统的和加速的肿瘤药物批准。对 2016 年至 2020 年间结直肠癌、多发性骨髓瘤、非小细胞肺癌、尿路上皮癌和前列腺癌临床试验的传统终点和替代终点的分析表明,最常见的替代主要终点是病理完全应答( pCR )、复发率( RR )、无病生存期( DFS ),实体瘤的无事件生存期( EFS )和疾病控制率( DCR ),多发性骨髓瘤的微小残留病灶( MRD )。两个最广泛使用的替代终点, DCR 和 RR ,多用于转移性疾病的一二线治疗,而 pCR 和 DFS 是辅助 / 新辅助研究中最常用的主要终点。
- 02 -
一 、肿瘤学替代终点的趋势
在监管机构批准的最常用终点中,那些包含生存期的终点是证明临床益处的金标准。然而,生存期分析需要大量的样本,并且可能需要数年的长期随访来测量中位总生存期,有效的进展后治疗也可能会混淆或降低生存期。这种局限性是在肿瘤领域临床上使用替代终点的主要动机。基于流行病学、治疗学、病理生理学或其他科学证据,替代终点有望预测临床益处。此外,替代终点的使用已广泛应用于临床试验。 1992 年至 2019 年间,美国 FDA 为 132 种基于替代终点的药物颁发了 194 种独特的肿瘤药物授权。
使用替代终点的类似趋势也出现在欧盟市场授权机构( MAAs )中。临床试验中最常报告的(主要或次要)终点是 OS ( 94% )、 PFS ( 93% )和 ORR ( 87% )。在所有应用中, OS 、 PFS 和 ORR 分别构成 MAA 的主要终点的 34% 、 49% 和 22% 和次要终点的 60% 、 44% 和 66% 。值得注意的是, OS 累计作为所有肿瘤适应症的主要终点显著下降(平均下降近 13% ),同时 OS 作为次要终点的比率增加,这对于血液学适应症尤其明显。
然而,尽管不断发展的临床终点已被用于监管部门的批准,但支付方之间仍然存在相互矛盾的意见。 Apalutamide 获得了基于替代终点的批准,但 HTA 的评估表明,支付方对此类替代终点的接受程度有限。而 pembrolizumab 把 pCR 数据作为主要终点,而 OS 和 EFS 数据不成熟(临床试验中未达到有效期)时, FDA 肿瘤药物咨询委员会( ODAC )一致决定推迟 FDA 对这些适应症中 pembrolizumab 的批准。
- 03 -
二、肿瘤学替代终点的评价
在进行中的临床试验中确定了25个正在演变的终点,作为II期和III期的主要终点。 病理完全缓解率、复发率、无病生存期、无事件生存期和疾病控制率是2016年至2020年临床试验中最常见的主要替代终点。 微小残留病灶是多发性骨髓瘤最常见的演变主要终点。
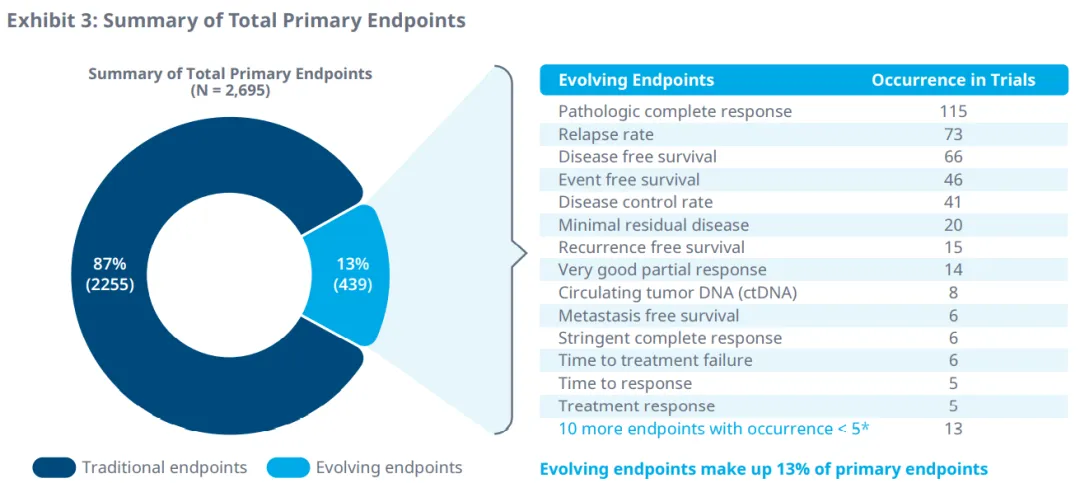
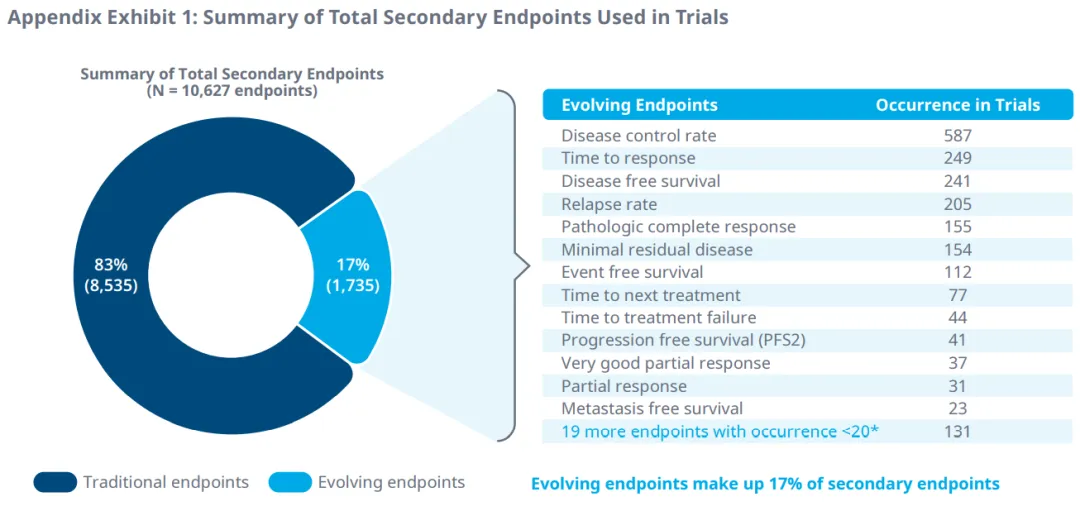
此外,在51个肿瘤适应症的II期和III期试验中,33个替代终点被确定为次要终点。疾病控制率、响应时间、无病生存期、复发率和病理完全响应是2016年至2020年临床试验中最常见的次要终点。微小残留病灶也是多发性骨髓瘤最常见的次要终点。
在2016年至2020年期间,有17个替代终点在超过5%的特定适应症的临床试验中被选为主要终点或次要终点。疾病控制率和复发率被分别用于25个和23个适应症的临床试验终点。
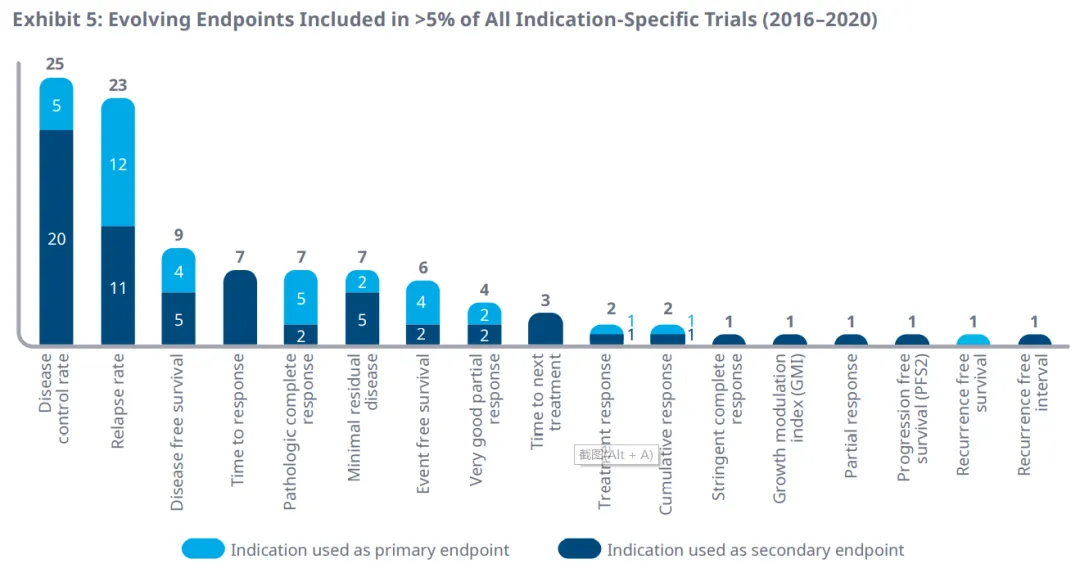
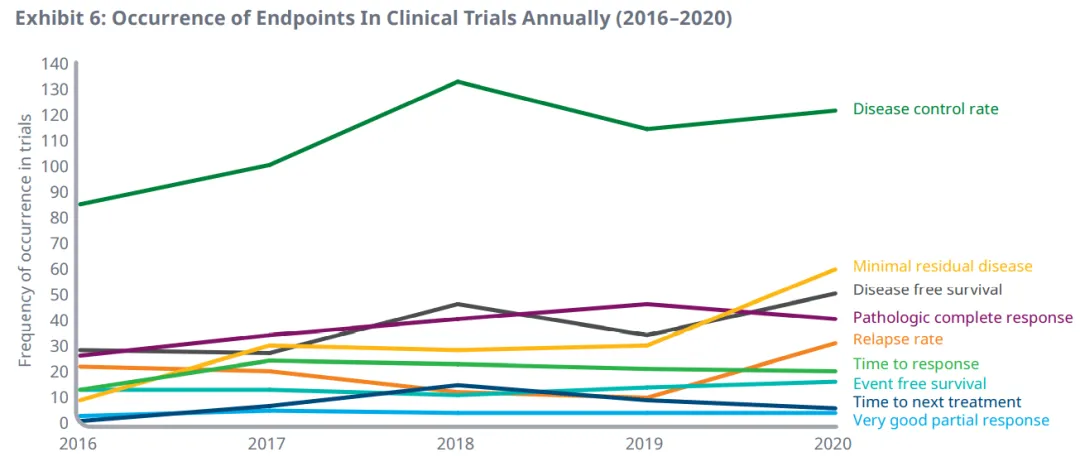
其中前9个替代终点,2016年至2020年临床试验中的年发生率如下图。相比于2016年,最小残留病( 555% )、无病生存期( 78% )、病理完全应答率( 53% )和疾病控制率( 43% )在2020年临床试验中的年使用量增加最多。
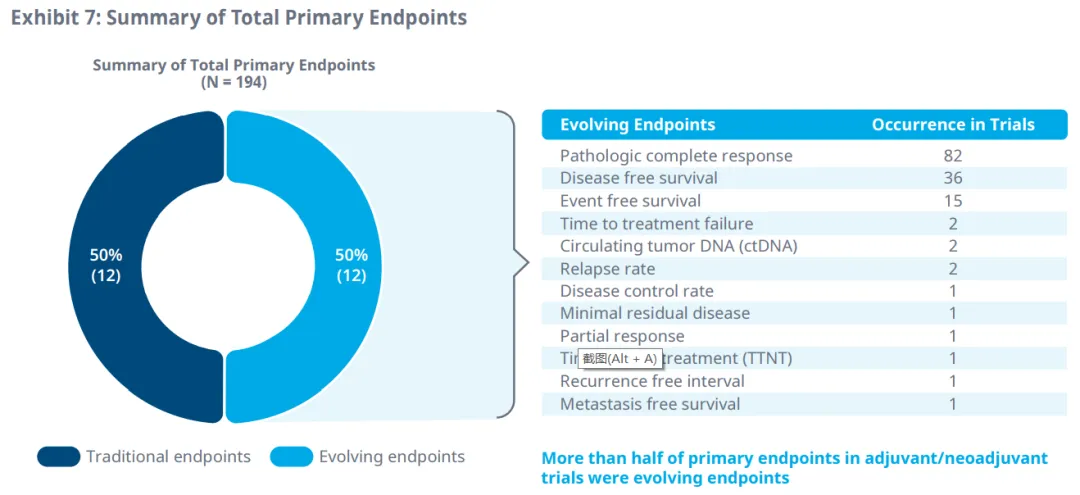
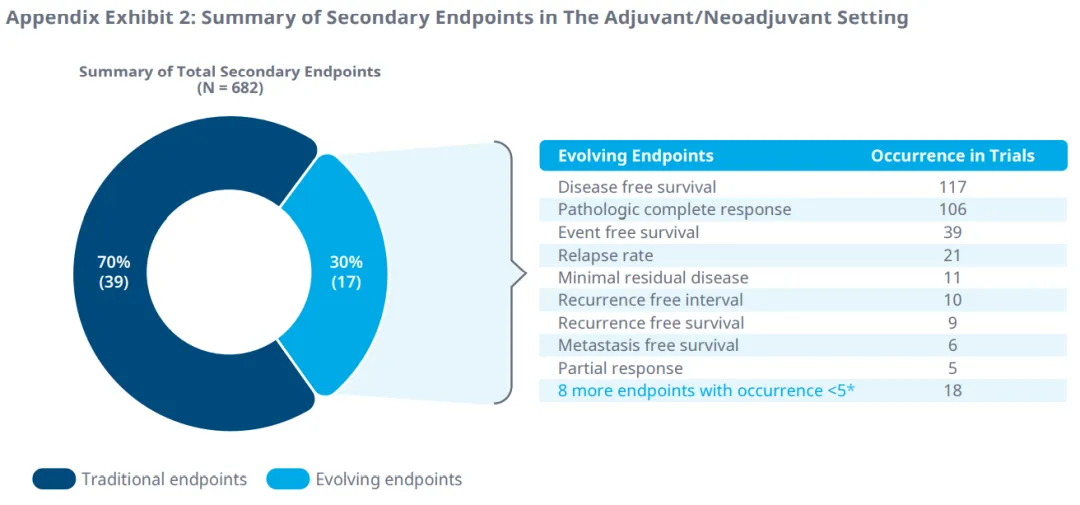
病理完全响应和无病生存期是辅助/新辅助治疗中最常用的替代终点,作为主要和次要终点。
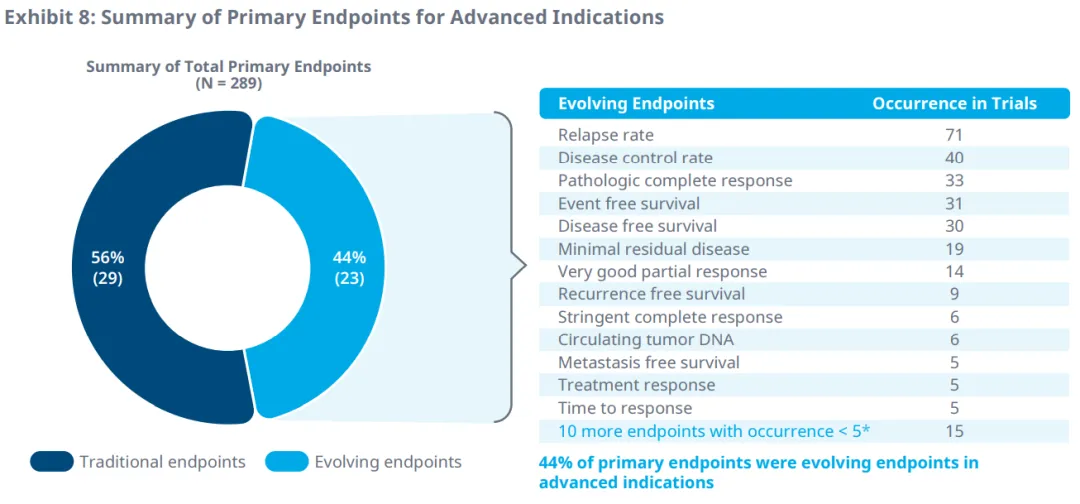
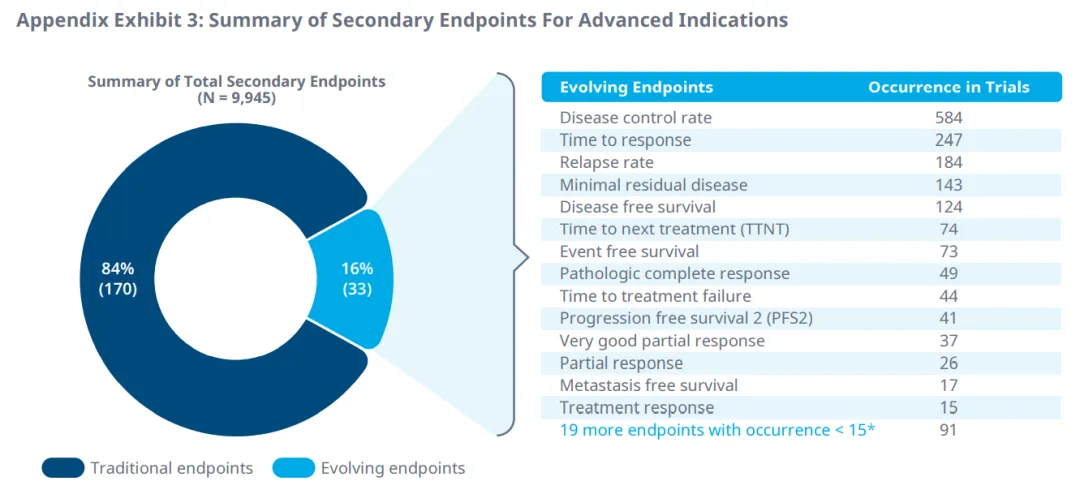
在晚期癌症的临床试验中,疾病控制率、复发率和响应时间是最常用的主要和次要终点。
DFS被认为是辅助/新辅助治疗中预后良好( 总生存期>18个月 )以及生存数据不成熟时的合适疗效替代终点。pCR是另一个演化中的终点,适用于术前辅助/新辅助治疗或化疗,而对于具有转移指征和良好预后的治疗,DCR可能是PFS和不成熟OS数据的合适支持替代终点。
- 04 -
三、 替代终点 “ 速度 VS 确定性 ” 之辩
替代终点是肿瘤免疫时代的一把 “ 双刃剑 ” 。它加速了救命药的诞生,但也需警惕 “ 虚假希望 ” 的风险。
1. 速度优势的局限性与风险
替代终点(如 PFS 、 ORR )虽可缩短药物研发周期(平均节省约 11 个月),但约 86% 的药物上市后未能证实明显延长生存期( OS ),导致审批速度的提升以牺牲临床确定性为代价。 研究表明,平均而言,患者更倾向于等待更长时间( 16-22 个月)以获取高确定性证据,而非接受基于替代终点的快速批准。这与当前监管(如 FDA )优先速度和市场准入的策略存在冲突。
2. 回归 OS 导向的临床试验设计
若监管机构优先患者核心结局(如 OS ),需转向高风险、晚期患者群体的随机试验(预后差 → 事件率高 →OS 数据更快生成),同时减少在早期低风险人群中测试新疗法。通过对重症患者进行初步试验(更快获取高质量证据),后续扩展至更广泛人群,可能同时兼顾速度与确定性。
3. 替代终点的未来角色调整
替代终点可能继续用于预后极差、亟需快速治疗的晚期患者(如多发性骨髓瘤高危亚群或晚期肺癌),但不适用于预后较好的早期疾病。替代终点需持续验证其与 OS 的关联性,并结合现实世界证据弥补不确定性。此外,微小残留病灶( MRD )、病理完全缓解率( pCR )等可能成为特定适应症(如血液肿瘤或辅助治疗)的补充性终点。
替代终点的未来将取决于多维度平衡 —— 短期利益(快速药物可及性)与长期风险(证据不确定性)、药企创新动力与公共健康责任、患者个体偏好与群体受益。若监管收紧替代终点,药企可能精简管线,聚焦真正突破性疗法,淘汰边际效益药物,从而减少总批准数但提升质量。此外,支付方对替代终点的质疑可能导致加速审批药物难以通过成本效益评估,倒逼药企优化临床设计。
- 05 -
结语:回归医疗本质的终极拷问
当可靠的验证研究表明特定替代终点的变化可以预测生存结果的变化时,这个替代终点是最有用的。随着这些替代终点的不断发展,正确的设计和应用对于未来药物的获批将是非常重要的。
在肿瘤领域的临床试验中,这些不断发展的替代终点应该持续监测,进一步的试验和研究需要显示替代终点和长期生存期之间的明确联系,以便使各方都能接受。业界、监管者和支付方都需要继续思考如何在正确的时间为正确的患者提供最佳的服务,从新的角度看待这些替代终点可以让所有利益相关者有效地评估药物的益处,同时确保治疗能够迅速地提供给需要的患者。
参考资料:
1. Evolving Oncology Endpoints: A New Horizonfor Oncology Outcomes. 2021 IQVIA
链接:http://www.lewenyixue.com/2025/04/03/%E8%82%BF%E7%98%A4%E6%B2%BB%E7%96%97%E4%B8%AD%E7%9A%84%E6%9B%BF%E4%BB%A3%E7%BB%88%E7%82%B9%EF%BC%9A%E5%8A%A0%E9%80%9F%E8%8D%AF%E7%89%A9%E7%A0%94%E5%8F%91%E7%9A%84%E5%8F%8C%E5%88%83/





赶快来坐沙发