【论著】局部进展期直肠癌患者新辅助放化疗后病理完全缓解的列线图预测模型
引用本文 :田若曦, 胡旭华, 刘恒昌, 等. 局部进展期直肠癌患者新辅助放化疗后病理完全缓解的列线图预测模型[J]. 中华胃肠外科杂志, 2025, 28(3): 304-313. DOI: 10.3760/cma.j.cn441530-20250106- 00012.
作者: 田若曦 胡旭华 刘恒昌 程璞 李吉云 包满都拉 赵黎明 郑朝旭
作者单位: 国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院结直肠外科 河北医科大学第四医院外二科
摘要
目的 构建并验证局部进展期直肠癌(LARC)患者在接受新辅助放化疗(nCRT)后病理完全缓解(pCR)的预测模型。
方法 本研究为回顾性观察性研究,纳入中国医学科学院肿瘤医院和河北医科大学第四医院确诊为LARC的T2~4和(或)N+M0期、未发生转移、耐受并完成新辅助治疗且在新辅助治疗后接受根治性手术的595例LARC患者,其中中国医学科学院肿瘤医院2013—2018年收治的299例患者作为训练集,2019—2023年期间收治的155例患者作为内部验证;而2013—2021年期间就诊于河北医科大学第四医院的141例患者作为外部验证。根据术后病理结果是否达到pCR分为pCR组及非pCR组。训练集患者299例中,非pCR组247例,pCR组52例;内部验证患者155例中,非pCR组113例,pCR组42例;外部验证141例患者中非pCR组132例,pCR组9例。使用Logistic回归进行单因素和多因素分析,探究与pCR相关的因素,并构建列线图预测模型。利用接受者操作特征(ROC)曲线、校准曲线及决策曲线分析(DCA)验证预测模型效能。
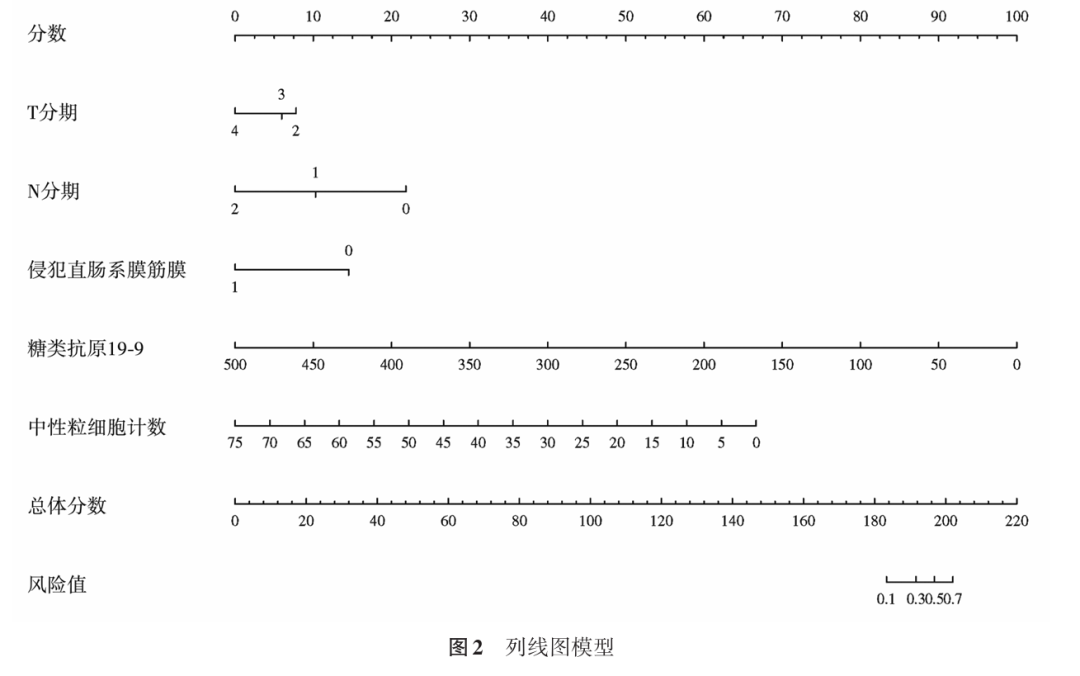
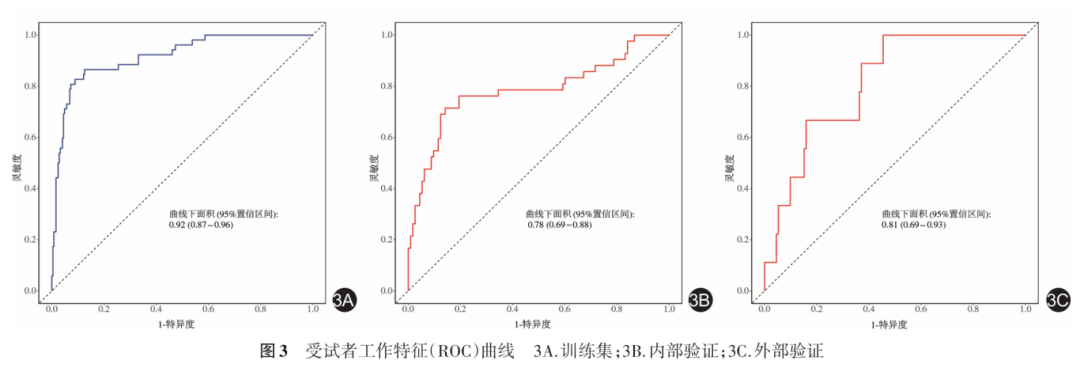
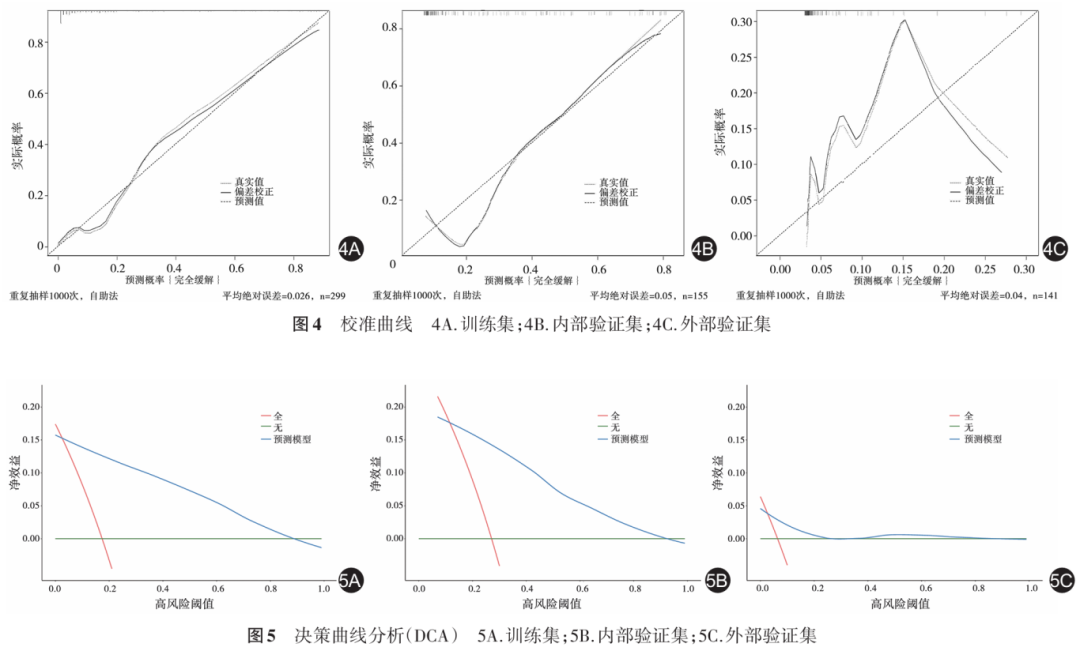
结果 单因素和多因素Logistic回归分析显示,糖类抗原19-9(CA19-9)( P =0.040,OR=0.97,95%CI:0.93~0.99)、中性粒细胞计数( P <0.001,OR=0.66,95%CI:0.52~0.84)、肿瘤T分期[Ⅳ期( P =0.011,OR=0.22,95%CI:0.07~0.70)]、肿瘤N分期[Ⅰ期( P =0.003,OR=0.22,95%CI:0.08~0.60)和Ⅱ期( P <0.001,OR=0.03,95%CI:0.01~0.09)]和直肠系膜筋膜(MRF)状态( P =0.004,OR=0.09,95%CI:0.02~0.47)这5个指标是与pCR相关的独立预测因子。在训练集中,本模型ROC曲线下面积(AUC)为0.92(95%CI:0.87~0.96)(在内部和外部验证集中,AUC分别为0.78和0.81);校准曲线提示,预测模型在训练集和验证集中均具有良好的预测效能;DCA显示,当阈值概率在5.2%~89.7%范围内时,模型净收益最大(在内部和外部验证集中,阈值概率分别在15.7%~92.3%和2.2%~84.1%范围内时,模型净收益最大)。
结论 本研究所构建的列线图模型对于预测LARC患者在接受nCRT后是否能获得pCR具有较好的预测效能。
结直肠癌(colorectal cancer,CRC)是全球常见癌症。2020年,全球估计有结直肠癌新发病例193万(10.0%),死亡病例94万(9.4%),其中约1/3为直肠癌患者 [1] 。局部进展期直肠癌(locally advanced rectal cancer,LARC)是指经影像学或病理检查发现的原发肿瘤浸润出肠壁肌层直至周围结构(c/pT3~4b)、或系膜内及真骨盆范围内出现淋巴结转移(c/pN1~2)而无远处转移的一类特殊的直肠癌 [2-3] 。“新辅助放化疗(neoadjuvant chemoradiotherapy,nCRT)+全直肠系膜切除术(total mesorectal excision,TME)+辅助化疗”是目前LARC标准的治疗模式 [4-5] 。长期以来,LARC治疗效果较差,但随着nCRT在LARC中的广泛开展,这类患者的治疗效果有了显著的提高。约20%的患者在手术时达到病理完全缓解(pathological complete response,pCR),但仍有相当一部分患者对nCRT耐药,甚至出现疾病进展 [6-7] 。如何平衡局部复发和转移性复发的风险,避免过度治疗,同时保留器官功能和患者的生活质量,是当今临床关注的重点 [8] 。因此,需要寻找能够区分对nCRT无应答和应答的LARC患者的影响因素及预测因子,以帮助确定最佳治疗方案。尽管已有相关研究从临床病理因素、影像组学及基因分子标志物等多方面探究了相关预测因素,但多数研究存在样本量较小、缺少外部验证、单中心研究以及纳入临床病理影响因素较少等问题。因此,需要构建准确性较高的预测模型,为临床决策提供更可靠的参考依据。
本研究拟依托双中心大样本数据,确定新辅助治疗后pCR的预测因素,构建预测模型并进行内部和外部验证,筛选对nCRT敏感的患者,以期为LARC患者个体化治疗提供理论指导。
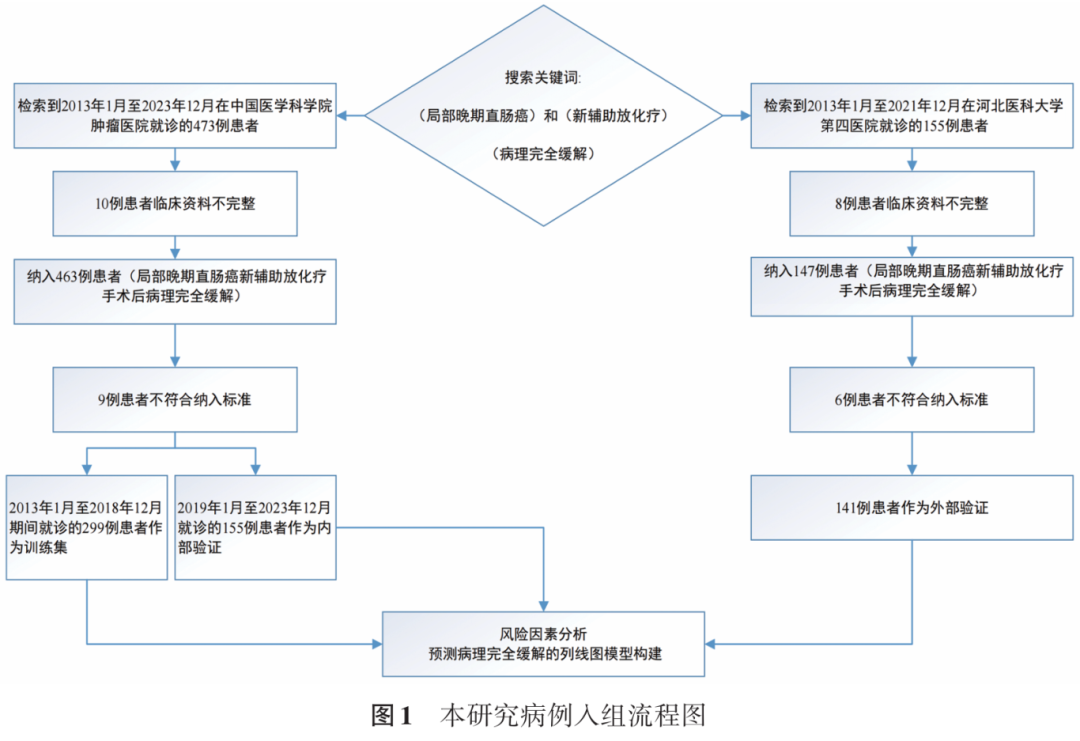
一、研究对象
本研究为回顾性观察性研究。
纳入标准:(1)确诊为未发生转移的原发直肠癌;(2)局部分期为T2~4和(或)N+M0;(3)年龄为18~75岁;(4)耐受并完成新辅助治疗,选用治疗方案为长程nCRT方案、短程nCRT、全程新辅助治疗,并在新辅助治疗后接受根治性手术。
排除标准:(1)既往患有其他原发性恶性肿瘤;(2)治疗开始后出现远处转移;(3)临床及病理资料不完整;(4)Lynch综合征或家族性腺瘤性息肉病。
根据以上标准,共纳入595例LARC患者,数据纳入过程的流程图见图1。其中,2013—2018年就诊于中国医学科学院肿瘤医院的299例患者作为训练集,2019—2023年就诊于中国医学科学院肿瘤医院的155例患者作为内部验证集,2013—2021年就诊于河北医科大学第四医院的141例患者作为外部验证集。根据术后病理结果是否达到pCR,将患者分为pCR组及非pCR组。本研究经中国医学科学院肿瘤医院伦理委员会(审批号:18-015/1617)及河北医科大学第四医院伦理委员会(审批号:2020kt417)审批通过。
二、资料获取
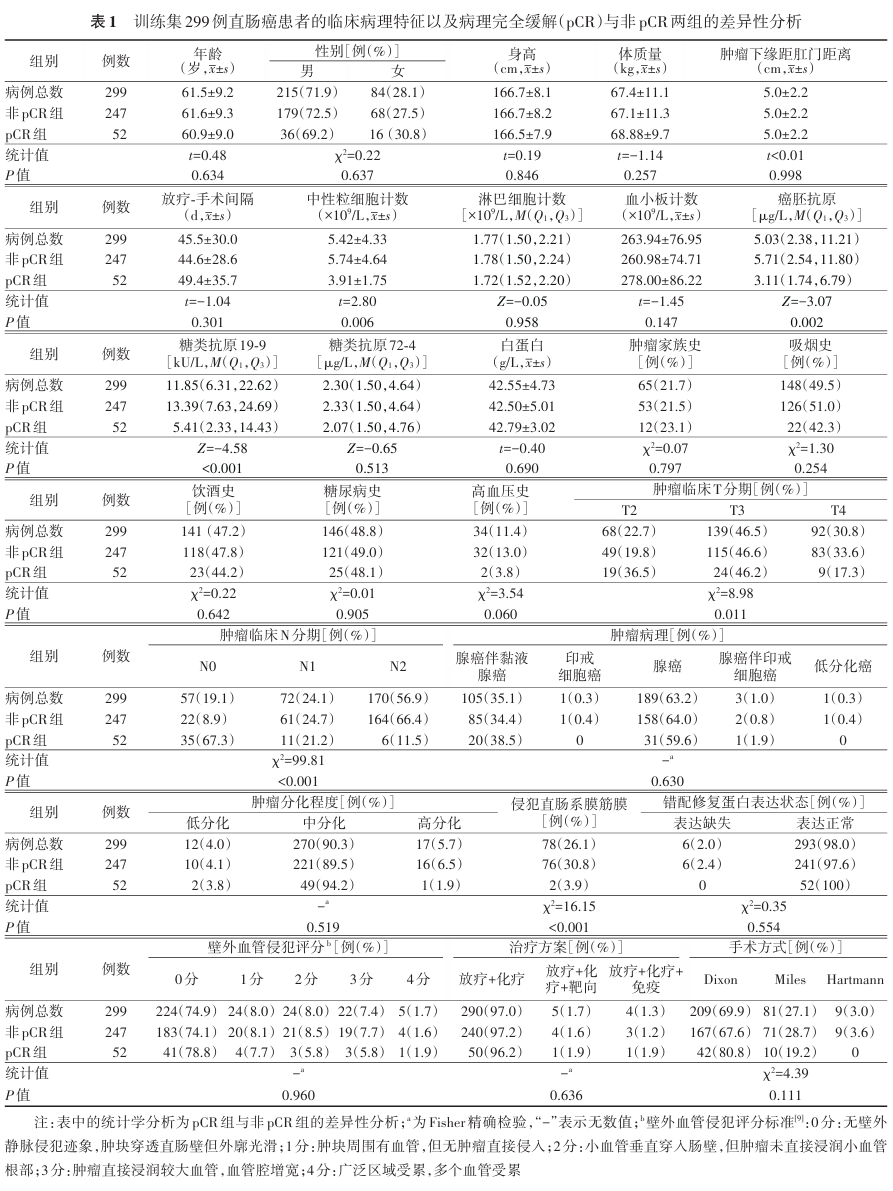
通过查询两家医院电子病历系统,收集患者的临床资料。具体包括:(1)基本信息:患者的年龄、性别、身高、体质量;(2)病史:肿瘤家族病史、吸烟史、饮酒史、高血压史和糖尿病史;(3)血液检测指标:癌胚抗原、糖类抗原(CA)19-9、CA72-4、中性粒细胞计数、淋巴细胞计数、血小板计数和白蛋白检测指标;(4)肿瘤学特征:肿瘤下缘距肛门距离、肿瘤病理、临床T分期和N分期及肿瘤分化程度和是否侵犯直肠系膜筋膜(mesorectal fascia,MRF)、壁外血管侵犯(extramural vascular invasion,EMVI)评分、错配修复状态;(5)治疗情况:治疗方案、放疗至手术间隔时间以及手术方式。
三、统计学方法
采用SPSS 22.0及R语言软件进行统计学分析。构建LARC临床队列后,进行数据预处理。根据治疗结果,将纳入患者分为pCR组与非pCR组。使用 x ± s 表示符合正态分布的连续变量,不符合正态分布的连续变量应用 M ( Q 1 , Q 3 )表示,定性变量用绝对频率和百分比表示。使用独立样本 t 检验比较两组之间符合正态分布的连续变量,使用Mann-Whitney U 检验比较不符合正态分布的连续变量。χ 2 检验或Fisher精确检验比较定性变量。随后,在训练集中进行单因素分析及多因素分析,筛选独立危险因素或保护因素。将多因素logistic回归中的独立危险因素或保护因素纳入预测模型中并绘制列线图。利用受试者工作特征(receiver operating characteristic curve,ROC)曲线、校准曲线及决策曲线分析(decision curve analysis,DCA)评估预测模型效能;利用内部验证集以及外部验证集验证预测模型效能。 P <0.05表示差异有统计学意义。
一、训练集患者的临床病理资料及预后因素分析
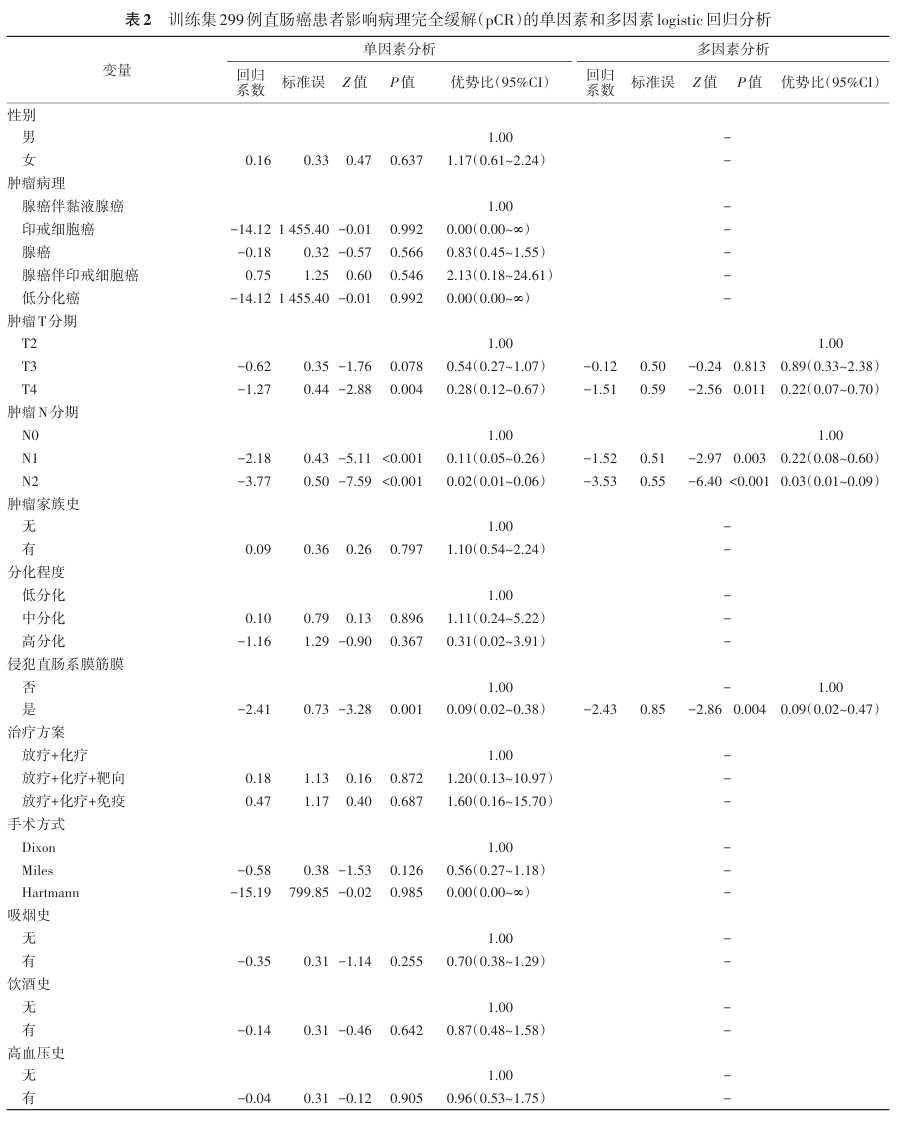
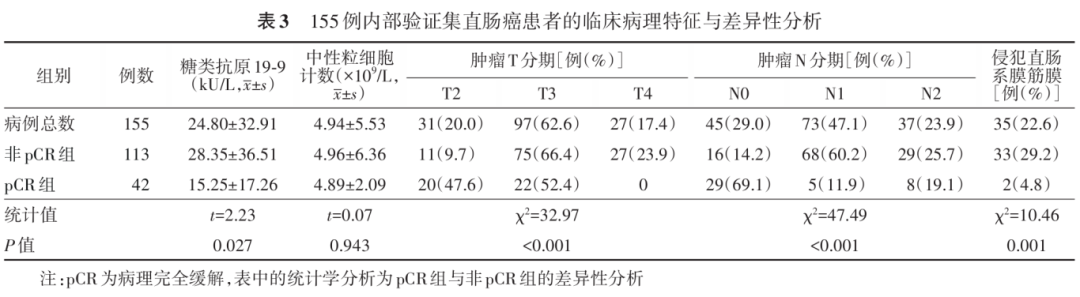
1.临床病理资料:299例训练集患者中,非pCR组247例,pCR组52例。299例患者的临床病理资料以及两组的差异性分析见表1。其中,中性粒细胞计数( P =0.006)、癌胚抗原( P =0.002)、CA19-9( P <0.001)、肿瘤临床T分期( P =0.011)和N分期( P <0.001)及侵犯MRF( P <0.001)与pCR显著相关。
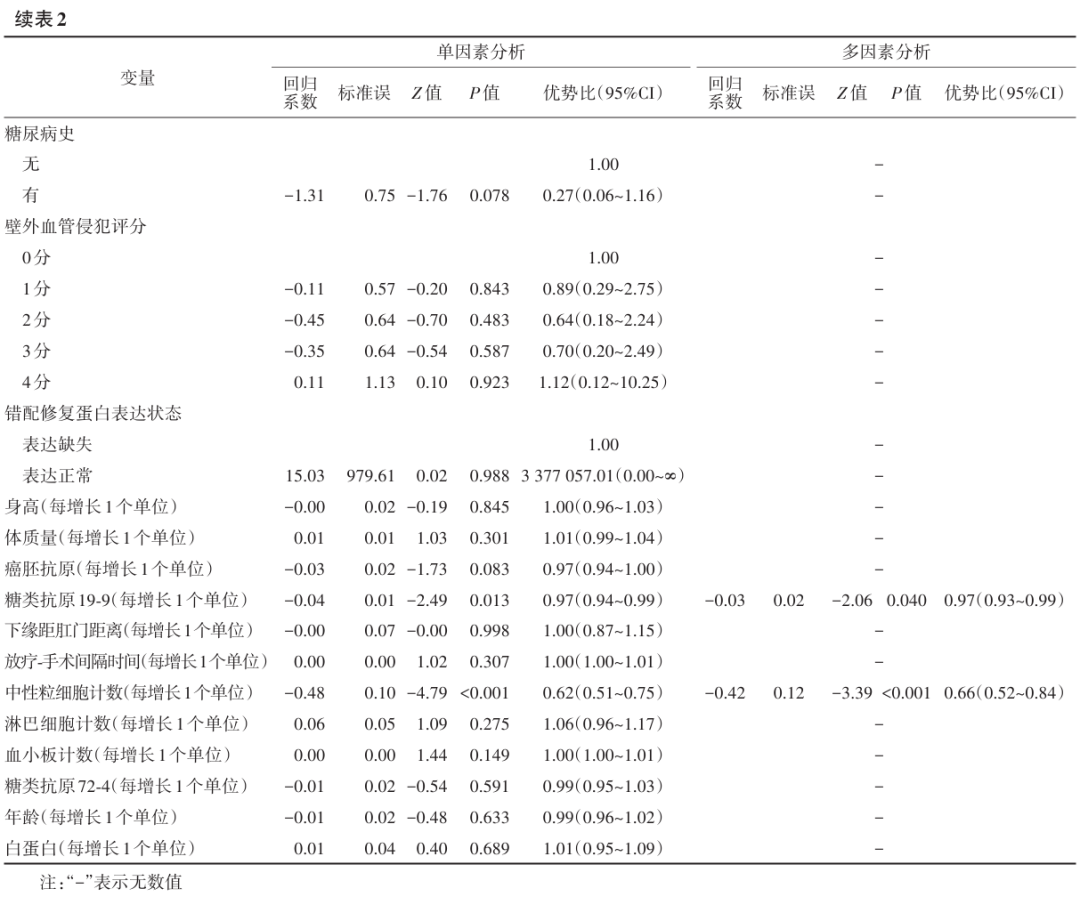
2.影响LARC患者pCR的因素:单因素logistic回归分析发现,有5个变量差异具有统计学意义,分别为CA19-9、中性粒细胞计数、肿瘤T分期(T4)和N分期(N1和N2)以及肿瘤侵犯MRF。这5个变量进行多因素logistic回归分析结果表明,CA19-9、中性粒细胞计数、肿瘤T分期(T4)和N分期(N1和N2)以及肿瘤侵犯MRF是影响pCR的独立预测因子。单因素和多因素logistic回归分析结果见表2。
二、列线图的构建与验证
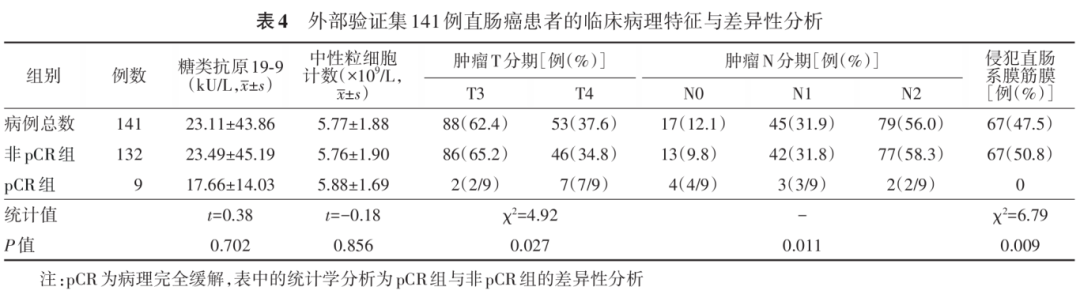
将多因素logistic回归分析中的独立危险纳入预测模型中并绘制列线图(图2)。内部验证及外部验证中纳入模型的变量情况见表3和表4。
采用ROC曲线评估模型的预测效能。在训练集中,ROC曲线的曲线下面积为0.92(图3A)。在内部验证和外部验证中,ROC曲线的曲线下面积分别为0.78及0.81(图3B和图3C)。校准曲线则提示,建立的预测模型无论是在训练集、还是验证集中都具有良好的预测效能,与真实情况吻合良好(图4)。DCA决策曲线表明,在训练集中,当阈值概率在5.2%~89.7%范围内时,预测模型净收益更大(图5A)。在内部验证中,当阈值概率在15.7%~92.3%范围内时,预测模型净收益更大(图5B)。在外部验证中,当阈值概率在2.2%~84.1%范围内时,预测模型净收益更大(图5C)。
nCRT有助于肿瘤体积缩小和降期,提高手术切除率以及低位肿瘤的肛门括约肌保留率,显著降低局部复发率及治疗相关毒性 [10] 。然而,患者对nCRT治疗反应存在差异,这种治疗结局的异质性会影响患者的长期预后 [11] 。因此,pCR患者的精准识别,有助于避免过度治疗,保留器官功能,提升患者的生活质量和改善预后 [8] 。确定能够区分有无应答的LARC患者的预测因子,并构建出相应的预测模型,有望帮助临床医生在治疗过程中进行决策。本研究基于两个中心的LARC临床队列数据,单因素和多因素logistic分析显示,临床T分期、临床N分期、侵犯直肠系膜、CA 19-9和中性粒细胞计数是影响患者pCR的独立危险因素。
本研究结果表明,nCRT前较高的临床T分期和N分期不利于患者pCR。Wen等 [12] 纳入126例术前接受nCRT治疗的LARC患者,随机分为训练组(84例)和验证组(42例),从nCRT前后的MRI T2加权图像中提取250个放射学特征,以预测评估这些接受nCRT治疗的LARC患者对治疗反应的有效性;结果显示,基于nCRT前cN分期的列线图模型是预测LARC患者nCRT术后pCR的有效工具(AUC:0.852)。Zhang等 [13] 也指出,nCRT前cN分期(OR=0.570, P =0.036)与患者pCR显著相关。还有研究纳入了2016—2019年接受nCRT和根治性手术治疗的278例LARC患者,并指出nCRT前cN分期是LARC患者pCR的独立预测因子 [14] 。van Stiphout等 [15] 通过临床参数和PET-CT参数筛选pCR的预测特征并构建预测模型,pCR选择的预测特征是cT分期、cN分期、SUV mean反应指数和治疗期间肿瘤最大直径;模型的AUC分别为0.78(训练组)和0.70(验证组)。Ren等 [16] 建立预测良好降期(ypT0~2N0M0)概率的诺曼图显示,肿瘤分化、MRF状态和临床T分期显著影响良好降期的概率。上述研究与本研究结论类似,即低cT及cN分期更有可能实现nCRT治疗后的良好降期,可以与其他因素联合作为器官保存策略的参考工具。
MRF状态同样与患者pCR显著相关。MRF(+)提示肿瘤具有侵袭性。在nCRT后,MRF(+)患者的pCR可能性较低。有研究指出,化疗方案、肿瘤分化程度、MRF状态和肿瘤长径是患者pCR的独立预测因子 [16] 。Erozkan等 [17] 回顾性研究纳入2015—2022年间完成nCRT的LARC患者,分析了pCR的预测因素,结果表明,直肠低位肿瘤、无MRF累及和无EMVI是pCR的预测因素。Chen等 [18] 评估了新辅助化疗对中低位局部晚期直肠癌伴MRF(-)患者治疗的安全性和有效性,结果表明,对于MRF(-)的中低位直肠癌患者,3个月的新辅助化疗可产生良好的肿瘤反应,毒性可接受。还有研究指出,基于MRF状态构建的患者无进展生存(progression free survival,PFS)预测模型在训练集(AUC=0.819)和验证集(AUC=0.815)均表现良好 [19] 。结合上述研究,我们认为,MRF(+)的患者即使在新辅助治疗后降期良好,也需要谨慎选择“等待观察”策略。而MRF(-)患者可能有更高的pCR概率,可以考虑轻度治疗方案、局部切除或“等待观察”策略。
CA19-9是患者pCR的独立预测因子之一。有研究通过机器学习模型分析接受nCRT治疗的LARC患者,发现CA19-9对pCR预测有显著意义 [20] 。还有研究对2002年1月至2008年6月中山大学肿瘤中心收治的132例LARC患者放疗后的治疗反应进行评估,结果表明,放疗前血清CA19-9水平与pCR相关 [21] 。值得注意的是,还有研究指出,癌胚抗原对于患者pCR的预测能力 [22-23] 。本研究中,单因素logistic回归分析表明,癌胚抗原与pCR也具有一定相关性( P <0.1,OR=0.97)。后续研究我们将会扩大样本量,以进一步验证这个结论。
在本研究中,较低的中性粒细胞计数有利于患者pCR的发生。Zhang等 [24] 探究了LARC患者在短期放疗后化疗和免疫治疗pCR的血液学指标,结果表明,低中性粒细胞( P =0.012)水平与高pCR率相关,是短期放疗后化疗和免疫治疗的LARC患者pCR的独立预后预测因子。Yang等 [25] 回顾性分析2013年1月至2023年5月期间,接受nCTR和根治性手术治疗的LARC患者资料,结果表明,nCTR前中性粒细胞与淋巴细胞比率(NLR)≥2.6(OR=0.378,95%CI:0.164~0.868, P =0.022)是pCR的独立危险因素。还有研究评估了血液学参数在预测nCTR后反应的作用,结果显示,无反应患者和应答患者在中性粒细胞与单核细胞比率上差异具有统计学意义( P <0.01) [26] 。上述研究从侧面支持了我们的研究结论。
在单因素和多因素logistic回归分析的基础上,本研究构建了预测患者是否pCR的列线图模型。ROC曲线、校准曲线和DCA曲线均表明,列线图模型具有良好的预测效能。本模型有助于识别出潜在对nCRT敏感的患者,可为临床医生制定个体化的多学科策略提供参考。但由于回顾性研究的局限性,本研究仍然存在样本量较少、纳入的临床病理特征少等问题。我们后续将进行多中心、大样本的前瞻性研究,以进一步验证我们的结论。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 田若曦:酝酿和设计实验、采集数据、统计分析及解释数据、文章撰写及修改;郑朝旭:酝酿和设计实验、文章审阅及修改;胡旭华、刘恒昌:采集数据、统计分析及解释数据、文章审阅及修改;程璞、李吉云、包满都拉、赵黎明;统计分析及解释数据、文章审阅及修改
滑动阅读参考文献
链接:http://www.lewenyixue.com/2025/04/02/%E3%80%90%E8%AE%BA%E8%91%97%E3%80%91%E5%B1%80%E9%83%A8%E8%BF%9B%E5%B1%95%E6%9C%9F%E7%9B%B4%E8%82%A0%E7%99%8C%E6%82%A3%E8%80%85%E6%96%B0%E8%BE%85%E5%8A%A9%E6%94%BE%E5%8C%96%E7%96%97/





赶快来坐沙发