【CACA前沿周刊】91期 小核酸药物——精准医疗的下一个里程碑
本期看点
序言
你是否在接种疫苗时注意到疫苗的新品类——RNA疫苗?特别是COVID-19病毒大流行期间,RNA疫苗为抗疫作出了突出贡献。核酸递送也随着疫苗变得家喻户晓。核酸,或将成为新一代药物的重要发展方向。
近年来,小核酸药物凭借其独特的基因调控能力,成为肿瘤治疗领域备受瞩目的新兴方向。这类药物通过精准干预肿瘤相关基因的表达,为攻克传统疗法难以触及的“不可成药”靶点提供了全新方案。随着化学修饰技术与递送系统的突破,小核酸药物在肿瘤治疗中的潜力逐步显现,或将成为继化疗、靶向治疗和免疫治疗之后的又一里程碑。
传统抗肿瘤药物的局限性
现有的抗肿瘤小分子靶向药或抗体类药物均靶向蛋白质,但是这些蛋白质中有80%的靶点难以成药。另外,肿瘤并不总是有蛋白质改变导致的,浩瀚的人类基因组中只有1.5%的序列长度编码了蛋白质。可以想象的是,那些和肿瘤相关但不可靶向的靶点是海量的,而传统抗肿瘤药物只能望洋兴叹。
小核酸药物的优势与研发历程
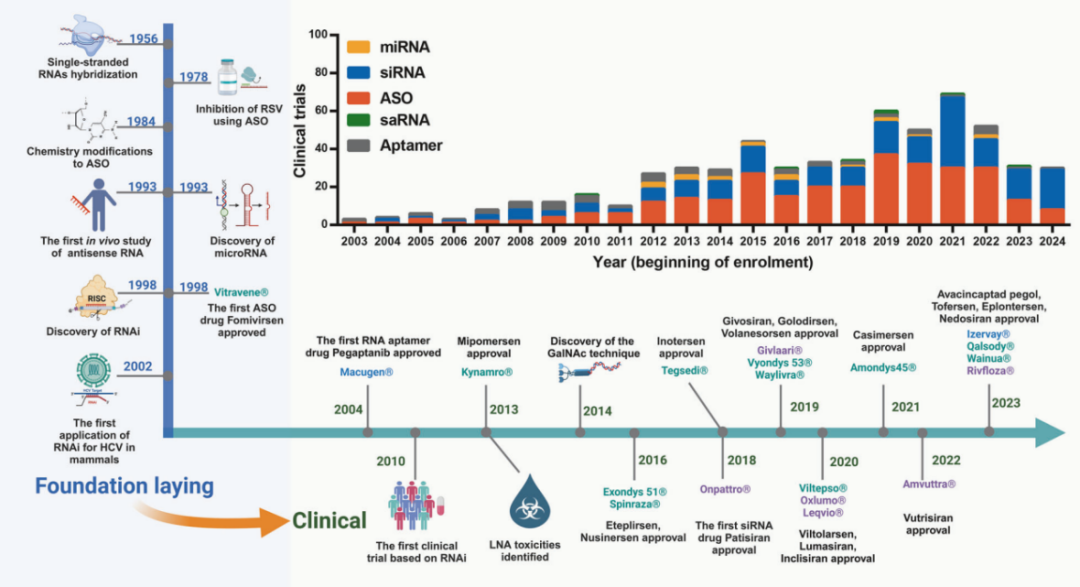
小核酸药物的研发历程始于20世纪70年代,经过数十年的技术积累与创新,逐步从实验室走向临床,在肿瘤治疗领域展现出巨大潜力。
1978年,一篇研究首次提出通过碱基互补配对靶向RNA的概念。反义寡核苷酸(ASO)技术就此诞生。80年代,ASO药物进入早期开发阶段,但因稳定性差、递送效率低,总体研发进展缓慢。
1998年,福米韦生成为首个获批的ASO药物,用于治疗巨细胞病毒性视网膜炎。它的获批标志着小核酸药物的首次临床成功。同年,RNA干扰(RNAi)机制被发现,为siRNA药物的开发奠定了基础。Andrew Fire和Craig Mello也因此获得2006年诺贝尔奖。
2004年,派格帕尼钠获批成为首个获批的核酸适配体(Aptamer)药物,其靶向VEGF,用于治疗新生血管性年龄相关性黄斑变性。
2008年,靶向RRM2的siRNA药物CALAA-01成为首个进入临床试验的靶向药物,用于治疗实体瘤。但由于其血液循环半衰期较短,Ⅰ期研究被迫中止。研究者认识到,想要改善小核酸类药物的稳定性和疗效,化学修饰和纳米载体等策略必不可少。
2010年,第一个基于RNAi技术治疗黑色素瘤的临床研究获得积极结果。自此,小核酸类药物走上了发展的快车道,希望之光开始从实验室辐射向临床。
小核酸药物的分类与肿瘤作用机制
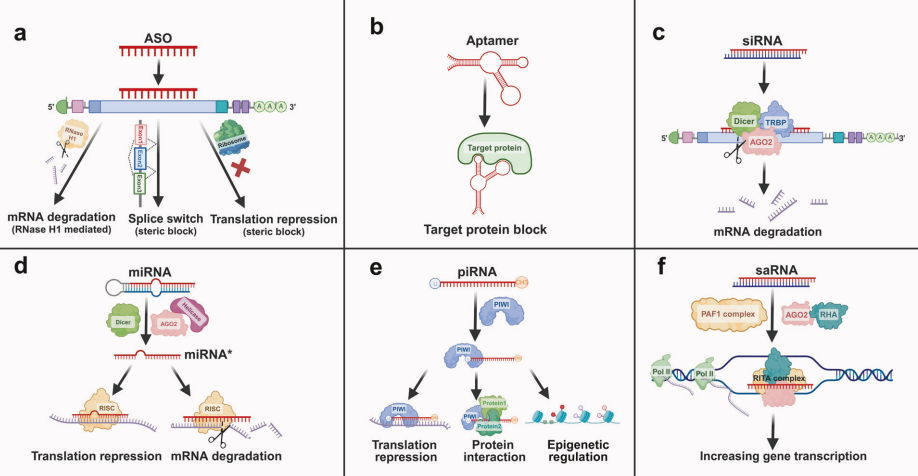
目前在研的小核酸药物主要包括ASO、核酸适配体、siRNA等类型,这些药物通过不同机制靶向肿瘤相关基因。
ASO:单链RNA序列,通过碱基互补结合mRNA或pre-mRNA,诱导RNase H1依赖的降解或通过空间位阻抑制翻译。例如,针对MYC癌基因的ASO可抑制肿瘤细胞增殖。
Aptamer:短单链RNA序列,通过三维构象高亲和力结合肿瘤相关蛋白,如靶向VEGF的派格帕尼钠可阻断肿瘤血管新生。
siRNA:双联互补RNA序列,通过形成RNA诱导沉默复合体(RISC)特异性切割靶mRNA。如靶向PKN3的siRNA药物Atu027可通过抑制肿瘤血管生成抑制转移。
miRNA:内源单链RNA,通过结合到目标mRNA的3' UTR区域,导致翻译抑制或mRNA降解,进而调控多种基因的表达。
piRNA:小的单链RNA,与PIWI蛋白相互作用,调控基因表达、沉默转座子并保持生殖系细胞的基因组稳定。
saRNA:双联RNA序列,结合靶基因的启动子区域,招募转录激活因子或改变染色质结构来增强转录活性,用于上调基因表达,增加相关蛋白质合成。
小核苷酸在肿瘤治疗中的核心优势
1、靶向“不可成药”靶点
传统小分子药物依赖蛋白活性口袋,而小核酸药物可直接靶向非结构域或非分泌型蛋白(如转录因子MYC、KRAS突变体)或者直接干扰靶蛋白的产生,覆盖传统药物难靶向的靶点。
2、长效性与高特异性
小核酸药物的单次给药可持续数周至数月抑制靶基因,且通过序列设计可区分单核苷酸多态性,降低脱靶风险。例如,针对EphA2的siRNA-DOPC脂质体在卵巢癌模型中实现持续抑制肿瘤细胞增殖的效果。
3、克服耐药性
小核酸药物通过靶向耐药相关通路(如STAT3、BCL-2)逆转耐药,或与化疗/免疫治疗联合来增强疗效。临床前研究显示,靶向PLK1的TKM-080301与吉西他滨联用可显著延长胰腺癌模型生存期。
临床进展与突破性案例
截至2025年,全球共有73款小核酸药物进入肿瘤临床试验阶段,涵盖实体瘤与血液肿瘤。其中,最火爆的靶点为TLR9,其余靶点还包括BCL-2、AKT-1、IGF-1R、TGF-β2、TMPRSS6以及COX-2×TGF-β1等。
递送系统的创新与挑战
当前肿瘤靶向递送策略创新主要集中在脂质纳米颗粒(LNP)和工程化外泌体上。调整LNP的磷脂成分、构建新型LNP等策略可以改善递送效率,提高靶向性。外泌体也是有希望的递送体系,当前研究通过表面修饰靶向肽(如RVG、iRGD)等突破血脑屏障,为脑转移患者带来福音。临床试验中,携带抗miR-21 ASO的外泌体在胶质母细胞瘤模型中显著抑制肿瘤生长(NCT04152339)。除有机载体外,一些无机纳米载体如金纳米颗粒(AuNP)也展现出优秀疗效。例如AuNP结合CLPFFD肽可穿越血脑屏障,递送PARP-1 siRNA实现对脑转移瘤的控制。
尽管递送系统群星闪耀,但当前依旧存在诸多问题。其一,在递送效率方面,仅1%的药物可逃离内吞体进入胞质,既影响了疗效,还可能带来脱靶毒性。一些新型pH敏感型脂质(如YSK05)可将逃逸效率提升至20%,有望进一步改善递送效率。第二个需要关注的是脂质体的细胞毒性,阳离子脂质易引发肺损伤,中性脂质体(如DOPC)与PEG化修饰可显著改善安全性。同时,PEG化修饰还可改善药物半衰期,进一步优化疗效。第三个需要解决的是多药递送。siRNA的单靶点干预易引发耐药,多靶点联用(如VEGF+PD-L1 siRNA共递送)或可实现更好的肿瘤控制。
小核酸药物因技术尚未成熟暂时不能“独当一面”,但其与免疫检查点抑制剂、CAR-T等联用或可发挥独特价值。例如,利用siRNA调控肿瘤微环境,为免疫疗法“打好辅助”是很有希望的成才之路。当前已有临床前研究表明,靶向STAT3 siRNA可逆转PD-1抗体耐药。针对患者个体特征的个性化治疗是小核酸药物的重点差异化竞争领域。例如,医生可基于患者肿瘤基因图谱设计个体化siRNA鸡尾酒疗法,实现真正的“精准治疗”。除联合治疗外,进一步优化递送系统,开发光控/磁控释放、条件响应型载体(例如MMP-2激活型纳米颗粒)等智能递送系统也是进一步改善疗效,推动小核酸药物未来发展的重要策略。
总结
小核酸药物凭借其独特机制、较低的开发成本与较高的开发效率,正在重塑肿瘤药物研发与临床治疗格局。尽管递送效率与安全性仍需优化,但随着化学修饰、靶向递送与联合策略的突破,小核酸药物有望为“不可成药”肿瘤靶点提供更好的解决方案,为复发耐药难治性患者带来生的希望。
医术观澜
……
1-
Nature :浙江大学医学院附属第一医院梁廷波教授为难治性肝细胞癌开发溶瘤病毒VG161并开展一项Ⅰ期研究验证安全性和有效性,同时构建疗效预测模型 [1]。
肝细胞癌在亚洲患者尤其是中国男性患者中发病率较高,其二线治疗失败后的治疗选择有限。溶瘤病毒可选择性地在肿瘤细胞中复制并导致肿瘤裂解,从而释放出肿瘤新抗原并刺激抗肿瘤免疫,是一种有希望的免疫疗法。VG161是表达IL-12、IL-15、IL-15Rα和PD-1-PD-L1阻断融合蛋白的工程化单纯疱疹病毒。
本研究评估了VG161的多中心Ⅰ期研究结果。在所有患者中,VG161耐受良好,未观察到剂量限制性毒性。在疗效方面,VG161可重塑肿瘤免疫微环境,重新致敏对既往全身治疗耐药的肿瘤。此外,既往对PD-1/PD-L1阻断敏感的患者在接受VG161后表现出增强的疗效,表明VG161与免疫疗法可能具有协同作用。最后,研究团队开发了一种基于差异表达基因的疗效预测模型,该模型可识别可能从VG161获益的患者,该群体具有更长的OS。
基于以上研究结果,VG161有望成为难治性肝细胞癌有希望的三线治疗选择。
药事纵横
……
1-
Signal Transduction and Targeted Therapy :北京大学肿瘤医院沈琳教授公布双特异性抗HER2抗体KN026联合双特异性抗CTLA-4/PD-L1抗体KN046治疗晚期HER2阳性非乳腺癌患者疗效和安全性的ⅠB/Ⅱ期研究结果 [2]。
曲妥珠单抗是HER2靶向治疗的一线标准治疗,但仍有相当一部分患者未能从曲妥珠单抗治疗中获得显著益处。此外,很大一部分患者无法耐受化疗的副作用或拒绝化疗,这一部分患者需要新的去化疗联合方案。KN026是靶向HER2(ECD2和ECD4)的双特异性抗体,为评估其用于晚期HER2阳性实体瘤患者的疗效和安全性,研究者开展了ⅠB/Ⅱ期研究,主要终点为安全性、MDT、ⅠB期研究的RP2D和Ⅱ期研究的ORR和DOR。
本研究分析结果纳入113例非乳腺癌患者,包括74例胃癌、26例结直肠癌和13例其他实体瘤。所有患者均为pMMR/MSS,91.2%的患者为HER2阳性,60.5%的患者为PD-L1阳性。在GC患者中,有39例采用该方案作为一线治疗方案。其余患者均接受过其他治疗,其中30例接受过抗HER2治疗,18例接受过PD-1/PD-L1阻断治疗,7例患者同时接受过这两种治疗。
ⅠB期未达到DLT,5 mg/kg Q3W的KN026和KN046被确定为RP2D。共108例患者完成疗效评估,99例是HER2阳性。ORR为55.6%,DCR为83.3%,CBR达到61.1%。在既往接受过抗HER2治疗的患者中,51.9%达到PR。在既往接受过PD-1/PD-L1阻断治疗的患者中,60.0%达到PR。在既往接受过上述两种治疗的患者中,ORR也达到了66.7%。ⅠB期研究发现HER2阳性患者获益显著高于HER2低表达或突变的患者,因此Ⅱ期仅纳入HER2阳性患者,且入组了部分初治患者。在Ⅱ期研究中,初治GC患者中PR率为76.3%,ORR和DCR分别为78.9%和89.5%。中位DOR为13.4个月,中位PFS为11.0个月,中位OS未达到。而在二线GC患者中,PR率和ORR均为44.4%,DCR达85.2%。中位DOR为10.8个月,中位PFS为5.3个月。
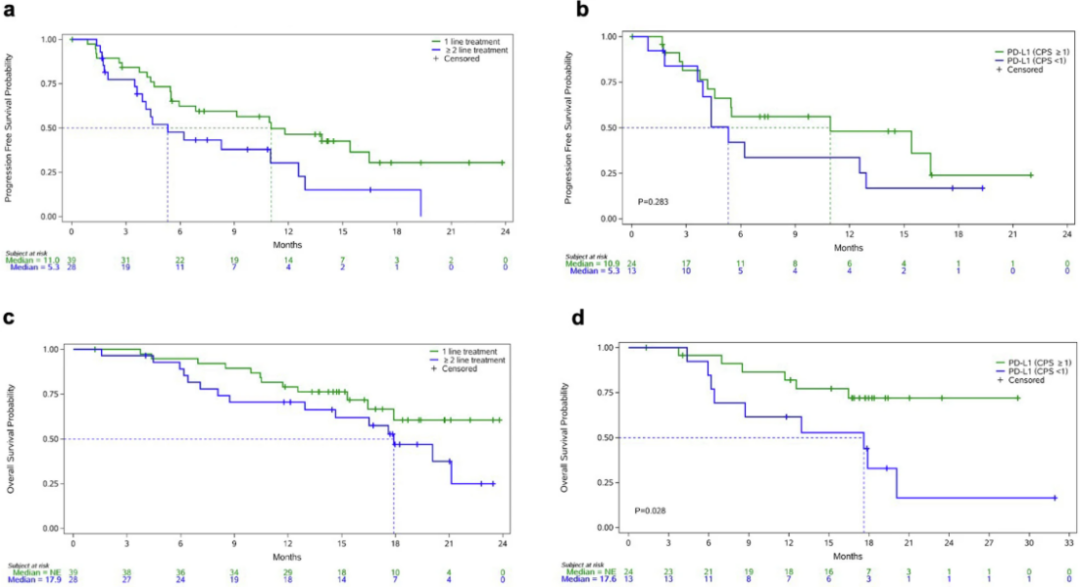
在HER2阳性的其他实体瘤患者中,ORR为52.9%,无CR,DCR为91.2%。中位DOR为5.0个月,中位PFS为5.6个月。
安全性方面,3级及以上TRAE发生率为35%,9.7%和17.7%的患者分别对KN026和KN046永久停药。
对于HER2靶向治疗,越后线疗效越差,因此KN026可向更前线推进。研究也探索了其用于一线的疗效,相比其他同类研究可能效果更优。此外,无化疗方案改善了患者耐受,但仍需关注输液相关反应风险的显著增加和可疑的肺动脉高压。
2-
Nature Medicine :中山大学肿瘤防治中心赵洪云教授公布靶向B7H3的ADC YL201在晚期实体瘤中的Ⅰ/ⅠB期数据 [3]。
YL201是一种靶向B7H3的新型ADC,利用肿瘤微环境可激活的连接子-有效载荷平台,采用可切割的连接子,可被蛋白酶切割。
本研究评估了YL201在标准疗法难治性晚期实体瘤患者中的安全性、药代动力学和初步疗效。该试验包括剂量递增部分和剂量扩展部分。研究共纳入312例患者,涉及多种肿瘤类型,包括ES-SCLC、鼻咽癌(NPC)、NSCLC、食管鳞状细胞癌和其他实体瘤。最大耐受剂量确定为2.8 mg/kg,推荐的扩展剂量选择为2.0 mg/kg和2.4mg/kg,每3周一次。在ES-SCLC(ORR:63.9%)、NPC(ORR:48.6%)、肺腺癌(ORR:28.6%)和淋巴上皮瘤样癌(ORR:54.2%)患者中均观察到疗效。未发现B7H3膜表达与ORR之间存在显著相关性。
最常见的3级及以上TRAE包括中性粒细胞减少症(31.7%)、白细胞减少症(29.5%)和贫血(25.0%)。仅观察到4例间质性肺病(1.3%)和1例输液反应(0.3%)。
YL201在既往接受过大量治疗的晚期实体瘤患者中显示出可接受的安全性和有希望的疗效,尤其是在ES-SCLC、NPC或淋巴上皮瘤样癌患者中。
医谷回声
……
1-
Nature Medicine :广东省人民医院吴一龙教授分析奥希替尼辅助治疗已切除的EGFR突变早期NSCLC患者MRD变化趋势 [4]。
奥希替尼被推荐用于可切除的ⅠB-ⅢA期EGFR突变NSCLC患者的辅助治疗。但是,ADAURA研究观察到完成3年辅助治疗后DFS事件发生率增加的趋势,这表明一些患者可能受益于更长时间的奥希替尼辅助治疗。研究对ADAURA研究220例患者进行MRD分析,发现MRD先于影像学DFS事件发生,中位时间为4.7个月。36个月时奥希替尼组和安慰剂组DFS和MRD无事件率为86% vs 36%,奥西替尼组68%的DFS或MDR事件发生中停用奥希替尼后,停药12个月后这一比例是58%。基于这一趋势,研究者认为可对MRD阳性患者进行更长时间的奥希替尼辅助治疗,但这一观点需要进一步的临床证据。
高峰科讯
……
1-
Nature Cancer :中山大学崔隽教授开发了一种ZDHHC8抑制剂,可减弱GPX4棕榈酰化,增强铁死亡敏感性 [5]。
谷胱甘肽过氧化物酶4(GPX4)是一种减轻脂质过氧化的关键酶,而含有锌指DHHC结构域的蛋白8(zDHHC8)是一种在多种肿瘤中高度表达的S-酰基转移酶,可在Cys75位点使GPX4棕榈酰化。
研究者开发了一种zDHHC8特异性抑制剂PF-670462,可促进zDHHC8降解,缓解GPX4棕榈酰化并通过促进CD8 +T细胞诱导的肿瘤细胞铁死亡。研究者在B16-F10异种移植模型中使用PF-670462协同促进了免疫治疗的疗效,证明了PF-670462在抗肿瘤治疗中的潜在价值。
2-
Advanced Materials :苏州医科大学第一附属医院杨凯教授开发了一种TREM2 scFv-工程大肠杆菌,通过调节巨噬细胞促进肿瘤放射联合免疫治疗 [6]。
术前新辅助放化疗是治疗低位结直肠癌的主要方案,但部分患者对该疗法不敏感。
TREM2巨噬细胞在这些患者肿瘤中起到了关键作用。因此,研究者使用工程化Nissle 1917大肠杆菌表达抗TREM2的scFv片段,用来调节免疫治疗。这些大肠杆菌释放的TREM2-scFv可精确靶向TREM2巨噬细胞并逆转免疫异质性肿瘤微环境,并且协同抗PD-L1免疫疗法。此外,工程菌还可进一步改善肠道微生物群,进一步增强抗肿瘤作用。
刊后语
大风泱泱,大潮滂滂;大道如砥,医者无疆。
积跬步以至千里,每一期周刊都是恶性肿瘤学科发展的剪影;积小流以成江海,一年周刊浓缩肿瘤领域各科前沿进展的精华!关注CACA周刊,带你领略恶性肿瘤学科发展的四季花开。
CACA周刊,我们下周不见不散!
编辑 | 李瑞源
排版 | 晓晓
审核 | 李瑞源
链接:http://www.lewenyixue.com/2025/04/01/%E3%80%90CACA%E5%89%8D%E6%B2%BF%E5%91%A8%E5%88%8A%E3%80%9191%E6%9C%9F%20%E5%B0%8F%E6%A0%B8%E9%85%B8%E8%8D%AF%E7%89%A9%E2%80%94/






赶快来坐沙发