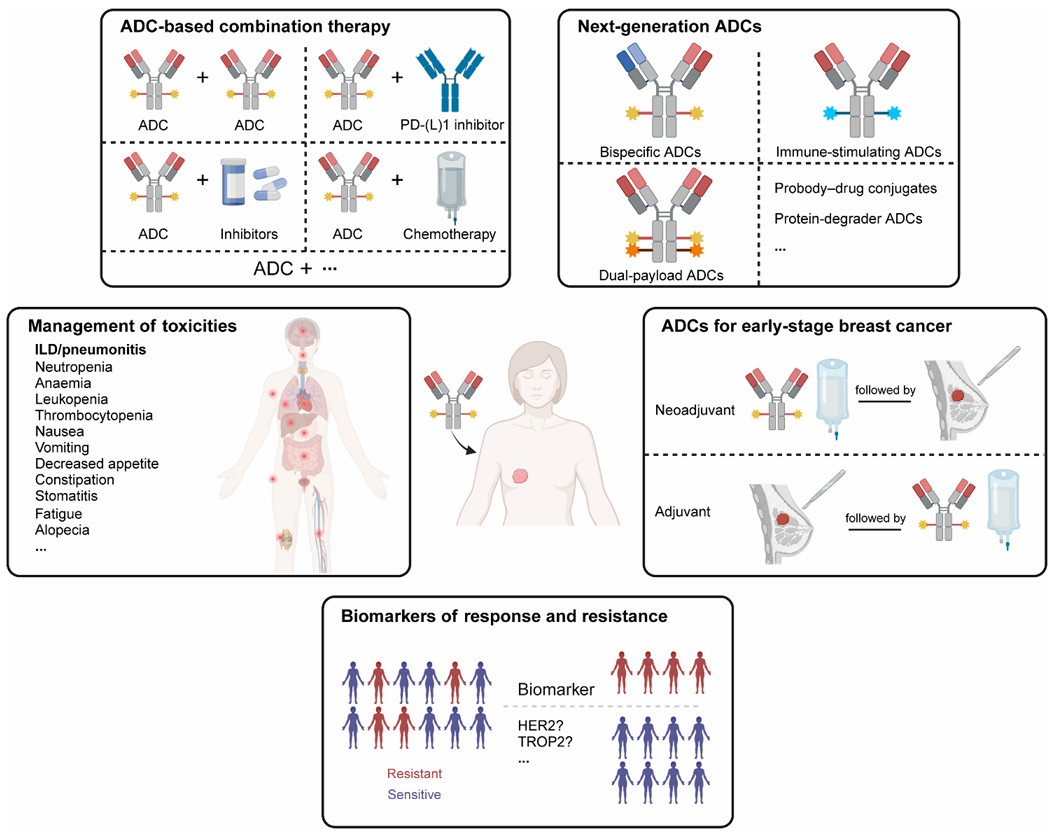
ADC在乳腺癌目前的进展和未来的方向
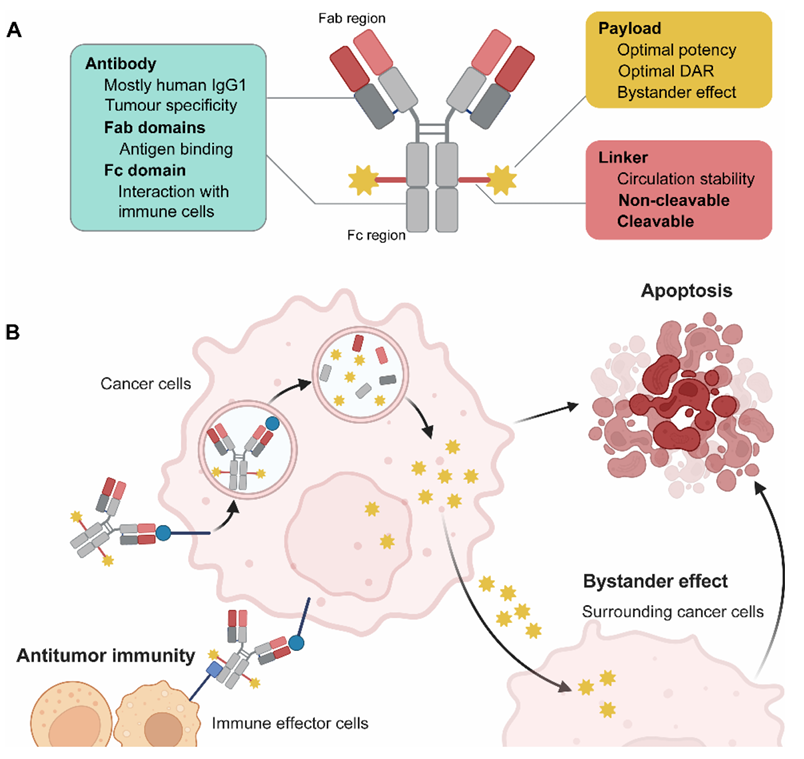
HER2靶向ADCs
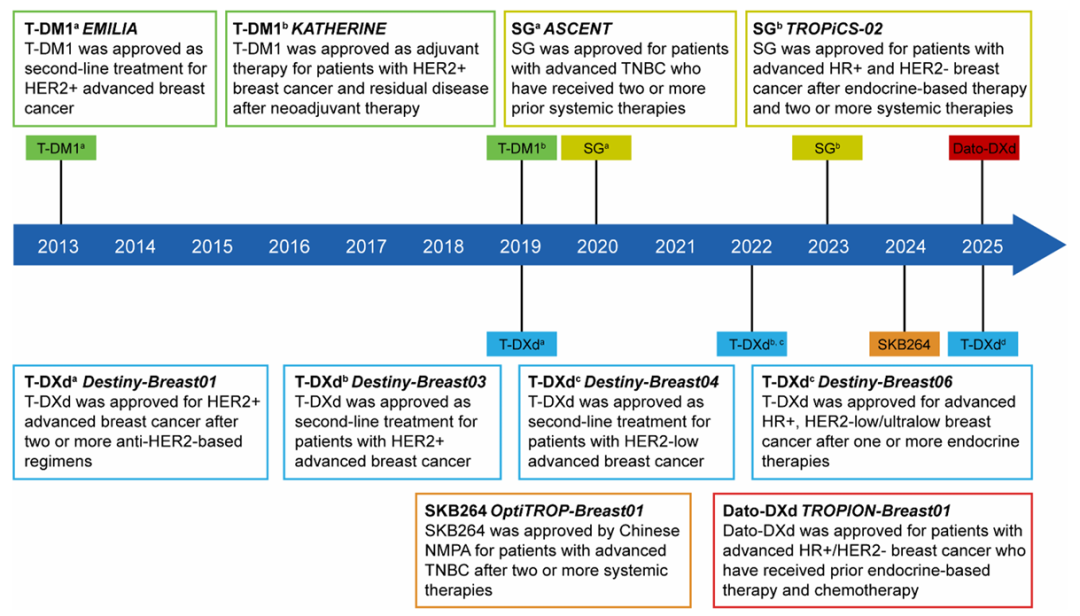
T-DM1(Ado-trastuzumab emtansine)是 首个获批用于治疗HER2阳性乳腺癌的ADC药物,由曲妥珠单抗通过不可切割连接子与微管抑制剂DM1连接,药物抗体比(DAR)为3.5。
T-DXd(Trastuzumab deruxtecan)是 一种新型HER2靶向ADC,具有可切割的四肽连接子和拓扑异构酶I抑制剂有效载荷DXd,DAR高达8。
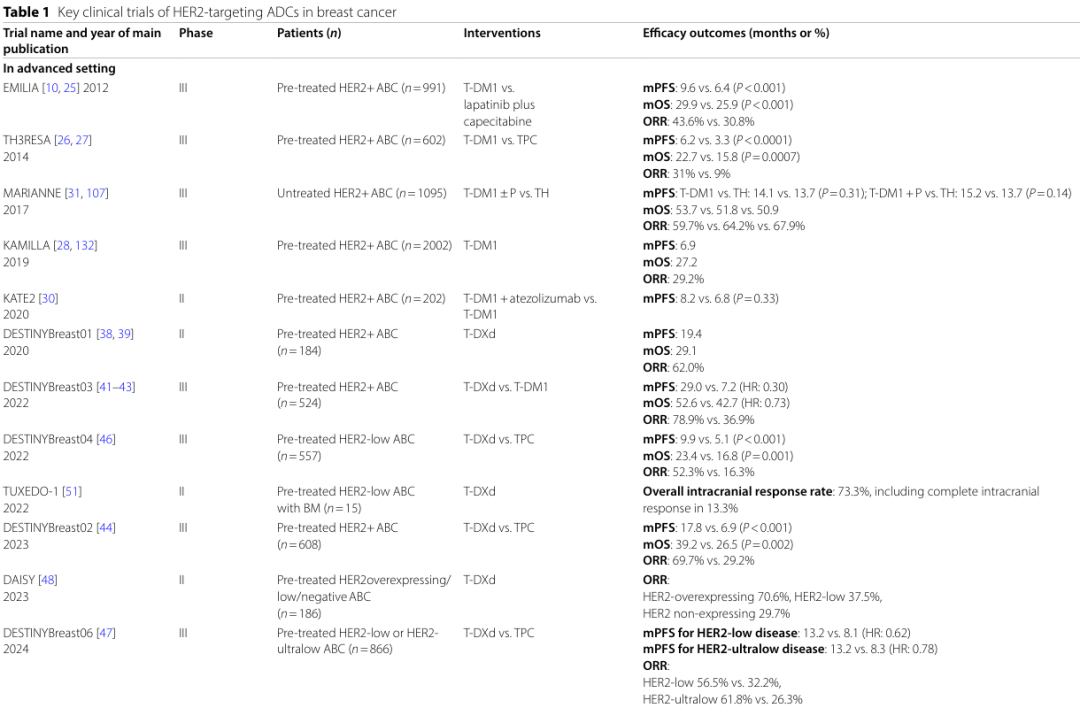
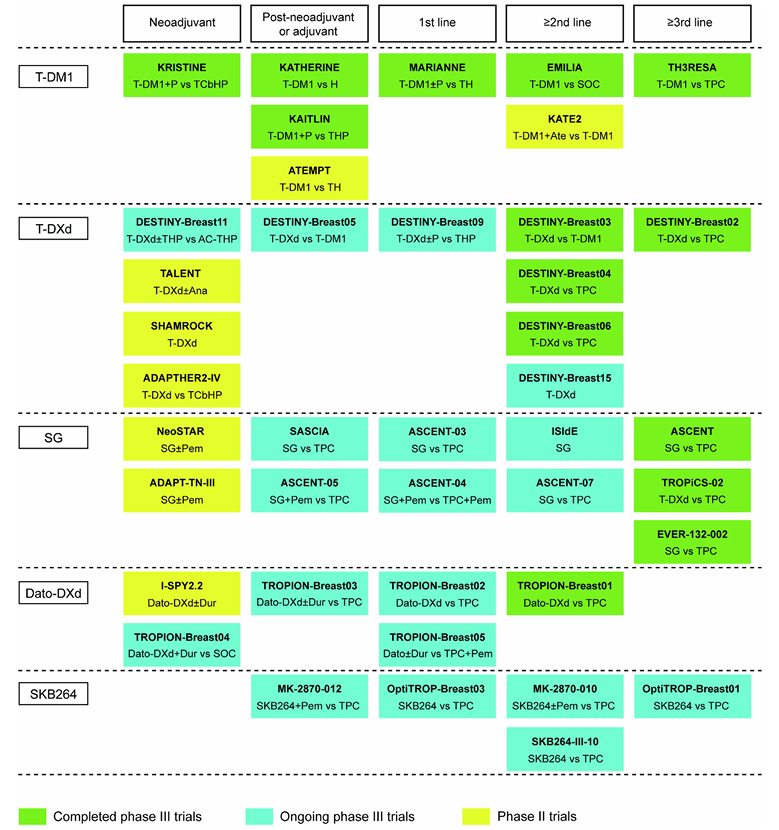
如下表1,HER2靶向ADCs(如T-DM1和T-DXd)在HER2阳性乳腺癌和HER2低表达乳腺癌中显示出显著的疗效,显著延长了PFS和OS,并提高了ORR。
T-DM1(Ado-trastuzumab emtansine) :
-
EMILIA试验 :与拉帕替尼+卡培他滨相比,T-DM1显著延长了PFS(9.6个月 vs. 6.4个月)和OS(30.9个月 vs. 25.1个月),且3级及以上不良事件(AEs)发生率更低(41% vs. 57%)。
-
TH3RESA试验 :在三线及以后的治疗中,T-DM1显著延长了PFS(6.2个月 vs. 3.3个月)和OS(22.7个月 vs. 15.8个月)。
-
KAMILLA试验 :在HER2阳性晚期乳腺癌患者中,T-DM1的中位PFS为6.9个月,中位OS为27.2个月。
-
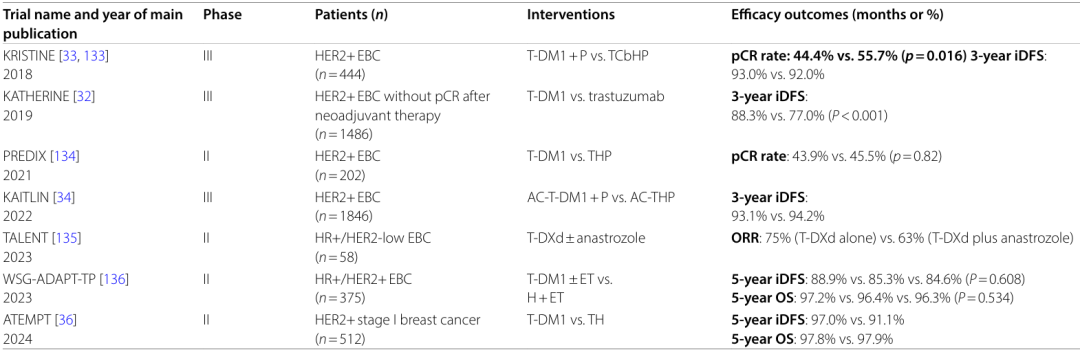
KATHERINE试验 :在新辅助治疗后有残留病灶的HER2阳性早期乳腺癌患者中,T-DM1作为辅助治疗显著降低了复发风险(3年无浸润性疾病生存率:88.3% vs. 77.0%)。
T-DXd(Trastuzumab deruxtecan) :
-
DESTINY-Breast01试验 :在经多线治疗的HER2阳性晚期乳腺癌患者中,T-DXd的中位PFS为19.4个月,中位OS为29.1个月,ORR为62.0%。
-
DESTINY-Breast03试验 :与T-DM1相比,T-DXd显著延长了PFS(29.0个月 vs. 7.2个月)和OS(52.6个月 vs. 42.7个月),ORR更高(78.9% vs. 36.9%)。
-
DESTINY-Breast04试验 :在HER2低表达晚期乳腺癌患者中,T-DXd显著延长了PFS(9.9个月 vs. 5.1个月)和OS(23.4个月 vs. 16.8个月),ORR为52.3% vs. 16.3%。
-
DESTINY-Breast06试验 :在HER2低表达或超低表达晚期乳腺癌患者中,T-DXd显著延长了PFS(13.2个月 vs. 8.1个月和8.3个月),ORR分别为56.5% vs. 32.2%和61.8% vs. 26.3%。
TROP2靶向ADCs:
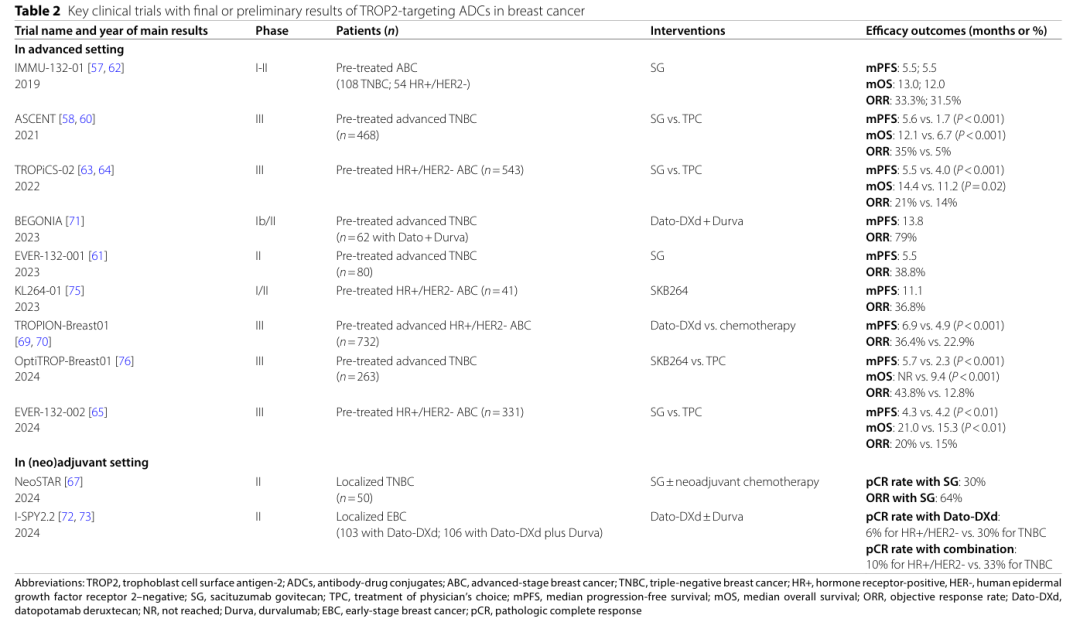
SG(Sacituzumab govitecan)是 首个TROP2靶向ADC,由抗Trop2抗体通过可切割连接子与拓扑异构酶I抑制剂SN-38连接,2020 年 4 月获得 FDA 加速批准用于治疗转移性三阴性乳腺癌。
SKB264(Sacituzumab tirumotecan)是 一种TROP2靶向ADC,与SG为相同TROP2单克隆抗体(hRS7),但具有不同的连接子和有效载荷。于2024年11月22日在中国获批治疗局部晚期或转移性三阴性乳腺癌,2025年3月10日 获批新适应症局部晚期或转移性EGFR突变非小细胞肺癌。
Dato-DXd(Datopotamab deruxtecan) 由抗TROP2抗体与DXd通过可切割连接子连接。2024 年 12 月在日本获批上市,用于治疗既往接受过化疗的成年人 HR 阳性、 HER2 阴性( IHC 0 、 IHC 1+ 或 IHC 2+/ISH- )不可切除或复发乳腺癌患者。
SG(Sacituzumab govitecan) :
-
IMMU-132-01试验 :在经多线治疗的三阴性乳腺癌(TNBC)患者中,SG的中位PFS为5.5个月,中位OS为13.0个月,ORR为33.3%。
-
ASCENT试验 :与化疗相比,SG显著提高了ORR(35% vs. 5%)、PFS(5.6个月 vs. 1.7个月)和OS(12.1个月 vs. 6.7个月)。
-
TROPiCS-02试验 :在经内分泌治疗的HR+/HER2-晚期乳腺癌患者中,SG显著延长了PFS(5.5个月 vs. 4.0个月)和OS(14.4个月 vs. 11.2个月),ORR为21% vs. 14%。
-
EVER-132-002试验 :在亚洲HR+/HER2-晚期乳腺癌患者中,SG显著延长了PFS(4.3个月 vs. 4.2个月)和OS(21.0个月 vs. 15.3个月),ORR为20% vs. 15%。
Dato-DXd(Datopotamab deruxtecan) :
-
TROPION-PanTumor01试验 :在经多线治疗的HR+/HER2-和TNBC患者中,Dato-DXd的ORR分别为26.8%和31.8%,中位PFS分别为8.3个月和4.4个月。
-
TROPION-Breast01试验 :与化疗相比,Dato-DXd显著延长了PFS(6.9个月 vs. 4.9个月)和ORR(36.4% vs. 22.9%)。
-
BEGONIA试验 :Dato-DXd联合durvalumab作为一线治疗TNBC,ORR为79%,中位PFS为13.8个月。
SKB264(Sacituzumab tirumotecan) :
-
OptiTROP-Breast01试验 :在TNBC患者中,与化疗相比,SKB264显著延长了PFS(5.7个月 vs. 2.3个月),ORR为43.8% vs. 12.8%。
-
KL264-01试验 :在HR+/HER2-晚期乳腺癌患者中,SKB264的中位PFS为11.1个月,ORR为36.8%。

链接:http://www.lewenyixue.com/2025/03/27/ADC%E5%9C%A8%E4%B9%B3%E8%85%BA%E7%99%8C%E7%9B%AE%E5%89%8D%E7%9A%84%E8%BF%9B%E5%B1%95%E5%92%8C%E6%9C%AA%E6%9D%A5%E7%9A%84%E6%96%B9%E5%90%91/





赶快来坐沙发