中国奇迹!西京医院发表nature:世界首例猪肝人体移植成功,器官移植开启新纪元

器官荒的救星:为什么选择猪?
全球每年有数百万患者因等不到器官移植而死亡。猪因其器官大小、生理功能与人类高度相似,被视为“天然器官库”。但直接移植会引发致命的免疫排斥反应——猪细胞表面的 α-半乳糖抗原 会让人体免疫系统发起超强攻击。
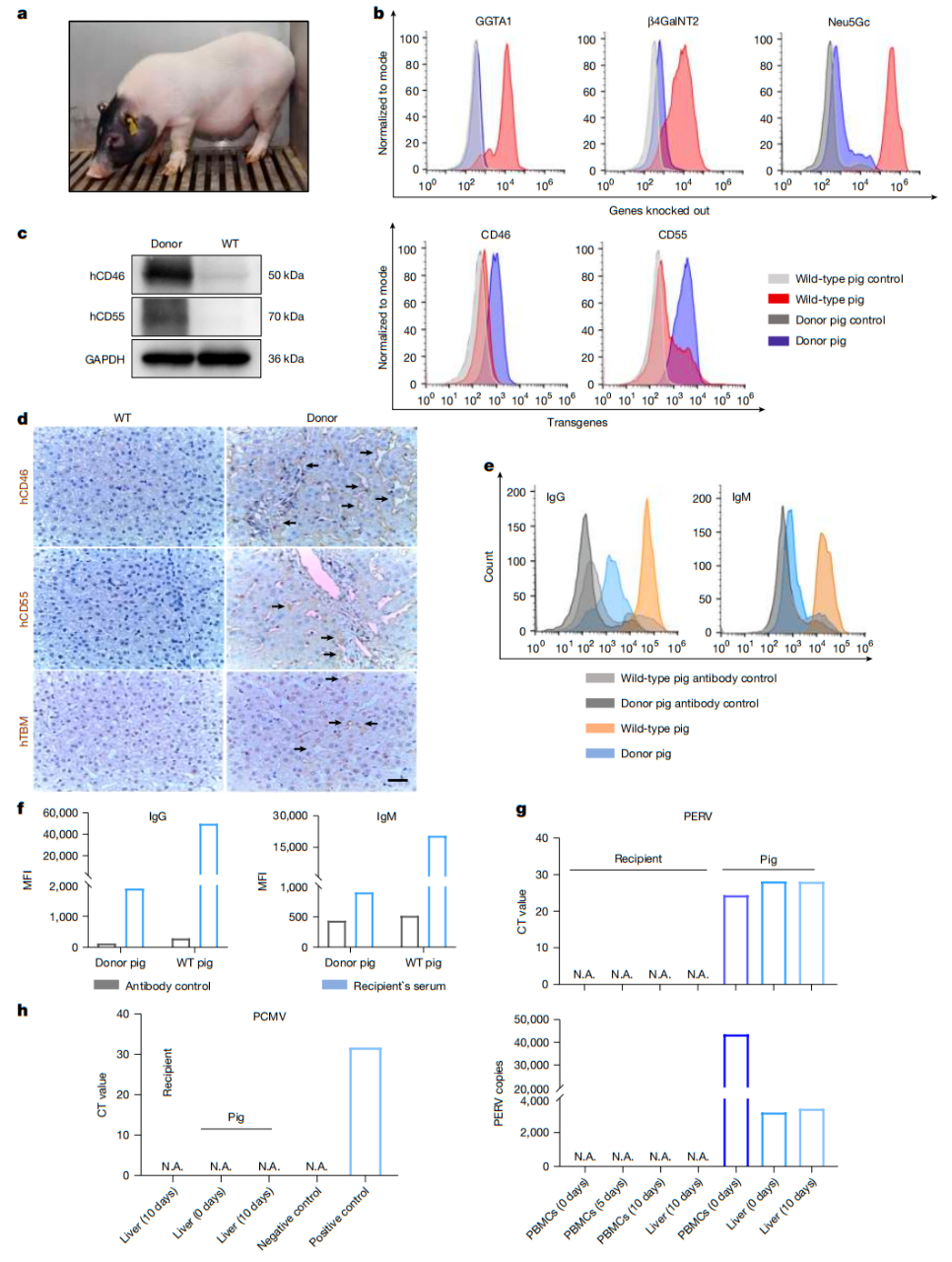
为此,中国科研团队对供体猪 ( 巴马小型猪) 进行了六基因改造:
删除猪的三大“危险分子”基因 : GTKO 、 CMAH 和 B4GALNT2 ,这三个猪基因会表达引起 超急性排斥和急性体液性排斥的猪抗原;
加入了 三重“保护盾”基因 :人类 补体调节蛋白基因 hCD46 、 hCD55 ,人类 凝血调节蛋白基因 hTBM ,前两个人类基因能够抑制免疫攻击,第三个人类基因能够防止凝血紊乱。
一场精密的外科实验
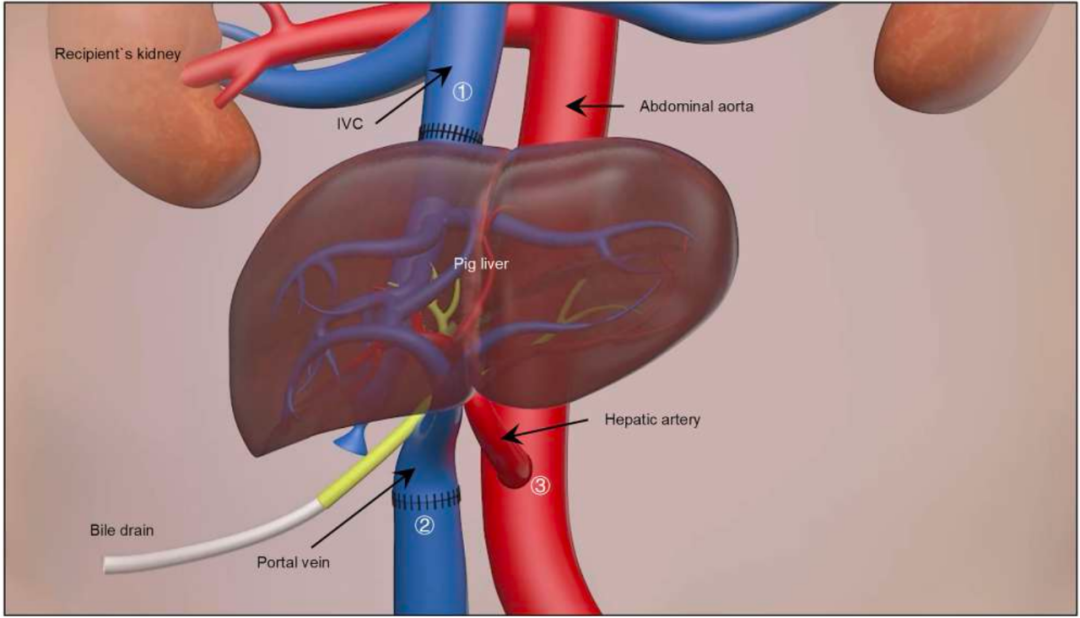
研究团队选择了一名被诊断为脑死亡但生命体征稳定的患者作为受体, 在医院伦理委员会严格的监督下,研究团队 采用异位辅助肝移植方案,将上述基因改造的猪肝脏移植到该脑死亡患者体内,而不切除患者原有肝脏 (该手术于 2024 年 3 月 10 日进行) 。
手术关键步骤包括:
1、将猪肝的肝动脉连接患者腹主动脉;
2、猪门静脉对接患者下腔静脉;
3、建立胆汁外引流通道。
移植手术后 10 天监测显示:
功能性指标 :移植后 2 小时即产生金黄色胆汁,10 天内累计分泌 66.5 毫升;猪血清白蛋白持续升高;
血液动力学 :肝动脉血流速度稳定在 41.45-60.63 cm/s;
无严重排斥 :组织学检查显示肝脏再生良好,未发现典型排斥反应。
免疫系统的“攻防战”
为控制排异反应,研究团队制定了多靶点免疫抑制方案:
术前 :抗胸腺细胞球蛋白 (清除T细胞) + 补体抑制剂 (防超急性排斥) ;
术后 :他克莫司+霉酚酸酯 (经典抗排异药) + 利妥昔单抗 (抑制B细胞活化) 。
结果令人振奋:T 细胞活性被有效抑制,B 细胞虽在第 3 天短暂激活,但被及时控制。炎症因子 (例如 IL-6、TNF-α) 水平始终处于低位,补体沉积极少。
未来挑战与希望
虽然该研究仅持续 10 天,但已传递出关键信息:
安全性可控 :未检测到猪内源性逆转录病毒 (PERV) 和猪巨细胞病毒 (PCMV) 传播;
凝血难题突破 :血小板和凝血时间波动后恢复正常, hTBM 基因显效;
窦科峰 院士表示, 这是医学界第一次将基因改造猪肝植入人体内,在目前观察的96小时内, 移植的基因改造猪肝脏,在人体内能够发挥生理功能,正常分泌胆汁,说明有可能替代人类肝脏 。该项研究的顺利开展,是异种器官移植领域的重大突破,也是异种肝移植向临床迈进的关键一步,为下一步的临床应用提供了理论依据和数据支撑。
猪器官,来自中国团队
提供该研究中基因改造供体猪的 成都中科奥格生物科技有限公司 由 潘登科 研究员于 2018 年创立,该公司 旨在打造 “未来器官工厂”,开发可供人体移植的异种器官、生物医用材料、疾病模型实验猪等等。
链接:http://www.lewenyixue.com/2025/03/27/%E4%B8%AD%E5%9B%BD%E5%A5%87%E8%BF%B9%EF%BC%81%E8%A5%BF%E4%BA%AC%E5%8C%BB%E9%99%A2%E5%8F%91%E8%A1%A8nature%EF%BC%9A%E4%B8%96%E7%95%8C/





赶快来坐沙发