【柳叶刀血液病学】印度低成本CAR-T治疗复发难治B细胞肿瘤的1/2期研究结果
在不发达国家,复发或难治性B细胞恶性肿瘤的治疗结局较差,主要是因为缺乏有效的治疗方法。例如,印度每年约有10万人诊断为B细胞急性淋巴细胞白血病(B-ALL)和非霍奇金淋巴瘤(NHL),其中约2万人会发展为复发或难治性疾病。由于缺乏如贝林妥欧单抗和格菲妥单抗等有效疗法,以及骨髓移植单位的短缺和高昂的治疗费用,很多患者难以获得治疗。因此,开发一种有效且毒性较低的CAR-T细胞疗法,对于满足这些国家的未满足需求、提高可及性和可行性至关重要。
Talicabtagene autoleucel也称actalycabtagene autoleucel或HCAR19,是一种新型人源化 CD19 CAR-T 细胞疗法。早在2023 年便在印度获批用于治疗复发/难治性 B 细胞淋巴瘤和复发/难治性 B 细胞急性淋巴细胞白血病,价格为3万美元,近日《The Lancet Haematology》报道了其1/2期研究结果。

这项开放标签、多中心1/2期研究在印度的六家三级癌症中心进行。研究分为两个阶段:
1期部分:单中心研究,纳入≥18岁复发或难治性B细胞淋巴瘤患者。
2期部分:单臂、多中心、篮式试验,纳入≥15岁复发或难治性B细胞急性淋巴细胞白血病或B细胞淋巴瘤患者。
通过血细胞分离术获取至少1×10 ⁹淋巴细胞以制造CAR-T细胞。清淋方案为环磷酰胺500 mg/m²和氟达拉滨30 mg/m²连续3天,或苯达莫司汀90 mg/m²连续2天。随后,患者在1期接受1×10 ⁷–5×10 ⁹CAR T细胞的分次输注(第0、1、2天分别输注10%、30%和60%),在2期接受至少5×10 ⁶CAR T细胞/kg(最多可达2×10 ⁹CAR T细胞)的单次输注。
主要终点为安全性(第1阶段)和总缓解率(第2阶段)。疗效分析在疗效可评估队列中进行(接受目标剂量和3天淋巴耗竭治疗的所有患者),安全性分析在安全性人群中进行(接受Talicabtagene autoleucel的所有患者)。

患者:共纳入64例患者,其中1期14例,2期50例。整体队列的中位年龄为44岁(IQR 27–57),49例(77%)为男性,15例(23%)为女性。
安全性:1期部分未观察到剂量限制性毒性,选择至少5×10 ⁶CAR T细胞/kg作为2期剂量。最常见的3级或更严重的毒性事件为血液学事件,包括贫血(61%)、血小板减少症(65%)、中性粒细胞减少症(96%)和发热性中性粒细胞减少症(47%)。共发生2例治疗相关死亡,1例因发热性中性粒细胞减少症、免疫效应细胞相关噬血细胞性淋巴组织细胞增多症和败血性休克死亡,另1例因肺出血、多器官功能障碍综合征和细胞因子释放综合征死亡。
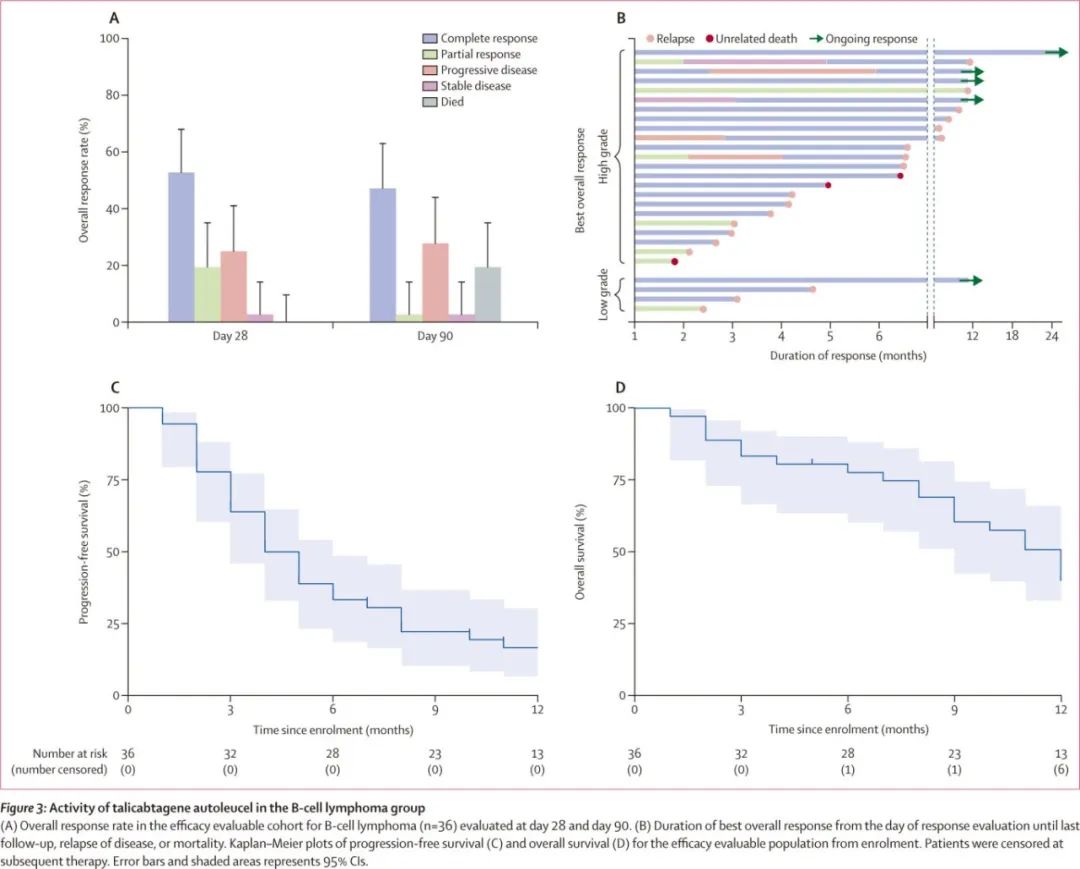
疗效:在51例疗效可评估的患者中(36例B细胞淋巴瘤患者和15例B细胞急性淋巴细胞白血病患者),总缓解率为73%(37/51)。在B细胞急性淋巴细胞白血病患者中,总缓解率为73%(11/15),且所有11例患者均达到完全缓解,其中10例患者达到微小残留病阴性。B细胞淋巴瘤患者的总缓解率为72%(26/36),完全缓解率为53%(19/36)。中位缓解持续时间在B细胞急性淋巴细胞白血病患者中未达到,在B细胞淋巴瘤患者中为4.0个月。B细胞急性淋巴细胞白血病患者的中位无进展生存期为6.0个月,B细胞淋巴瘤患者为4.0个月。B细胞急性淋巴细胞白血病患者的中位总生存期未达到,B细胞淋巴瘤患者为12.0个月。

Talicabtagene autoleucel在复发或难治性B细胞恶性肿瘤患者中显示出可控的安全性和持久的抗肿瘤活性。但还需要在更大样本量和更早线探索,并延长随访时间以验证该研究结果。也需要实施区域分散制造以及探索更广泛患者群体的真实世界数据。
参考文献
Jain H, et al.Talicabtagene autoleucel for relapsed or refractory B-cell malignancies: results from an open-label, multicentre, phase 1/2 study.Lancet Haematol . 2025 Mar 13:S2352-3026(24)00377-6. doi: 10.1016/S2352-3026(24)00377-6.
链接:http://www.lewenyixue.com/2025/03/27/%E3%80%90%E6%9F%B3%E5%8F%B6%E5%88%80%E8%A1%80%E6%B6%B2%E7%97%85%E5%AD%A6%E3%80%91%E5%8D%B0%E5%BA%A6%E4%BD%8E%E6%88%90%E6%9C%ACCAR-T%E6%B2%BB/







赶快来坐沙发