BMC Pediatrics|王景福团队发表GD2单抗一线维持治疗高危神母细胞瘤的单中心临床研究
Dinutuximab beta是一种人-鼠嵌合型抗GD2 单克隆抗体(ch14.18/CHO),在临床前和早期临床研究中展现了针对神经母细胞瘤的靶向特异性。欧洲药品管理局(EMA)批准 dinutuximab beta 用于 HR-NB 及复发/难治性神经母细胞瘤患者的治疗,并已成为 HR-NB 患者在接受早期多模式治疗后至少达到部分缓解(PR)时的标准维持治疗方案。中国国家药品监督管理局于 2021 年 8 月批准 dinutuximab beta 用于 12 个月及以上 HR-NB 及复发/难治性神经母细胞瘤患者的治疗。
另一种抗 GD2 单克隆抗体 Dinutuximab 于 2015 年获美国 FDA 批准。一项随机对照试验表明,dinutuximab 联合白细胞介素-2(IL-2)、粒细胞-巨噬细胞集落刺激因子(GM-CSF)及异维甲酸可改善 HR-NB 患者的维持治疗预后。GM-CSF 可增加循环中性粒细胞的数量并增强其活性,与 dinutuximab 联合使用可增强抗体依赖的细胞介导细胞毒性(ADCC),提高抗肿瘤效应。此外,GM-CSF 还能促进 M1 型巨噬细胞的极化,并在化疗后促进肿瘤坏死因子的释放。目前尚无临床试验数据支持GM-CSF 与 dinutuximab beta 联合使用,但基于其潜在获益,中国 HR-NB 治疗共识建议将 GM-CSF 纳入治疗方案。然而,在中国,关于 dinutuximab beta 在真实世界临床实践中的应用数据仍然有限。
近日,山东省肿瘤医院/山东省第一医科大学/山东省医学科学院的 王景福等 在 BMC Pediatrics 发表题为 A clinical observational study of dinutuximab beta as first-line maintenance treatment for patients with high-risk neuroblastoma in China 的 论文 , 总结了其中心在2021年10月至2023年11月间将Dinutuximab β作为新诊断的高危神经母细胞患儿一线维持治疗的疗效与安全性, 我们一起来了解下。
入组标准: 新诊断的HR-NB患者,在接受免疫治疗前达到完全缓解(CR)、极佳部分缓解(VGPR)或部分缓解(PR);年龄≥12 个月;并符合国际神经母细胞瘤分期系统(INSS)标准,即诊断为 4 期神经母细胞瘤,或 2 期或 3 期但伴有 MYCN扩增的神经母细胞瘤。
本研究共纳入 51 例高危神经母细胞瘤患儿,所有患者均完成随访。免疫治疗开始至研究截止日的中位随访时间为 26 个月(范围:15−36 个月)。患者确诊时的中位年龄为 36 个月(范围:6−108 个月),其中男性占 56.9%(n=29)。绝大多数患者(n=50, 98%)被诊断为 INSS 4 期神经母细胞瘤,仅 1 例(2%)为 INSS 3 期且伴有MYCN 扩增。共有 12 例患者(23.5%)存在 MYCN 扩增,20 例患者(39.2%)检测到 11q 缺失。在 INSS 4 期神经母细胞瘤患者中,最常见的转移部位为骨(n=37, 72.5%)和骨髓(n=32, 62.7%)。在巩固治疗阶段,9 例患者(17.6%)接受了 2 轮大剂量化疗后行自体外周血干细胞移植(ASCT),36 例患者(70.6%)接受单次移植,而 6 例患者(11.8%)未行移植,仅接受放疗。
在接受 dinutuximab beta 治疗前,18 例患者(35.3%)达到完全缓解(CR),12 例患者(23.5%)达到极佳部分缓解(VGPR,其中 2 例仅残留微小骨髓病灶),21 例患者(41.2%)达到部分缓解(PR)。共有 27 例患者仅有骨转移,2 例仅有骨髓浸润,另有 2 例患者同时存在骨和骨髓转移。
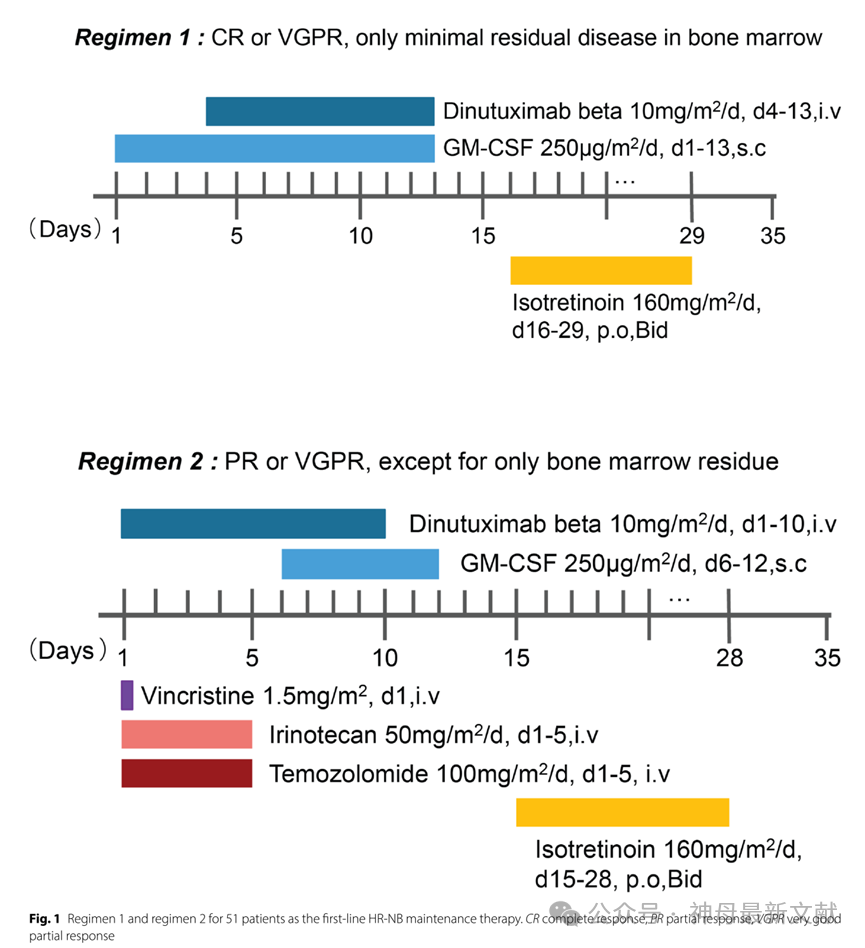
图1. 针对 51 名患者的一线 HR-NB 维持治疗方案 1 和方案2。CR:完全缓解,PR:部分缓解,VGPR:极佳部分缓解。
对于达到完全缓解(CR)或极佳部分缓解(VGPR,仅残留微小骨髓病灶)的患者,采用方案 1(dinutuximab beta 联合 GM-CSF 和异维甲酸);对于达到部分缓解(PR)或 VGPR(但不仅限于微小骨髓残留)的患者,采用方案 2(dinutuximab beta 联合 GM-CSF、异维甲酸及化疗)。
患者接受 dinutuximab beta 维持治疗的方案为:剂量 10 mg/m²,每日一次,连续 10 天,每 5 周为 1 个周期,共 5 个周期,并配合推荐的支持治疗。异维甲酸于 dinutuximab beta 治疗结束后 2 天开始,剂量 160 mg/m²/d,分两次口服,连续 14 天,共 6 个周期。
在方案 1 中,GM-CSF 于 dinutuximab beta 开始前 3 天启动,剂量 250 μg/m²/d,持续至 dinutuximab beta 结束(适用于中性粒细胞计数 <20×10⁶/L)。在方案 2 中,化疗药物长春新碱(1.5 mg/m²,1 天)/伊立替康(50 mg/m²,5 天)/替莫唑胺(100 mg/m²,5 天)(VIT 方案)联合dinutuximab beta 进行治疗。GM-CSF 在化疗结束后开始,持续至 dinutuximab beta 免疫治疗结束后 2 天(适用于中性粒细胞计数 <20×10⁶/L)。方案 1 和方案 2 见图 1。
在免疫治疗过程中,36 例患者(70.6%)接受了 5 个周期的 dinutuximab beta 治疗,15 例患者(29.4%)接受了超过 5个周期的治疗。采用方案 1(dinutuximab beta 联合 GM-CSF 和异维甲酸)治疗的 20 例患者中,18 例达到 CR,2 例达到 VGPR(仅残留微小骨髓病灶)。采用方案 2(dinutuximab beta 联合 GM-CSF、异维甲酸和 VIT 化疗)的 31 例患者中,10例达到 VGPR(除微小骨髓病灶外无残留),21 例达到 PR。
评估分别在免疫治疗前、接受 3、5、6、8 和 10 个周期治疗后,以及 dinutuximab beta 免疫治疗结束时进行。在临床治疗结束后,第 1 年每 3 个月评估一次,第 2 至 3 年每 6 个月评估一次。肿瘤评估依据 2017 年国际神经母细胞瘤反应标准(INRC),以 dinutuximab beta 免疫治疗前的肿瘤状态作为基线。临床评估采用¹8F-NOTATATE ,并结合正电子发射断层扫描(PET)或计算机断层扫描(CT)评估骨和软组织。对于骨髓浸润的患者,采用细胞形态学检查和 GD2 免疫细胞化学染色进行评估。所有评估在研究中心进行。
EFS 定义为从开始接受dinutuximab beta 治疗到发生第一次复发、疾病进展、继发性恶性肿瘤或因任何原因死亡,或直到最后一次与患者接触的时间。OS 定义为从开始接受 dinutuximab beta 治疗到因任何原因死亡的时间。
该研究评估了免疫治疗前已有病灶的患者的肿瘤反应。在接受 3 个周期的 dinutuximab beta 免疫治疗后,总缓解率(ORR)为 69.7%(95% CI, 51.3-84.4%),完全缓解率(CRR)为 51.5%(95% CI, 33.5-69.2%)。免疫治疗结束时,ORR 为 60.6%(95% CI, 42.1-77.1%),CRR 为 54.5%(95% CI, 36.4-71.9%)。随访 6 个月后,ORR 下降至 42.4%(95% CI, 25.5-60.8%),CRR 为 39.4%(95% CI, 22.9-57.9%)。在整个观察期内,最佳 ORR 为 78.8%(95% CI, 61.1-91.0%),CRR 为 66.7%(95% CI, 48.2-82.0%)。
在 33 例免疫治疗前已有病灶的患者中,20 例在治疗结束时肿瘤缓解,其中 19 例达到 CR,2 例达到 VGPR。18 例免疫治疗前已达 CR 的患者中,14例(77.8%)维持 CR,1 例出现疾病进展(PD),发生新的骨转移,3 例未完成评估。
针对免疫治疗前仅有骨转移的 27 例患者,免疫治疗结束时 ORR 为 63.0%(95% CI, 42.4-80.6%),CRR 为 59.3%(95% CI, 38.8-77.6%),其中 16 例达到 CR,1 例达到 VGPR。本研究中仅 4 例患者在免疫治疗前存在骨髓浸润,经免疫细胞学和免疫组织化学检测,3 例完成治疗后评估,其中 2 例骨髓阴性,1 例仍为阳性。然而,在整个治疗过程中(包括中期评估),骨髓的最佳缓解率达到 100%。
在免疫治疗前仍有病灶的 29 例接受移植患者中,ORR 为 58.6%(95% CI, 38.9-76.5%),CRR 为 51.7%(95% CI, 32.5-70.6%);23 例单次移植患者的 ORR 为 56.5%(95% CI, 34.5-76.8%),CRR 为 52.5%(95% CI, 30.6-73.2%)。6 例双次移植患者中,3 例达到 CR,1 例达到 VGPR;4 例未接受移植的患者中,3例达到 CR。
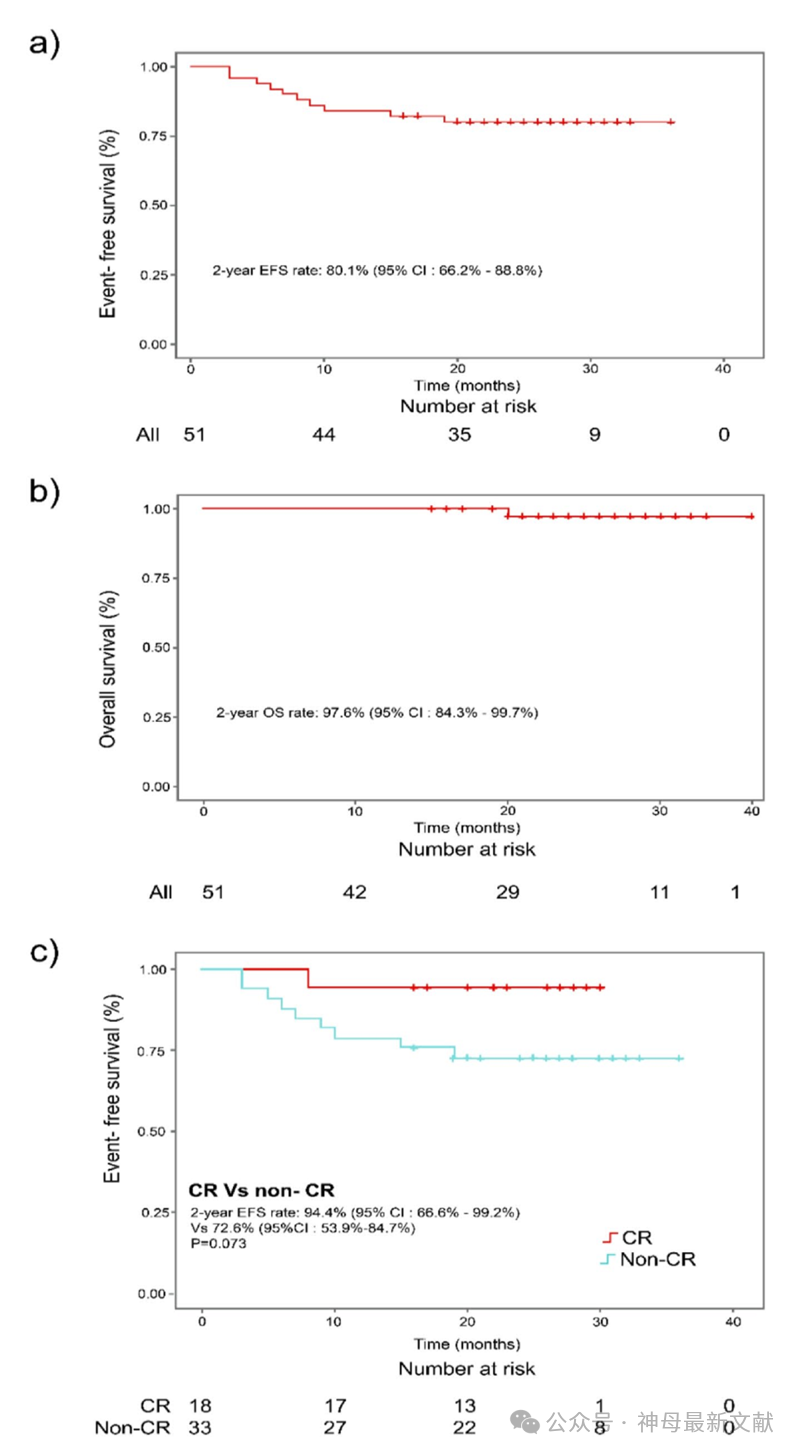
图2. Kaplan-Meier 分析:(a) 接受 dinutuximab beta 免疫治疗的 51 例 HR-NB 患者的无事件生存率(EFS)。(b) 接受dinutuximab beta 免疫治疗的 51 例HR-NB 患者的总生存率(OS)。(c) CR 组患者与非 CR 组(VGPR* + PR)患者的EFS 数据比较。*VGPR 组包括 2 例接受方案 1 治疗的患者,仅存骨髓微小残留病灶。CI 置信区间,CR 完全缓解,EFS 无事件生存率,OS总生存率,PR 部分缓解,VGPR 极佳部分缓解。
在 dinutuximab beta 维持治疗后,2 年无事件生存率(EFS)为80.1%(95% CI,66.2-88.8%;图 2a)。2 年总生存率(OS)为 97.6%(95% CI,84.3-99.7%;图 2b)。CR 组患者的 2 年 EFS 率(94.4%;95% CI,66.6-99.2%)在数值上高于非 CR 组(VGPR 和 PR)患者(72.6%;95% CI,53.9-84.7%),但差异无统计学意义(P = 0.073;图 2c)。此外,CR组患者的 2 年 OS 率为 100%,在数值上高于非 CR 组患者(96.4%;95% CI,77.2-99.5%),但差异同样无统计学意义(P = 0.480)。这表明,在 dinutuximab beta 维持治疗前已达到 CR 的患者可能相比未达到 CR 的患者具有更好的预后优势。
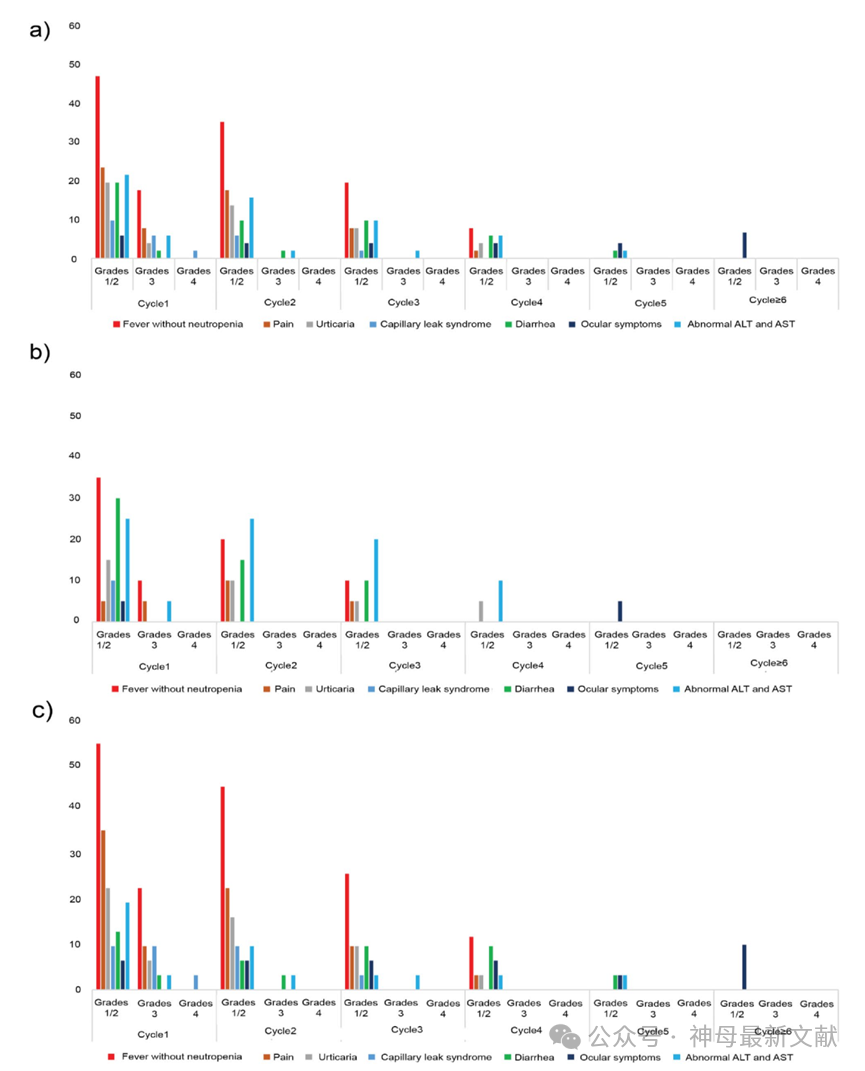
图3. 不良事件在(a)51名患者,(b)接受方案 1 治疗的患者,以及(c)接受方案 2 治疗的患者中的情况。ALT:丙氨酸氨基转移酶,AST:天冬氨酸氨基转移酶。
Fever without neutropenia:发热但不伴中性粒细胞减少
Pain:疼痛
Capillary leak syndrome:毛细血管渗漏综合征
Ocular symptoms:眼部症状
Abnormal ALT and AST:ALT 和 AST 异常
Dinutuximab beta治疗总体耐受良好,临床相关的不良事件(AEs)可控且可管理。首次治疗周期的不良事件发生率较高,随后在后续治疗周期逐渐减少。未报告5级不良事件,但有1例4级毛细血管漏出综合症(CLS)。使用不同治疗方案的患者群体中,接受方案2(联合化疗)的患者不良事件类型和频率较高。
从临床实践的角度来看,最值得关注的不良事件是发热、疼痛、CLS和眼部症状。在第一个周期中,17.6%的患者出现3级发热,47.1%的患者在第一周期出现1/2级发热,发热在第5周期后完全消失。23.5%的患者在第1周期出现1/2级疼痛,7.8%的患者出现3级疼痛,但没有患者因疼痛中断治疗。通过早期使用加巴喷丁和连续输注吗啡(0.02–0.05 mg/kg/h)有效控制了疼痛。
CLS在治疗的第一个周期中发生在17.6%的患者中,其中5.9%的患者为3级CLS,2%的患者为4级CLS。CLS症状通过支持治疗得到改善,且在恢复后,患者逐渐恢复并继续接受治疗。对于出现3/4级CLS的患者,在恢复后使用较低剂量的dinutuximab beta并逐渐增加剂量,后续治疗耐受良好。
有少数患者出现眼部不良事件,其中1例出现2级眼部不良事件(视力下降、瞳孔散大和畏光),症状在治疗结束后6个月内逐渐缓解。另一患者在接受4个周期治疗后出现1级眼部不良事件(视神经水肿、瞳孔散大和轻度畏光),但症状没有加重。
本研究未观察到严重神经系统不良事件。其他不良事件包括肝功能异常、腹泻和荨麻疹,主要为1/2级,无需暂停治疗。未报告与dinutuximab beta治疗相关的死亡。
这项回顾性研究旨在探讨dinutuximab beta作为一线维持治疗在中国儿童新诊断的高危神经母细胞瘤(HR-NB)患者中的疗效和安全性。研究结果显示,dinutuximab beta免疫治疗与令人鼓舞的肿瘤反应和生存获益相关,且耐受性良好。
Dinutuximab beta作为一线维持治疗已提高高危神经母细胞瘤患者的生存率,国际儿童肿瘤学会欧洲神经母细胞瘤组HR-NB 1试验(HR-NBL1/SIOPEN)也表明了这一点。该试验报告称,接受dinutuximab beta联合异维甲酸治疗的高危神经母细胞瘤患者的2年无事件生存率(EFS)为65%,总体生存率(OS)为77%。本研究中,2年EFS率为80.1%,2年OS率为97.6%,总体反应率(ORR)为60.6%,完全缓解率(CRR)为54.5%。与非完全缓解(CR)患者相比,完全缓解患者的生存率更好,尤其是在无事件生存率方面。这表明在免疫治疗前获得CR的患者可能会有更好的预后。
化疗联合dinutuximab beta免疫治疗对于某些特定的高危神经母细胞瘤患者可能具有益处。例如,BEACON-Immuno研究评估了dinutuximab beta与化疗联合治疗复发或难治性高危神经母细胞瘤患者的疗效,显示该联合治疗能显著提高1年无进展生存率(PFS)和ORR。中国的专家共识也建议对于未达到完全缓解的患者,可使用dinutuximab beta联合VIT化疗和GM-CSF,效果良好且毒性低。
在SIOPEN治疗策略和药物使用说明中,推荐dinutuximab beta固定使用5个周期的免疫治疗,但在实际临床中,治疗周期有时超过5个。部分患者在接受超过5个周期后取得最佳反应,且延长治疗周期可能有益。基于dinutuximab beta的耐受性和安全性,在未达到完全缓解的患者中,部分患者在接受超过5个周期后仍显示肿瘤负担持续减少。
此外,本研究使用了18F-NOTATATE作为评估骨骼和软组织的影像学方法,并与18F-PET/CT在2017版INRC标准中一致。18F-NOTATATE被认为是一种有效的神经内分泌肿瘤(NET)影像诊断工具,具有良好的生物分布和安全性。
与以往dinutuximab beta单药持续静脉输注的研究相比,本研究观察到更高的发热、过敏反应和毛细血管漏出综合症(CLS)发生频率,这可能与GM-CSF的使用有关。疼痛在中国患者中较为耐受,且在第二、第三周期中,某些患者的吗啡初始剂量低于推荐剂量。大部分不良事件可通过标准支持性护理管理,且随着治疗周期的推进,dinutuximab beta的耐受性有所改善。
本研究的局限性包括回顾性设计、缺乏对照组以及随访时间较短。尽管如此,研究结果令人鼓舞,未来将继续进行后续随访。
结论: Dinutuximab β多模式治疗作为中国儿童HR-NB的一线维持治疗,显示出令人鼓舞的疗效和可耐受的安全性。本研究结果表明,对于现实临床实践中先前多模治疗后未达到CR的患者,Dinutuximab β联合GM-CSF和VIT化疗可以用于治疗。
责编

制作
排版 | Sheila 校对 | uu
延伸阅读
Naxitamab用于高危神经母细胞瘤患者的巩固治疗的2期临床试验结果
免疫相关基因分型可指导高危神经母细胞瘤患者治疗方案
▼滑动查看更多▼
Background
High-risk neuroblastoma (HR-NB) is associated with high metastatic and relapse rates that require intensive multimodal treatment. We evaluated the efficacy and safety of dinutuximab beta as first-line maintenance immunotherapy in pediatric patients with HR-NB in real-world clinical settings in China.
Methods
We retrospectively reviewed the clinical records of pediatric patients with newly diagnosed HR-NB in the hospital from October 2021 to November 2023. Patients treated with dinutuximab beta in combination with granulocyte-macrophage colony-stimulating factor (GM-CSF) and isotretinoin as the first-line maintenance therapy were included in this study. Among patients with residual disease after completing induction and consolidation treatment, those with partial response (PR) or very good partial response (VGPR) except for bone marrow (BM) residue were also administrated vincristine/irinotecan/temozolomide (VIT) chemotherapy.
Results
Fifty-one patients with newly diagnosed HR-NB who achieved at least PR before immunotherapy were evaluated. At the end of immunotherapy, the objective response rate (ORR) in 33 patients with evidence of disease was 60.6% (95% confidence interval (CI), 42.1-77.1%) and the complete response rate (CRR; n= 18) was 54.5% (95% CI, 36.4-71.9%). The 2-year event-free survival (EFS) rate and overall survival (OS) rate were 80.1% (95% CI, 66.2-88.8%) and 97.6% (95% CI, 84.3-99.7%), respectively. The 2-year EFS rate was higher in patients with CR (94.4%; 95% CI, 66.6-99.2%) than in non-CR patients (72.6%; 95% CI, 53.9-84.7%). Dinutuximab beta was well tolerated in patients and had fewer side effects, which decreased over time. Co-treatment of dinutuximab beta with VIT chemotherapy did not require discontinuation in patients undergoing immunochemotherapy.
Conclusion
The study showed promising efficacy and safety of dinutuximab beta as the first-line maintenance immunotherapy for pediatric patients with HR-NB. Notably, the combination of dinutuximab beta with GM-CSF and VIT chemotherapy could be used for treating patients who did not achieve CR after previous multimodal therapy.
DOI: 10.1186/s12887-025-05568-x
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2025/03/24/BMC%20Pediatrics%EF%BD%9C%E7%8E%8B%E6%99%AF%E7%A6%8F%E5%9B%A2%E9%98%9F/
THE END










赶快来坐沙发