解密肿瘤免疫新思路——PD-L1 琥珀酰化
一、研究背景
肿瘤免疫治疗,尤其是针对 PD-1/PD-L1的免疫检查点抑制剂,已成为多种癌症的标准治疗手段。然而,免疫治疗的响应率仍然有限, 仅约 15%至25%的患者对治疗有积极反应 。 因此,深入理解免疫检查点通路的调控机制,以及肿瘤代谢对免疫微环境的影响,对于提高免疫治疗的疗效至关重要。 PD-L1作为免疫检查点蛋白,其表达水平是 预测 PD-1/PD-L1抑制剂疗效的关键生物标志物 。 然而,约 30%的PD-L1高表达黑色素瘤患者对免疫治疗无响应,提示 蛋白翻译后修饰(PTMs) 可能影响PD-L1的功能稳定性。在已知的PTMs(如磷酸化、泛素化)中, 琥珀酰化(Succinylation) 作为新型代谢相关修饰,其作用机制尚未明确。
黑色素瘤作为一种恶性程度较高的皮肤肿瘤,对传统的化疗和放疗不敏感。免疫治疗在黑色素瘤的治疗中展现出了显著的优势,但仍面临诸多挑战。因此, 深入研究黑色素瘤中肿瘤免疫逃逸的分子机制,寻找新的治疗靶点 , 对于改善黑色素瘤患者的预后具有重要意义。不久前《 Nature genetics》一篇文献聚焦于 PD-L1 的琥珀酰化修饰在黑色素瘤抗肿瘤免疫反应中的作用,为黑色素瘤的免疫治疗提供了新的思路和潜在靶点。

二、研究方法及相关发现
线粒体代谢与抗肿瘤免疫
研究者分析了接受免疫治疗的黑色素瘤患者的蛋白质组数据,发现 三羧酸循环( TCA cycle)和氧化磷酸化(OXPHOS)途径的高表达与更好的预后和免疫治疗反应相关 。 这些途径中的关键酶(如 OGDH、SCS和SDH)在免疫治疗反应者中表达丰富,且与更好的预后相关。
在小鼠模型中,研究者发现,给予琥珀酸( DES)和α-酮戊二酸(DMK)处理可以 显著抑制黑色素瘤、结肠癌和肺癌的肿瘤生长,并延长生存期 。 (图 2) 这种效应主要依赖于 CD8+ T细胞的激活,而与巨噬细胞的极化无关。
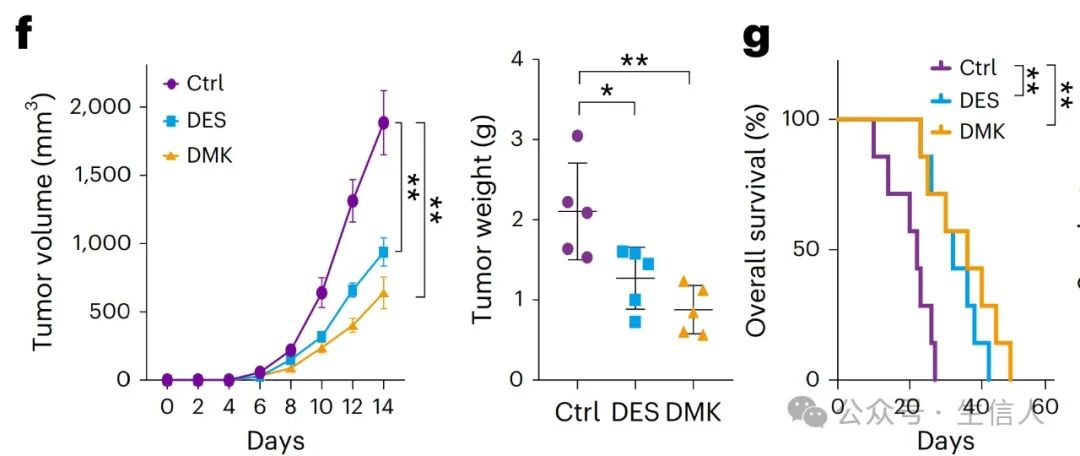
图 2
琥珀酰辅酶 A(Succinyl-CoA)的作用
研究进一步揭示了琥珀酰辅酶 A(Succinyl-CoA)在抗肿瘤免疫中的关键作用。Succinyl-CoA通过琥珀酰化修饰PD-L1,促进其降解,从而增强CD8+ T细胞的活性。实验显示,Succinyl-CoA水平的升高与PD-L1的琥珀酰化和降解呈正相关。
CPT1A作为琥珀酰转移酶的作用
研究者发现, CPT1A(肉毒碱棕榈酰转移酶1A)是一种琥珀酰转移酶,能够调节PD-L1的琥珀酰化。CPT1A的激活可以通过琥珀酰化修饰PD-L1,促进其降解,从而增强抗肿瘤免疫。此外 , CPT1A的表达水平与PD-1单克隆抗体的疗效呈负相关,表明其可能作为预测免疫治疗反应的生物标志物 。
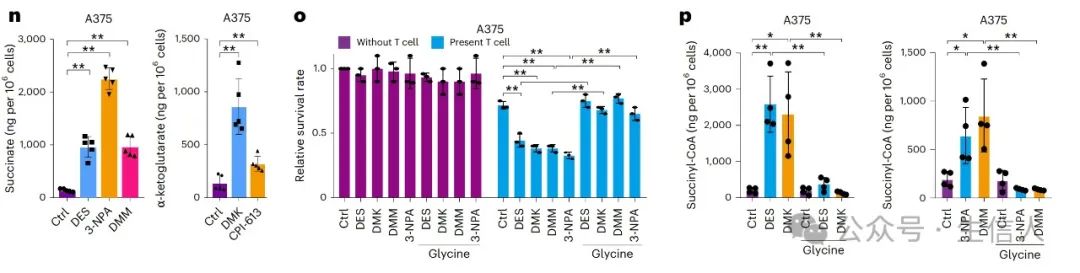
图 3
三、探索 PD-L1 琥珀酰化的关键发现
精准定位琥珀酰化位点
研究团队运用高分辨率质谱技术,剖析黑色素瘤细胞系中的 PD-L1,识别出多个琥珀酰化位点,其中胞内段赖氨酸残基 K162 尤为关键。为验证,构建不同琥珀酰化位点突变体,将野生型与突变型 PD-L1 分别转染至黑色素瘤细胞,通过免疫印迹及琥珀酰化特异性抗体检测,明确仅野生型可发生琥珀酰化,为后续研究奠定基础。
琥珀酰化增强 PD-L1 稳定性
为探究影响,研究人员用蛋白质合成抑制剂环己酰亚胺( CHX)处理细胞,不同时间点收集裂解液检测 PD-L1 表达。结果表明,野生型 PD-L1 在 CHX 处理后降解慢,证实琥珀酰化增强其稳定性。深入研究发现,琥珀酰化的 PD-L1 能招募 E3 泛素连接酶 ITCH,ITCH 与 PD-L1 结合阻断泛素化降解途径,延长其半衰期。
促进肿瘤细胞免疫逃逸
研究从体外、体内两方面探究 PD-L1 琥珀酰化对肿瘤细胞免疫逃逸的作用。体外将过表达野生型或突变型 PD-L1 的黑色素瘤细胞与活化 T 细胞共培养,野生型可显著抑制 T 细胞增殖及杀伤活性,突变型则无此效。体内构建小鼠黑色素瘤移植瘤模型, 接种过表达野生型 PD-L1 肿瘤细胞的小鼠,肿瘤生长快,CD8+T 细胞浸润少且活性低;接种突变型的小鼠情况相反,证实其助力肿瘤细胞免疫逃逸 。
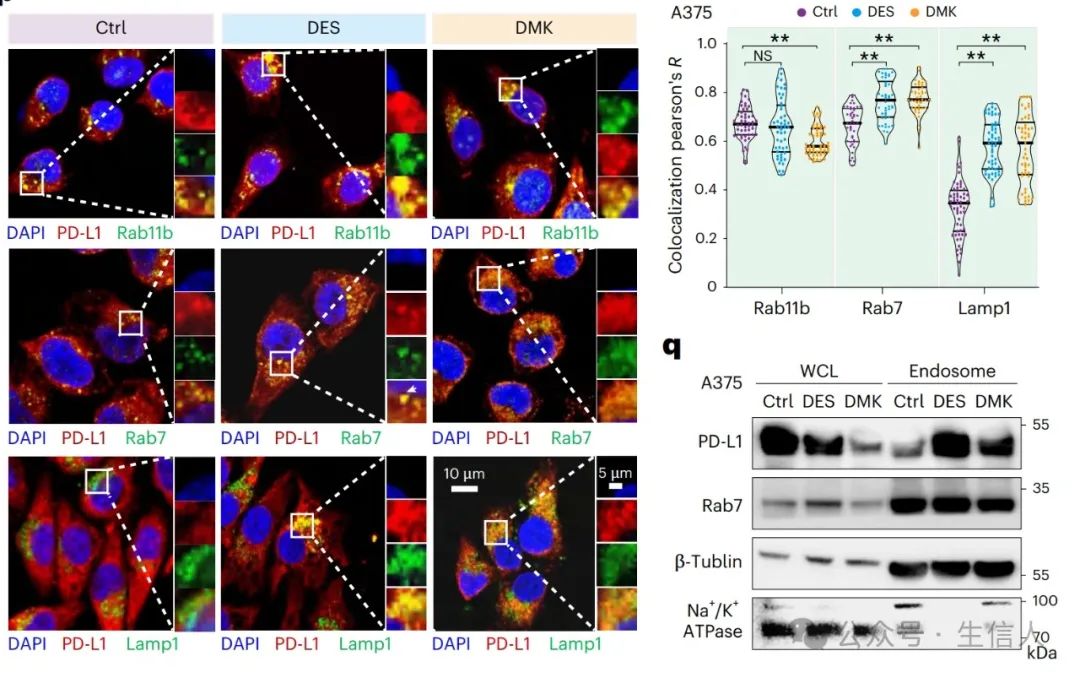
图 4
营造免疫抑制肿瘤微环境
研究人员利用流式细胞术发现,野生型 PD-L1 过表达的黑色素瘤小鼠肿瘤组织中,髓源性抑制细胞(MDSCs)比例大幅上升,树突状细胞(DCs)成熟受抑。进一步研究揭示,PD-L1 琥珀酰化上调肿瘤细胞分泌趋化因子 CCL2,招募更多 MDSCs 并抑制 DCs 成熟,营造免疫抑制微环境 。
开发靶向治疗新策略
基于上述研究,研究人员设计出特异性抑制 PD-L1 与 ITCH 相互作用、阻断 PD-L1 琥珀酰化的小分子化合物。体外实验显示,该化合物降低 PD-L1 蛋白稳定性,增强 T 细胞对黑色素瘤细胞的杀伤活性;体内实验中,荷瘤小鼠使用后肿瘤生长受抑制,肿瘤组织中 CD8+T 细胞增多,MDSCs 减少,DCs 成熟度提升, 有望成为黑色素瘤免疫治疗新策略 。
四、研究亮点与创新点
开拓新领域:首次揭示 PD-L1 琥珀酰化在肿瘤免疫中的作用
在该研究之前,虽然对 PD-1/PD-L1 通路的研究已较为广泛,但关于 PD-L1 蛋白的琥珀酰化修饰及其在肿瘤免疫中的功能完全未知。本文 首次发现并证实了 PD-L1 的琥珀酰化修饰能够增强其蛋白稳定性,促进肿瘤细胞免疫逃逸,为肿瘤免疫逃逸机制的研究开拓了全新的领域,填补了该领域的空白 。
阐明新机制:明确 PD-L1 琥珀酰化修饰的调控网络
研究详细阐述了 PD-L1 琥珀酰化修饰的调控机制,即琥珀酰化的 PD-L1 通过招募 ITCH 抑制自身的泛素化降解途径。同时,发现 PD-L1 琥珀酰化能够通过调节肿瘤微环境中免疫细胞的组成和功能,营造有利于肿瘤生长的免疫抑制微环境。这些机制的明确 为进一步开发靶向 PD-L1 琥珀酰化的治疗策略提供了坚实的理论基础 。
探索新策略:提出靶向 PD-L1 琥珀酰化的治疗新途径
基于对 PD-L1 琥珀酰化修饰功能和机制的深入研究,研究团队成功设计并验证了一种靶向 PD-L1 琥珀酰化的小分子化合物,该化合物在体内外实验中均显示出良好的抗肿瘤效果。这 为黑色素瘤以及其他可能存在类似机制的肿瘤的免疫治疗提供了新的潜在治疗靶点和策略 , 具有重要的临床转化价值。
五、临床指导意义
1.优化免疫治疗方案: 目前黑色素瘤免疫治疗面临患者无应答或耐药问题。此研究发现 PD-L1 琥珀酰化增强肿瘤细胞免疫逃逸能力,提示临床医生 可考虑将抑制 PD-L1 琥珀酰化作为新靶点 。 例如,文中设计的小分子化合物能阻断 PD-L1 琥珀酰化,在体内外实验中均增强 T 细胞对肿瘤细胞的杀伤活性。未来临床治疗中, 可尝试将该类靶向药物与现有的 PD-1/PD-L1 免疫检查点抑制剂联合使用 , 或 通过激活 CPT1A来增强PD-L1的降解,有望提高黑色素瘤患者对免疫治疗的响应率,改善治疗效果。
2.辅助患者分层与精准治疗: 通过检测黑色素瘤患者肿瘤组织中 PD-L1 的琥珀酰化水平,临床医生可以 对患者进行分层 。 对于 PD-L1 琥珀酰化水平高的患者,可优先选择针对该修饰的靶向治疗方案,或调整免疫治疗药物的剂量和使用方式 , 实现精准治疗。这有助于避免对部分患者无效治疗,减少不必要的医疗支出和药物副作用, 提高患者的生存质量和预后 。
3.预测疾病预后: PD-L1 琥珀酰化与肿瘤微环境中免疫细胞的变化相关,如髓源性抑制细胞(MDSCs)增多和树突状细胞(DCs)成熟受抑制,这些变化影响肿瘤的生长和免疫逃逸。临床医生 可将 PD-L1 琥珀酰化状态作为一个新的预后指标 。 若患者肿瘤组织中 PD-L1 琥珀酰化程度高,可能预示着肿瘤微环境更倾向于免疫抑制,患者预后相对较差,从而指导医生对患者进行更密切的监测和更积极的干预。
4. 代谢干预的临床应用 : 研究还发现,通过补充 α -酮戊二酸(DMK)或琥珀酸(DES)可以显著提高肿瘤细胞内琥珀酰辅酶A水平,并通过溶酶体途径加速PD-L1降解。这种 代谢干预策略不仅在黑色素瘤中有效,还可能适用于其他依赖代谢重编程的实体瘤,如肺癌和结直肠癌 。
5. 推动新治疗药物研发: 该研究揭示了 PD-L1 琥珀酰化的调控机制,即琥珀酰化的 PD-L1 招募 ITCH 抑制自身泛素化降解。这为 药物研发提供了明确的分子机制基础,制药公司可基于此开发更多特异性靶向 PD-L1 琥珀酰化过程的药物 , 丰富黑色素瘤乃至其他肿瘤类型的治疗药物库,推动肿瘤治疗药物的创新发展。
链接:http://www.lewenyixue.com/2025/03/24/%E8%A7%A3%E5%AF%86%E8%82%BF%E7%98%A4%E5%85%8D%E7%96%AB%E6%96%B0%E6%80%9D%E8%B7%AF%E2%80%94%E2%80%94PD-L1%20%E7%90%A5%E7%8F%80%E9%85%B0/





赶快来坐沙发