单细胞原位空间蛋白组技术在肺癌研究中的应用精选论文合集
文献一
小细胞肺癌(SCLC)的肿瘤空间异质性及预后相关免疫生态位
刊稿信息: Cancer Cell (IF 48.8), 2025

2025年2月,复旦大学附属肿瘤医院陈海泉和复旦大学生命科学院的曹志伟等研究团队在《 Cancer Cell 》期刊上联合发表的研究成果,采用PhenoCycler(原CODEX)单细胞空间蛋白组技术和多组学分析描绘了165名小细胞肺癌(SCLC)患者的肿瘤空间景观,并生成267张高维图像,包含超过930万个细胞,揭示了预后相关肿瘤细胞邻域。
此外,研究团队还开发了一种新型细胞集落算法,发现了与SCLC高生存率相关的空间免疫生态位,并可有效预测改善的免疫治疗反应。该研究为解析SCLC的空间异质性提供了宝贵的资源,并为潜在的患者分层和个性化治疗提供了重要见解。
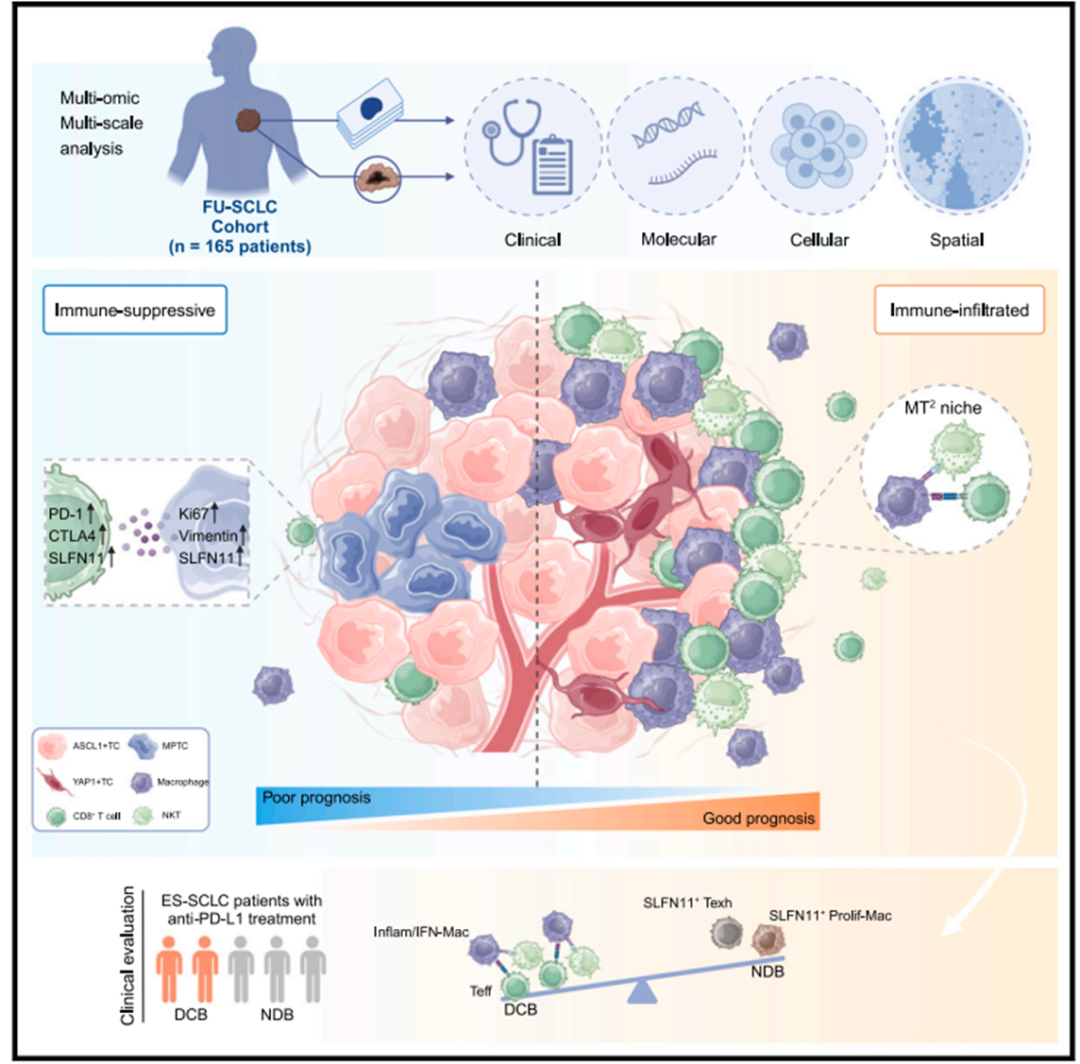
研究方法
为了全面解析小细胞肺癌(SCLC)的细胞组成、空间组织和分子异质性,研究人员创建了一个原发性SCLC肿瘤样本的多组学图谱,该研究结合了PhenoCycler单细胞空间蛋白组(35-plex)、全外显子测序(WES)和空间转录组等技术联用。
研究结果
1.SCLC的空间分辨单细胞表型图谱
从129个SCLC肿瘤样本和16个配对的邻近正常组织中获取了267张高维病理学图像,并采用监督聚类法对细胞表型进行分类,表明ASCL1+肿瘤细胞占所有肿瘤细胞的50%以上,巨噬细胞是免疫细胞中最丰富的类型,且大于10%的肿瘤细胞被鉴定为多阳性肿瘤细胞(MPTCs),最常见的是ASCL1和NEUROD1共表达。以上发现揭示了SCLC肿瘤细胞在分子水平上的高度异质性,特别是MPTCs的存在及其共表达模式,也凸显了空间组学技术在区域分割和结构映射方面具有优于传统批量测序的优势。
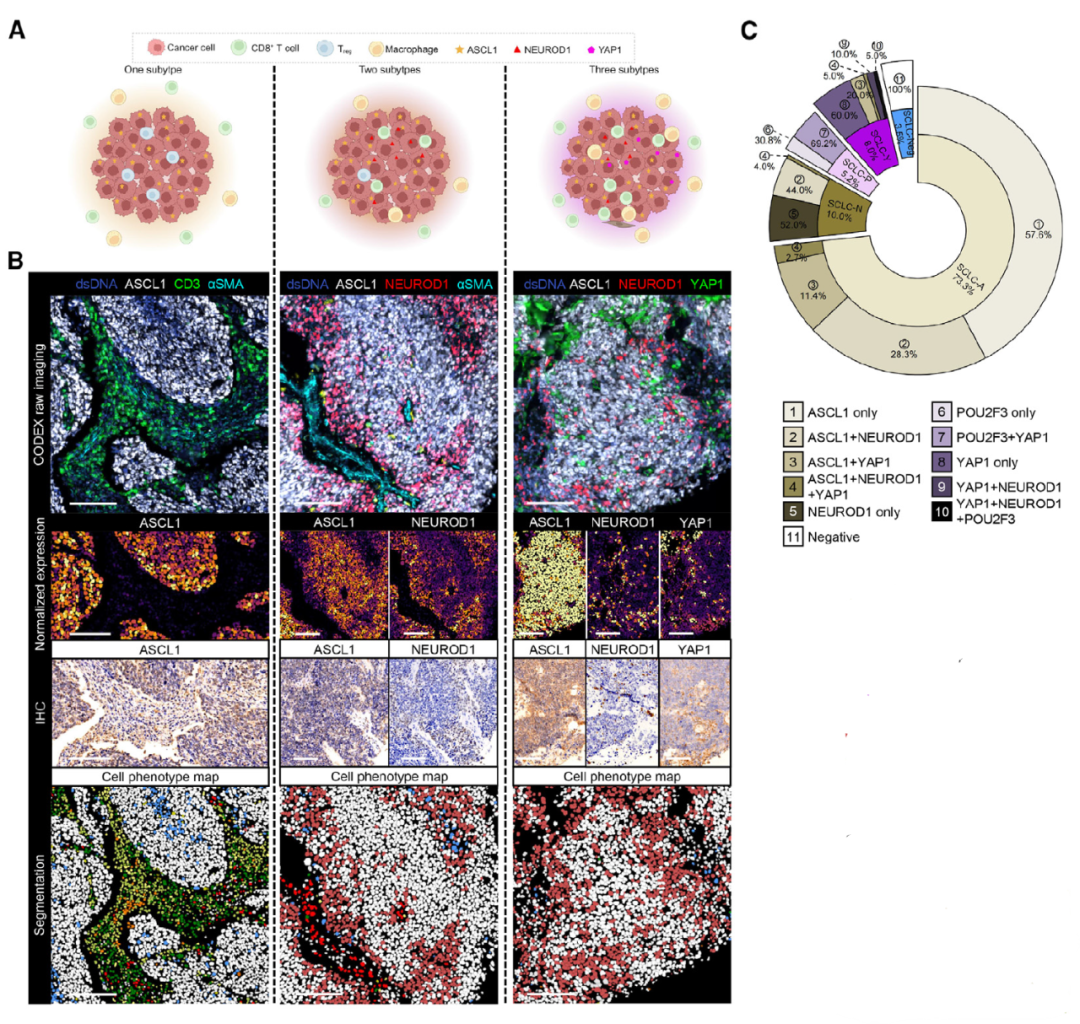
2. 细胞邻域在SCLC肿瘤的空间表型转变和患者生存结局中的重要作用
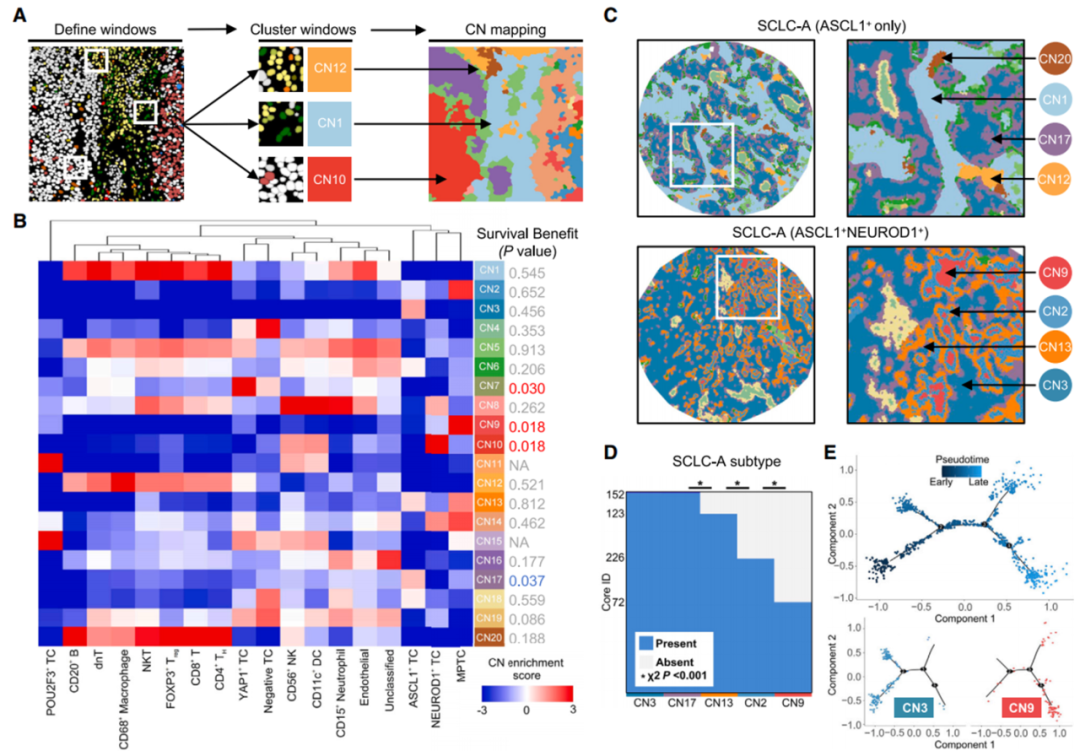
采用经典方法建立了20个细胞邻域(CNs),包括:全免疫型(CN1)、巨噬细胞富集型(CN12)、血管型(CN5)、多种多阳性肿瘤细胞(MPTC)富集的邻域(CN2、CN9、CN13和CN14)以及其他类型。在ASCL1+ (SCLC-A)亚型中存在SLFN11(一种DNA/RNA解旋酶,能够增强癌细胞对DNA损伤药物的敏感性)高表达的多阳性肿瘤细胞邻域,与较差的预后显著相关。进一步研究揭示了不同细胞邻域(CNs)与特定基因组改变之间的关联,为理解SCLC的分子机制、肿瘤进化轨迹以及开发精准治疗策略提供了重要线索。例如,CN9中的RBBP6突变可能成为抑制肿瘤转移的潜在靶点,而CN10中的CREBBP改变可能为化疗后复发的预测和治疗提供依据。
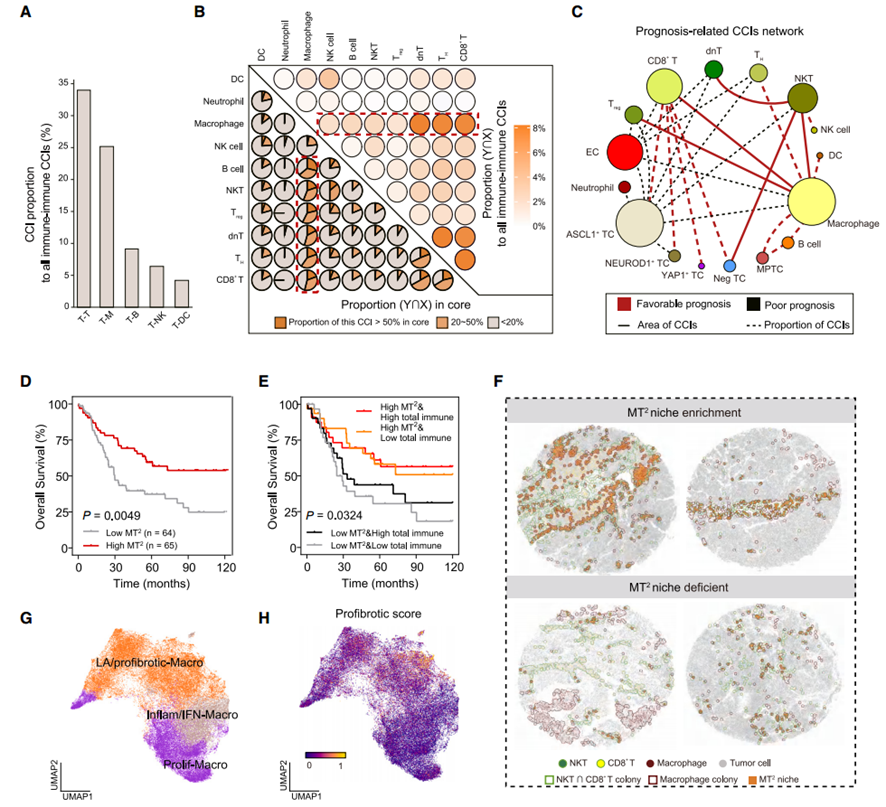
3. ColonyMap算法检测SCLC的空间组装细胞集落
细胞邻域(CN)分析为描述每个细胞周围局部微环境中的细胞组成提供了一种有效策略。从空间角度来看,相同细胞类型在聚集或分散状态下可能在组织中表现出不同的生理功能。为了更好地从细胞群体的角度研究空间相互作用,研究人员将这些聚集的同质细胞定义为细集落(cell colony),并开发了ColonyMap算法来分析空间蛋白组/转录组数据,为SCLC肿瘤中细胞群的空间分布和组织模式提供了新的视角。ColonyMap算法揭示了一个由抗肿瘤巨噬细胞、CD8+ T细胞和自然杀伤T细胞(MT2)组成的空间组装免疫生态位,它与更高的生存率高度相关,并在一个独立的队列中预测改善的免疫治疗反应。
文献二
空间转录组+蛋白组联用揭示肺腺癌发展的关键步骤
刊稿信息: Nature Communications (IF 14.7), 2024

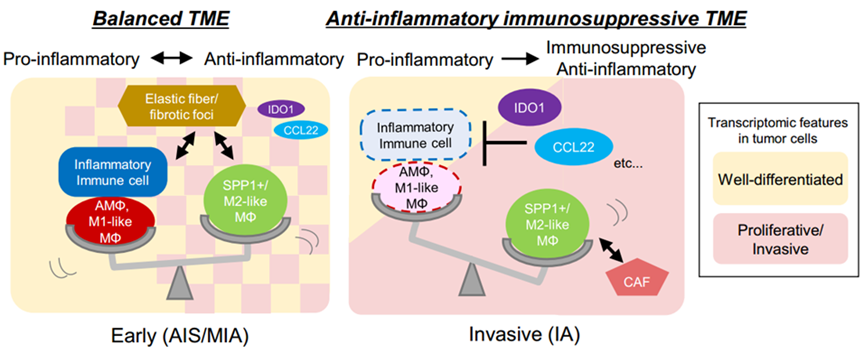
2024年12月,东京大学的Yutaka Suzuki和Ayako Suzuki研究团队在《 Nature Communications 》发表的研究成果,采用空间转录组、原位蛋白检测和RNA分析绘制了30例肺腺癌患者在非侵袭性和晚期侵袭性阶段的空间转录组图谱,检查肿瘤细胞、环境基质细胞和浸润免疫细胞的局部转录组特征和浸润性腺癌判定。随后,使用空间蛋白组检测技术和原位基因表达分析技术在单细胞分辨率下进一步检查在恶性(侵袭性)边界和较轻恶性区域之间观察到的代表性样品的病理事件,锁定肿瘤病理演进过程中发挥关键作用的因子。
研究方法
首先,通过空间转录组技术检测浸润性腺癌(invasive adenocarcinomas,IA)的肿瘤细胞、环境基质细胞和浸润性免疫细胞的局部转录组特征。然后通过PhenoCycler多重免疫染色和原位基因表达谱系统,以单细胞水平分辨率对一些代表性样品的恶性(即侵袭性)前沿和非恶性区域的交界处观察到的相互作用事件进一步分析。
在PhenoCycler空间蛋白标记抗体组合设计时,主要选择了上皮细胞(E-Cadherin或PanCK)、成纤维细胞(Collagen-IV 或 α-SMA/ACTA2)、内皮细胞 (CD31/PECAM1)、T 细胞(CD3e、CD4 或 CD8)、B 细胞(CD19 或 CD20)和巨噬细胞/DC (CD68、CD11c)等细胞亚群的代表性标志物。在此基础上还加入了用于和原位基因表达分析技术联用分析的相关靶标(如 CXCL13 和 IDO1)。
最后,在早期阶段的肺肿瘤(如AIS和MIA)中研究了肿瘤和免疫细胞之间的相互作用,以及对疾病进展很重要的表型因子。这些研究确定肿瘤细胞周围的TME是肺腺癌发生过程中与疾病进展相关的重要事件。
了解研究详情,参见微信文章:
Nat Commun | 空间转录组与空间蛋白组联用,揭示肺腺癌患者肿瘤微环境的异质性
文献三
通过单细胞空间蛋白组揭示NSCLC免疫治疗的应答机制
刊稿信息: Journal of Translational Medicine (IF 6.1), 2024
2024年3月,来自昆士兰大学的Arutha Kulasinghe 研究团队对接受PD-1免疫治疗的非小细胞肺癌(NSCLC)患者进行PhenoCycler 空间蛋白组检测(36-plex),展示了一套完整的CODEX数据分析流程,包括从多色荧光标记到图像处理、组织QC、染色QC、细胞表型分析、空间表征、以及统计学比较和生存相关分析,用以剖析肿瘤的空间表型特征及相互作用,发现与免疫治疗响应相关的空间标志物。
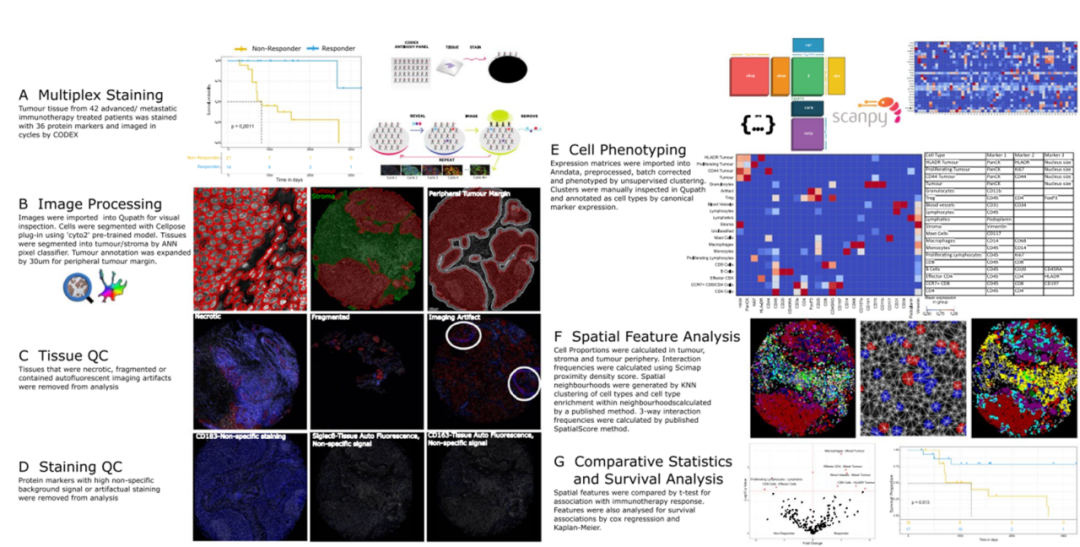
研究方法
对42名患者样本制作而成的TMA进行PhenoCycler 染色,获取36种蛋白标记物在每个样本上的表达和分布情况。

研究结果
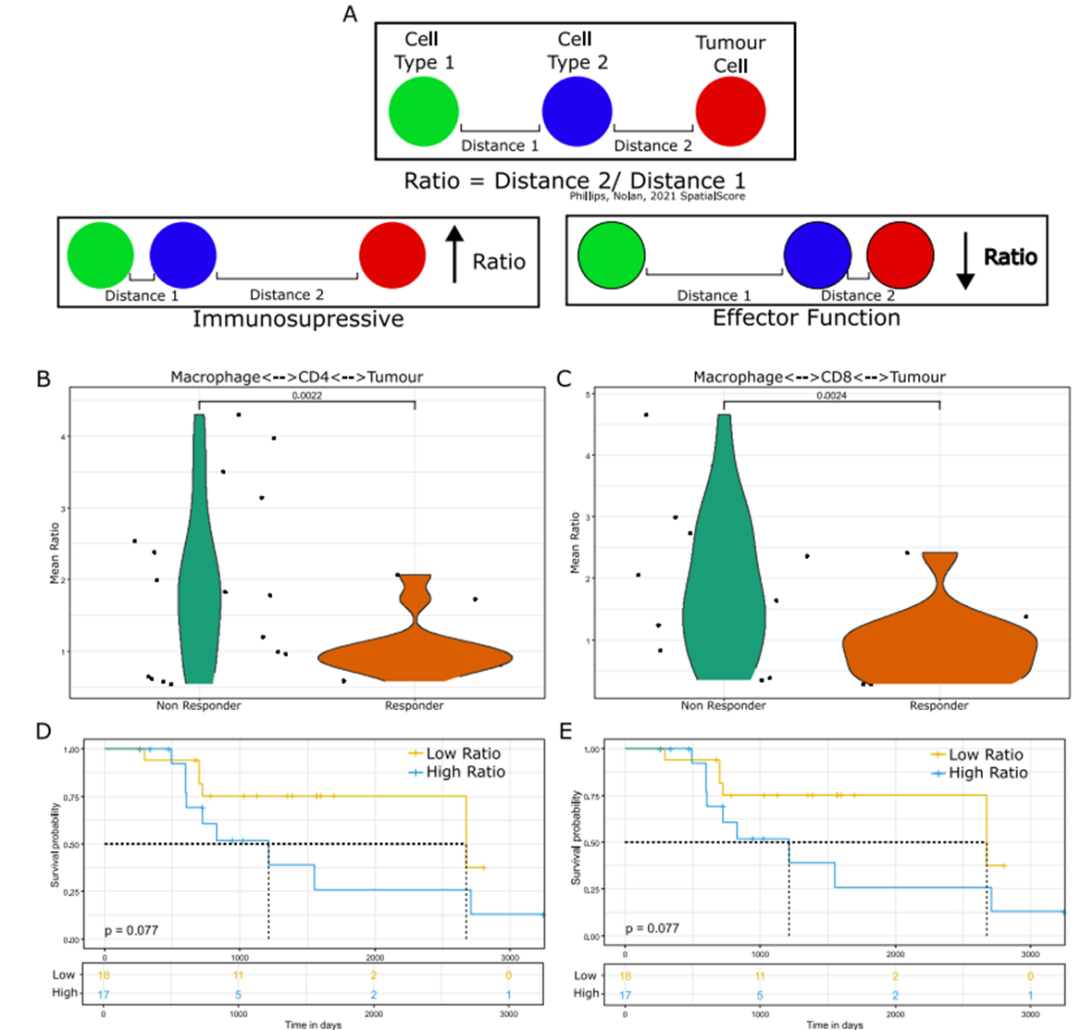
PhenoCycler研究结果发现,调节性T细胞(Tregs)在无应答患者中富集,这与它们在间质内和外周肿瘤边缘的定位一致。基于空间邻近性的细胞相互作用分析显示,Tregs与单核细胞和CD8+ T细胞之间互作在无应答患者中更为常见,而在应答患者中巨噬细胞常常更接近HLA-DR+肿瘤细胞。
细胞邻域分析表明,在混合肿瘤邻域中巨噬细胞和效应CD4+ T细胞,以及HLA-DR+肿瘤邻域中CD8+ T细胞均与良好的临床治疗反应相关。对推断的免疫细胞之间相对于肿瘤的调节功能的评估表明,巨噬细胞对CD4+和CD8+ T细胞均表现出免疫抑制作用,并且这种相关性在免疫检查点抑制剂(ICI)难治性患者中得分更高。除了ICI反应外,这些空间模式还与总体生存有关,因此可能表明对肿瘤微环境的功能理解的特征。
了解详情,参见微信文章:
J. Transl. Med.|以非小细胞肺癌为例建立的一套PhenoCycler空间蛋白分析流程,挖掘免疫治疗响应的空间特征
参考文献
1. Chen H, Deng C, Gao J, et al. Integrative spatial analysis reveals tumor heterogeneity and immune colony niche related to clinical outcomes in small cell lung cancer. Cancer Cell. Published online February 14, 2025. doi:10.1016/j.ccell.2025.01.012
2. Takano Y, Suzuki J, Nomura K, et al. Spatially resolved gene expression profiling of tumor microenvironment reveals key steps of lung adenocarcinoma development. Nat Commun. 2024;15(1):10637. Published 2024 Dec 6. doi:10.1038/s41467-024-54671-7
3. Monkman J, Moradi A, Yunis J, et al. Spatial insights into immunotherapy response in non-small cell lung cancer (NSCLC) by multiplexed tissue imaging. J Transl Med. 2024;22(1):239. Published 2024 Mar 4. doi:10.1186/s12967-024-05035-8
链接:http://www.lewenyixue.com/2025/03/24/%E5%8D%95%E7%BB%86%E8%83%9E%E5%8E%9F%E4%BD%8D%E7%A9%BA%E9%97%B4%E8%9B%8B%E7%99%BD%E7%BB%84%E6%8A%80%E6%9C%AF%E5%9C%A8%E8%82%BA%E7%99%8C%E7%A0%94%E7%A9%B6%E4%B8%AD%E7%9A%84%E5%BA%94/





赶快来坐沙发