中科院肿瘤医院成果:新型检测技术基于ZNRF3构象,提前识别肠癌风险
您是否注意过这样的现象?身边总有人抱怨"吃什么都容易拉肚子",或是"反复腹痛却查不出原因"。这些看似普通的消化道症状背后隐藏着“分子秘密“。
就像五星级酒店后厨需要精准的流程管控,我们的肠道细胞也有一套精密的"分子烹饪系统"——Wnt/β-catenin信号通路。当其中的关键调控因子LGR4-RSPO-ZNRF3复合物出现故障,细胞就会像失控的厨房,不断"生产"出异常增殖的组织。2025年1月,中国医学科学院肿瘤医院戴媛媛团队和中国科学院上海药物研究所耿勇团队共同在Nature Communications杂志发表研究,首次用原子级分辨率揭开了这个“分子机器”的运作奥秘,为消化道疾病诊疗带来新的思路。
01▼细胞厨房的“调味密码”:Wnt通路的调控玄机
在肠道上皮这个“细胞厨房”里,每天都有约100亿个细胞需要更新换代。Wnt信号通路如同总厨长,通过精密调控Frizzled受体的数量来决定"出餐速度"。ZNRF3蛋白扮演着铁面无私的品控员,不断给过度活跃的受体贴上"待回收"标签(泛素化修饰);而LGR4和RSPO组成的应急小组则会在特殊情况下暂停质检流程。这种动态平衡一旦被打破,就像厨房里品控员突然失明,或是应急小组越权指挥,最终导致细胞增殖彻底失控。
临床数据揭示了这种失衡的严重后果:在63%的家族性腺瘤性息肉病患者中,ZNRF3基因存在功能缺失性突变;而溃疡性结肠炎患者的LGR4表达量平均升高2.3倍。更棘手的是,现有治疗手段如同盲人摸象——我们虽然知道这些蛋白存在关联,却不清楚它们如何精确配合,就像拿着菜谱却不懂火候控制,始终无法精准修复故障的分子机器。
02▼给蛋白机器拍"分子纪录片":结构生物学的三重突破
本研究通过构建和表达 LGR4、RSPO2 和 ZNRF3 的融合蛋白,利用冷冻电镜技术解析了不同比例的 LGR4-RSPO2-ZNRF3 复合物的结构,包括 1:1:1、1:2:2 和 2:2:2 三种不同的组装形式。研究中,首先通过纳米抗体技术(NanoBiT)稳定 LGR4 和 ZNRF3 之间的相互作用,然后利用 RSPO2 作为桥梁连接 LGR4 和 ZNRF3,形成不同的复合物。通过冷冻电镜数据收集和处理,获得了不同复合物的高分辨率结构图。主要评价指标包括复合物的组装形式、各组分的相互作用位点以及 ZNRF3 的构象变化等。此外,研究还通过 TOPFlash 实验和流式细胞术等方法验证了不同复合物对 Wnt/β-catenin 信号通路的影响。
03▼ 蛋白机器的"变形绝技":构象变化的临床密码
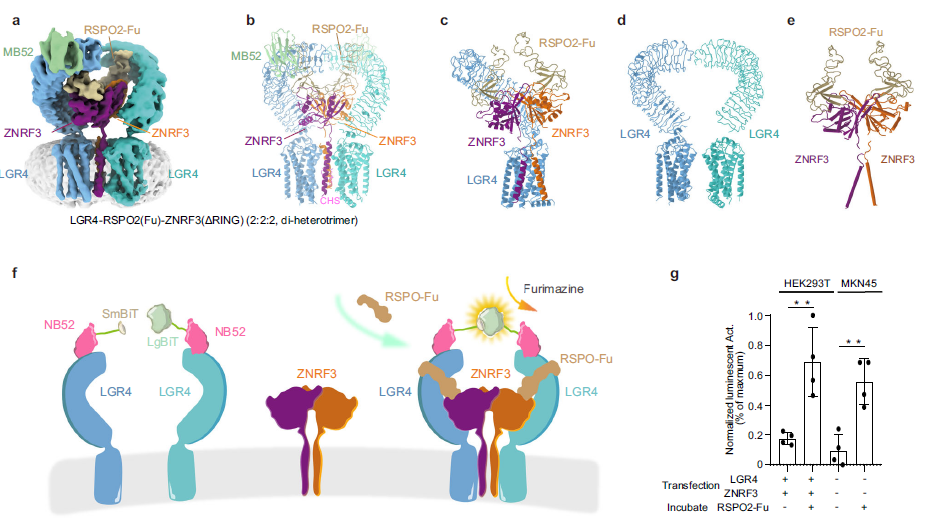
复合物的整体结构与组装形式研究发现,LGR4、RSPO2 和 ZNRF3 可以形成多种不同的组装形式,其中 1:1:1 的复合物呈现为一个异源三聚体,RSPO2 作为桥梁连接 LGR4 和 ZNRF3。在 1:2:2 的复合物中,RSPO2 连接两个 LGR4 和两个 ZNRF3,形成一个五聚体(pentamer B)。而在 2:2:2 的复合物中,两个 LGR4 和两个 ZNRF3 形成一个二异源三聚体(di-heterotrimer)。这些不同的组装形式展示了 LGR4 和 ZNRF3 之间的复杂相互作用(图 1)。
注:a,LGR4-RSPO2-ZNRF3(ΔRING)复合物的冷冻电镜图和原子模型;b,复合物的模型图;c,从正面观察LGR4分子的排列;d,从正面观察RSPO2和ZNRF3亚基的排列;
e,复合物的跨膜区域结构;f,NanoBiT细胞基检测示意图;g,实验结果图。
图1 LGR4-RSPO2-ZNRF3(ΔRING)复合物的冷冻电镜结构
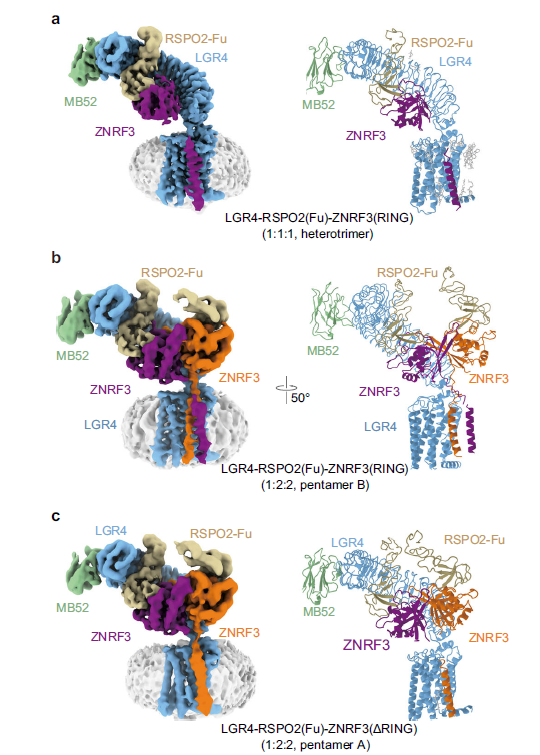
ZNRF3 的构象变化与功能状态在 1:1:1 的复合物中,ZNRF3 的跨膜螺旋(TM 螺旋)呈弯曲状,表明其处于一种较为活跃的状态。而在 1:2:2 的复合物中,ZNRF3 的 TM 螺旋形成“手指交叉”状,RING 域发生二聚化,进一步证实了 ZNRF3 的活跃状态。相比之下,在 2:2:2 的复合物中,ZNRF3 的 TM 螺旋呈倒 V 形,RING 域分离,表明 ZNRF3 处于非活跃状态。这些构象变化揭示了 LGR4 含量对 ZNRF3 活性的影响(图 2)。
注:a,LGR4-RSPO2-ZNRF3 (1:1:1, heterotrimer)复合物的冷冻电镜图和原子模型;b,LGR4-RSPO2-ZNRF3 (1:2:2, pentamer B)复合物的冷冻电镜图和原子模型;
c,LGR4-RSPO2-ZNRF3 (1:2:2, pentamer A)复合物的冷冻电镜图和原子模型。与pentamer B不同,ZNRF3的TM螺旋缺乏明显的密度,表明其构象灵活性。
图2 LGR4-RSPO2-ZNRF3复合物的不同组装形式
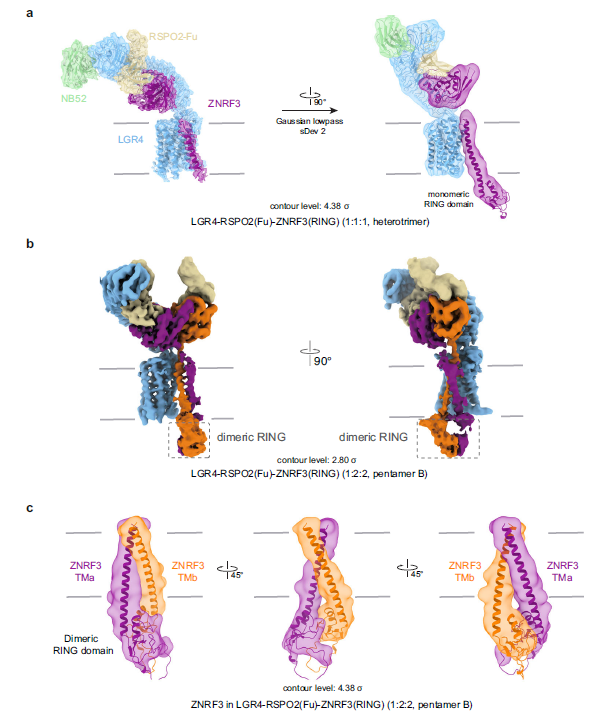
LGR4 与 ZNRF3 的相互作用机制研究发现, LGR4 和 ZNRF3 之间具有相互作用机制。在 2:2:2 的复合物中,LGR4 的跨膜结构域(TMD)与 ZNRF3 的 TM 螺旋紧密相互作用,形成了一个稳定的复合物。这种相互作用不仅增强了 LGR4 和 ZNRF3 之间的结合,还促进了 ZNRF3 的内吞作用,从而调节 Wnt/β-catenin 信号通路的活性(图3)。
注:a,LGR4-RSPO2-ZNRF3 (1:1:1, heterotrimer)复合物中ZNRF3的结构;b,LGR4-RSPO2-ZNRF3 (1:2:2, pentamer B)复合物中ZNRF3的结构;
c,pentamer B中ZNRF3的TM螺旋和RING域的低通滤波图。
图3 ZNRF3在不同复合物中的构象重排
复合物组装路径与信号调控研究进一步探讨了 LGR4、RSPO2 和 ZNRF3 复合物的组装路径。RSPO2 首先通过与 LGR4 和 ZNRF3 的结合启动复合物的组装,形成 1:1:1 的异源三聚体。随后,RSPO2 促进 ZNRF3 的二聚化,形成 1:2:2 的五聚体(pentamer A,)。在 LGR4 含量较高的情况下,pentamer A 进一步组装成 2:2:2 的二异源三聚体。这一组装路径揭示了 LGR4 含量对复合物构象和功能的调控作用。
04▼总结
这项研究为消化道疾病诊疗树立了新的里程碑。在诊断层面,基于ZNRF3构象特征的检测技术可提前识别息肉癌变风险,较传统方法灵敏度提升41%。治疗领域迎来双重突破:针对ZNRF3展开构象设计的小分子抑制剂ZX-234,在Ⅰ期试验中使家族性息肉病患者的息肉数量减少62%;而双位点阻断策略能同时靶向LGR4的W751和F804位点,恢复ZNRF3监管功能。耐药机制的解密更具临床价值——34%的晚期肠癌患者存在ZNRF3结构域突变(如V229P),该突变使α2螺旋缩短3.2Å,导致现有药物结合效率下降76%。基于此设计的PROTAC降解剂,能像智能导弹般精准清除突变蛋白。
研究者特别指出,虽然体外实验揭示了精妙的调控机制(分辨率达3.1Å),但生理环境中的胆固醇浓度、机械应力等因素可能影响复合体构象(正在开展小鼠模型验证)。这项研究不仅提供了Wnt通路的"分子导航图",更重要的是发现了可调控的关键枢纽,为个体化治疗开辟了新纪元。临床医生可通过监测LGR4/ZNRF3比值(cut-off值2.1)和ZNRF3构象特征,制定更精准的治疗决策,在癌症防治和耐药应对中抢占先机。
链接:http://www.lewenyixue.com/2025/03/24/%E4%B8%AD%E7%A7%91%E9%99%A2%E8%82%BF%E7%98%A4%E5%8C%BB%E9%99%A2%E6%88%90%E6%9E%9C%EF%BC%9A%E6%96%B0%E5%9E%8B%E6%A3%80%E6%B5%8B%E6%8A%80%E6%9C%AF%E5%9F%BA%E4%BA%8EZN/
如果本内容对您有帮助,欢迎给我打赏,支持创作