【CACA前沿周刊】90期 氘代药物:Me Better的捷径,还是创新陷阱?
本期看点
序言
一、从“山寨”到超越?氘代药物的突围之路
3月9日,同源康医药宣布其第三代EGFR TKI药物TY-9591在关键Ⅱ期临床试验中“击败”奥希替尼,引发市场震动。数据显示,TY-9591一线治疗EGFR突变脑转移NSCLC的颅内客观缓解率(iORR)显著优于奥希替尼,公司计划据此提交上市申请。
这一消息的焦点不仅在于TY-9591的疗效突破,更在于其“氘代药物”的身份——通过将奥希替尼分子中的氢原子替换为同位素氘,试图在代谢稳定性和安全性上实现优化。然而,氘代药物究竟是“站在巨人肩上”的创新捷径,还是暗藏风险的投机游戏?
二、科学逻辑:从同位素到临床价值的跨越
氘代药物的核心逻辑源于同位素化学键的稳定性差异。氘作为氢的同位素,其碳-氘键的强度是碳-氢键的6-9倍。这种特性可延缓药物代谢过程中关键化学键的断裂,从而延长半衰期、减少毒性代谢产物的生成。例如,TY-9591通过氘代改造,降低了活性代谢物AZ5104(TY-9591-D1)的水平,后者被认为是奥希替尼皮肤和胃肠道毒性的重要诱因。
临床前研究显示,TY-9591在保留奥希替尼疗效的同时,耐受性更优,血脑屏障穿透能力更强。Ⅰ期数据显示,该药物的ORR达84.8%,iORR高达100%。此外,其治疗EGFR突变NSCLC的mPFS达21.5个月,L858R突变患者mPFS为19.3个月,均优于奥希替尼历史数据(FLAURA试验中的总人群数据为18.9个月,FLAURA2研究中L858R突变患者数据为13.9个月)。当然,实验间对比须谨慎进行。此外,TY-9591治疗脑转移患者中mPFS达17.5个月,且160 mg剂量组未观察到脑部进展。而在FLAURA2研究中,mPFS仅13.8个月。
更优秀的疗效彰显了氘代的价值,通过氘代实现对“药王”的超越似乎是一种走上“药生”巅峰的快捷途径。
三、争议与隐忧:替代终点的胜利≠临床革命
尽管TY-9591的Ⅰ、Ⅱ期数据令人振奋,但质疑声同样存在。首先,当前研究终点仅为iORR,而非更具说服力的PFS或OS。肿瘤药物研发史上,不要说ORR了,就连PFS的优势未能转化为生存获益的案例也是比比皆是。其次,TY-9591的Ⅲ期临床试验仍在进行中,样本量扩大后结果是否稳定仍是未知数。
更深刻的挑战在于氘代药物的“先天局限”——其作用机制与原研药高度同源,难以突破原研药已建立的临床优势。即便通过剂量优化实现疗效提升,也可能因毒性增加而得不偿失。例如,奥希替尼的160 mg剂量虽能提高颅内暴露量,但皮疹、腹泻等副作用显著上升,而TY-9591的Ⅰ期数据显示,其高剂量组(160 mg)的3级以上不良事件发生率仍达30.5%,提示氘代的安全性优势可能被高估。
四、前车之鉴:氘代药物的“尴尬宿命”
氘代药物的商业化困境早有先例。泽璟制药的多纳非尼(氘代索拉非尼)虽在国内获批肝癌适应证,但上市时索拉非尼仿制药已遍地开花,且肝癌治疗格局早已转向免疫联合疗法。最终,多纳非尼未能复制“药王”神话,反而陷入市场定位模糊的窘境。
这一教训揭示了氘代药物的双重困境:在原研药专利期内,难以证明临床优势;专利到期后,又面临仿制药的价格碾压。即便TY-9591未来获批,其市场窗口期也将极为有限——奥希替尼的化合物专利将于2029年到期,而第四代EGFR抑制剂(如BLU-945)已进入临床,直接靶向奥希替尼耐药突变。尽管临床表现可能优于奥希替尼,但患者可能会选择先用更便宜的仿制药,“坐等”第四代EGFR-TKI。
五、未来之路:从“捷径”到底层创新
氘代技术的价值不应被全盘否定。在特定场景下,如改善中枢神经系统渗透性(如TY-9591对脑转移的潜在优势),或针对代谢缺陷明确的药物进行优化,氘代仍可能成为差异化竞争的利器。
然而,真正的创新不能止步于“分子微调”。TY-9591的案例警示行业:依赖氘代技术挑战“药王”的策略风险极高。唯有从靶点发现、作用机制等底层创新入手,才能在全球创新药竞争中占据主动。毕竟,在“内卷”的EGFR赛道,下一个“药王”绝不会是一个Me Better的氘代分子。
结语
氘代药物如同一把双刃剑——它既是快速迭代的“捷径”,也可能成为创新惰性的温床。当行业为TY-9591的阶段性胜利欢呼时,更需冷静思考:中国创新药的未来,究竟需要怎样的“Me Better”?答案或许不在同位素替代的化学游戏中,而在敢于突破的原始创新里。
诊断、筛查技术进展
……
1-
Nature Medicine :广东省人民医院吴一龙教授将脑脊液ctDNA分析用于NSCLC的CNS转移风险分层和匹配治疗 [1]。
在NSCLC中,CNS转移严重威胁患者生存,而液体活检有望通过非侵入性的检查来对患者进行分层,以改善CNS转移患者预后并避免非CNS转移患者过度治疗。
研究纳入584例合并CNS转移的NSCLC患者,其中396例患者ctDNA阳性。脑膜转移患者ctDNA检出率高达84.8%,脑转移患者ctDNA检出率则为46.2%。具有5个及以上可评估脑转移病灶的患者ctDNA检出率明显更高(64.7% vs 33.3%),ctDNA阳性组患者脑部病变也更大,反映脑转移肿瘤负荷。最重要的是,研究确认ctDNA可作为OS的独立预后因素,阳性患者mOS显著短于阴性患者(11.1个月 vs 21.4个月,HR为1.9)。这一结论在初治或经治、脑转移或脑膜转移亚组中依旧成立。脑脊液ctDNA状态可用于识别高脑膜转移风险的患者,阳性患者从脑转移进展为脑膜转移的风险更高(2年比例分别为48.5%和23.5%)。此外,脑脊液ctDNA识别出88.1%的患者存在驱动基因突变,在亚洲人群中与脑转移瘤的DNA突变特征高度一致。特别地,脑脊液ctDNA检测到一些肿瘤测序未发现的特异性突变或拷贝数变异。这些变异主要存在于RTK/RAS、PI3K、细胞周期以及TGFβ通路中,与更差OS相关(9.9个月 vs 15.3个月)。此外,研究团队还开发了一个多变量模型,包含脑脊液ctDNA状态、RB1突变ECOG评分、肿瘤转移负荷和全身疾病进展情况,可将患者分层为高风险组和低风险组。在指导治疗方面,脑脊液ctDNA阳性且携带至少一个驱动基因突变患者接受靶向治疗可改善OS,脑脊液ctDNA阳性患者接受ICI也具有显著获益。用脑脊液ctDNA作为CNS转移进展时组织活检的替代方法是可行的,可以给患者带来生存获益,支持脑脊液ctDNA用于CNS进展患者治疗过程中的纵向动态检测。
2-
Nature Medicine :ctDNA指导Ⅱ期结肠癌辅助治疗的DYNAMIC研究5年结果更新 [2]。
早期数据表明,ctDNA指导的辅助化疗相比标准方案,可在不影响Ⅱ期结肠癌2年RFS的情况下减少辅助化疗的使用。标准管理组患者按照标准管理策略接受辅助化疗,而ctDNA指导管理组的患者则在术后第4、7周接受ctDNA检测,由医生基于这两次检测情况决定是否使用辅助化疗。若ctDNA阳性则接受氟尿嘧啶单药或含奥沙利铂的联合化疗方案,阴性患者则不接受辅助化疗。在中位随访59.7个月时,ctDNA指导管理组和标准管理组的5年RFS分别为88%和87%,5年OS率相似,分别为93.8%和93.3%。ctDNA阳性的患者中,40例患者中有35例在辅助化疗结束时观察到ctDNA清除。血浆术后肿瘤衍生突变分子浓度高于中位数的患者与较低的ctDNA清除率和较差的5年RFS相关。基于29个肿瘤衍生突变,辅助化疗结束后的ctDNA清除与持续存在的患者5年RFS分别为97%和0。
5年数据证实了先前的研究结论。对于ctDNA阳性患者,术后突变负荷和辅助治疗后ctDNA清除情况可提供额外的预后信息。
3-
Nature Medicine :Ⅲ期CheckMate 649研究的探索性生物标志物分析 [3]。
CheckMate 649研究采用纳武利尤单抗联合化疗或伊匹木单抗对比化疗治疗胃食管结合处癌患者,进一步的生物标志物分析有助于区分适合不同治疗方案的患者。
该研究对1581例患者进行分类,分为占主导的染色体不稳定型(CIN)、基因组稳定型(GS)、超突变型以及EB病毒阳性型。其中,超突变型患者接受化免方案获益最大,相比单纯化疗的HR为0.37。EB病毒阳性型获益紧随其后,HR达0.39。在占比最多的CIN患者中,患者接受联合疗法的获益最少,HR仅为0.92。研究者发现,预测免疫疗法获益的关键因素是肿瘤突变负荷(TMB),当TMB超过199个突变/外显子(相当于10个突变/百万碱基),化免组的中位OS相比单纯化疗延长近一倍。这些患者在MSI-H患者中富集。特别地,KRAS突变或扩增的患者接受化免疗法获益显著,相比化疗的HR为0.53。研究认为KRAS可能通过ERK-MAPK通路促进免疫抑制微环境,常在肺癌中导致耐药。但PD-1抑制剂可以逆转此种耐药机制。此外,肿瘤微环境特征可预测患者预后。低血管生成特征与最佳生存获益相关,因为低血管生成常常意味着肿瘤血管异常程度低。低间质信号与化免方案的生存获益改善相关,因为低密度间质有助于免疫细胞浸润。Treg含量高预示免疫抑制,但纳武利尤单抗联合伊匹木单抗组中高Treg与生存改善相关,表明CTLA-4抑制剂通过清除Treg重塑肿瘤微环境。在纳武利尤单抗+化疗和纳武利尤单抗+伊匹木单抗的对比中,只有前者达到预定终点,后者仅在特定亚组中展现治疗获益(如高Treg亚组)。
该研究为胃癌治疗方案的制定提供了重要思路:临床医生可通过全基因组外显子测序对患者进行基因分型,随后利用RNA-seq分析肿瘤微环境的血管生成、间质状态和免疫细胞浸润特征,为患者选择合适的治疗方案。同时,在治疗过程中动态监测ctDNA明确TMB和突变基因状态。
内科治疗进展
……
1-
The Lancet :同济大学附属东方医院周彩存教授HARMONi-2研究登顶柳叶刀主刊,依沃西单抗和帕博利珠单抗头对头Ⅲ期研究论文发布 [4]。
在预先计划的中期分析中,国产创新药依沃西单抗单药一线治疗PD-L1表达阳性(PD-L1 TPS≥1%)的晚期NSCLC患者相比帕博利珠单抗实现更优越的疗效,中位PFS明显更长(11.14个月 vs 5.82个月),HR为0.51。在各亚组中,依沃西单抗对帕博利珠单抗的PFS获益一致,HR分别为鳞状0.50、非鳞0.55、TPS 1~49% 0.54、TPS≥50% 0.48、肝转移0.47、脑转移0.55。3级及以上TRAE发生率分别为29%和16%,3级及以上免疫相关不良事件发生率分别为7%和8%。作为一款创新性双抗,伊沃西双抗的作用机制不同于单克隆抗体的组合。特别是在VEGF存在的情况下,依沃西单抗与PD-1结合的亲和力可增加10倍,这可解释依沃西单抗临床表现优于两种双抗的组合的表现。基于该研究结果,依沃西单抗有望成为PD-L1阳性晚期NSCLC患者一线治疗的另一选择。
2-
JAMA :北京大学肿瘤医院沈琳教授公布舒格利单抗联合化疗一线治疗晚期胃癌的Ⅲ期GEMSTONE-303研究结果 [5]。
舒格利单抗是一种全人源化的PD-L1抗体,在既往ⅠB期研究中展现出对初治、不可切除、局晚期或转移性胃或胃食管交界处腺癌患者的优秀抗肿瘤活性和安全性。
在Ⅲ期研究中,舒格利单抗联合CAPOX化疗方案对比安慰剂联合CAPOX方案,在PD-L1 CPS评分≥5的患者中显著改善了mOS(15.6个月 vs 12.6个月,HR为0.75)和mPFS(7.6个月 vs 6.1个月,HR为0.66)。12个月和24个月OS率分别为61.25% vs 29.90%和52.02% vs 23.28%。其他次要终点方面,ORR分别为68.6%和52.7%,中位DOR分别为6.87个月和4.63个月。舒格利单抗组和安慰剂组在3级及以上TRAE发生率方面接近,分别为53.9%和50.6%。该研究结果支持舒格利单抗联合化疗治疗既往未经治疗的不可切除的局晚期或转移性胃或胃食管结合部腺癌患者。该研究是全球首个在胃癌Ⅲ期研究中达到OS和PFS双终点阳性的PD-L1单抗研究,也是首次在晚期胃癌中精准筛选PD-L1 CPS评分≥5的患者的临床研究。
3-
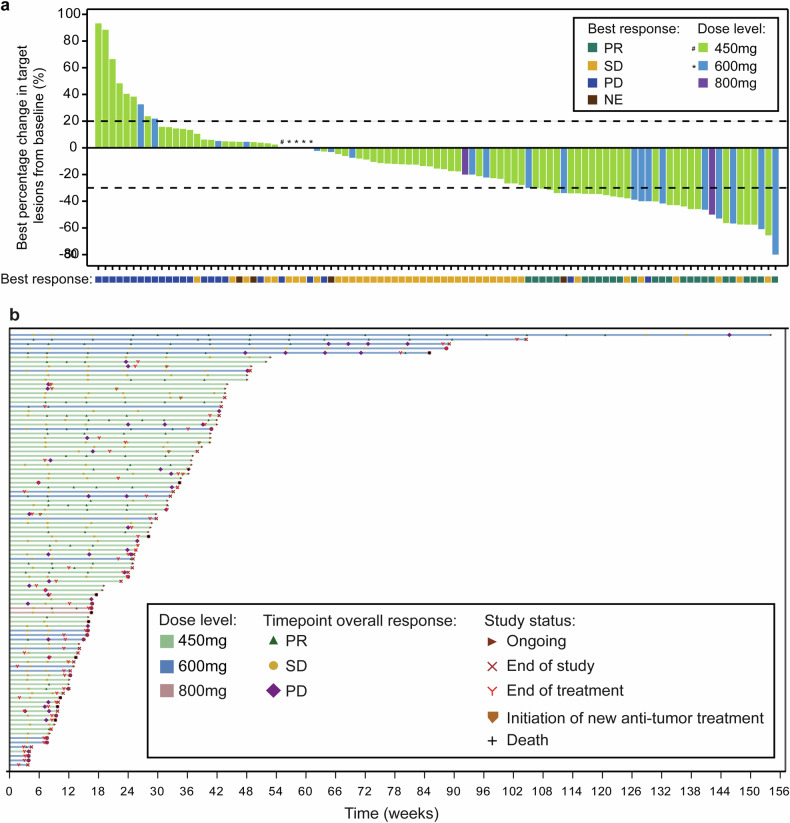
Journal of Clinical Oncology :广东省人民医院吴一龙教授公布宗格替尼(BI1810631)治疗具有HER2改变的晚期或转移性实体瘤(包括NSCLC)患者Ⅰ期Beamion LUNG-1研究结果 [6]。
HER2改变在多种实体瘤中都有发生,其中包括NSCLC。但目前HER2靶向药主要适应证集中在乳腺癌和胃癌,肺癌只有一种HER2 ADC可用。HER2 TKI如吡咯替尼和波奇替尼等显示出对EGFR野生型的脱靶毒性,常见TRAE包括腹泻和皮疹。宗格替尼是一种新型HER2选择性酪氨酸激酶抑制剂,可选择性地与HER2不可逆结合并保留野生型EGFR。
本研究旨在评估宗格替尼的安全性和有效性。计量递增方案包括每天2次每次15、30、60、100和150 mg和每天1次每次60、120、180、240、300和360 mg。本次研究的主要终点是MTD和DLT,次要终点是肿瘤反应。在105例患者中,MTD评估期间发生2次DLT,未达到MTD。推荐的扩展剂量为120或240 mg/d。TRAE发生率为82%,3级及以上的发生率为10%。腹泻和皮疹的发生率分别为50%和16%,3级及以上的发生率为1%和4%。在所有患者中,ORR为30%,DOR达12.7个月。在NSCLC患者亚组中,确认的ORR为35%。特别地,在A775_G776insYVMA患者(38%)和既往接受过HER2治疗的患者(28%)也观察到相当的活性。总体患者的中位PFS为17.2个月。在既往治疗中位数为4的这些患者中,宗格替尼的疗效令人鼓舞,在NSCLC、乳腺癌以及其他肿瘤患者中观察到了持久反应。未来还有更大规模的研究进一步探索宗格替尼在肺癌等瘤种的临床数据。
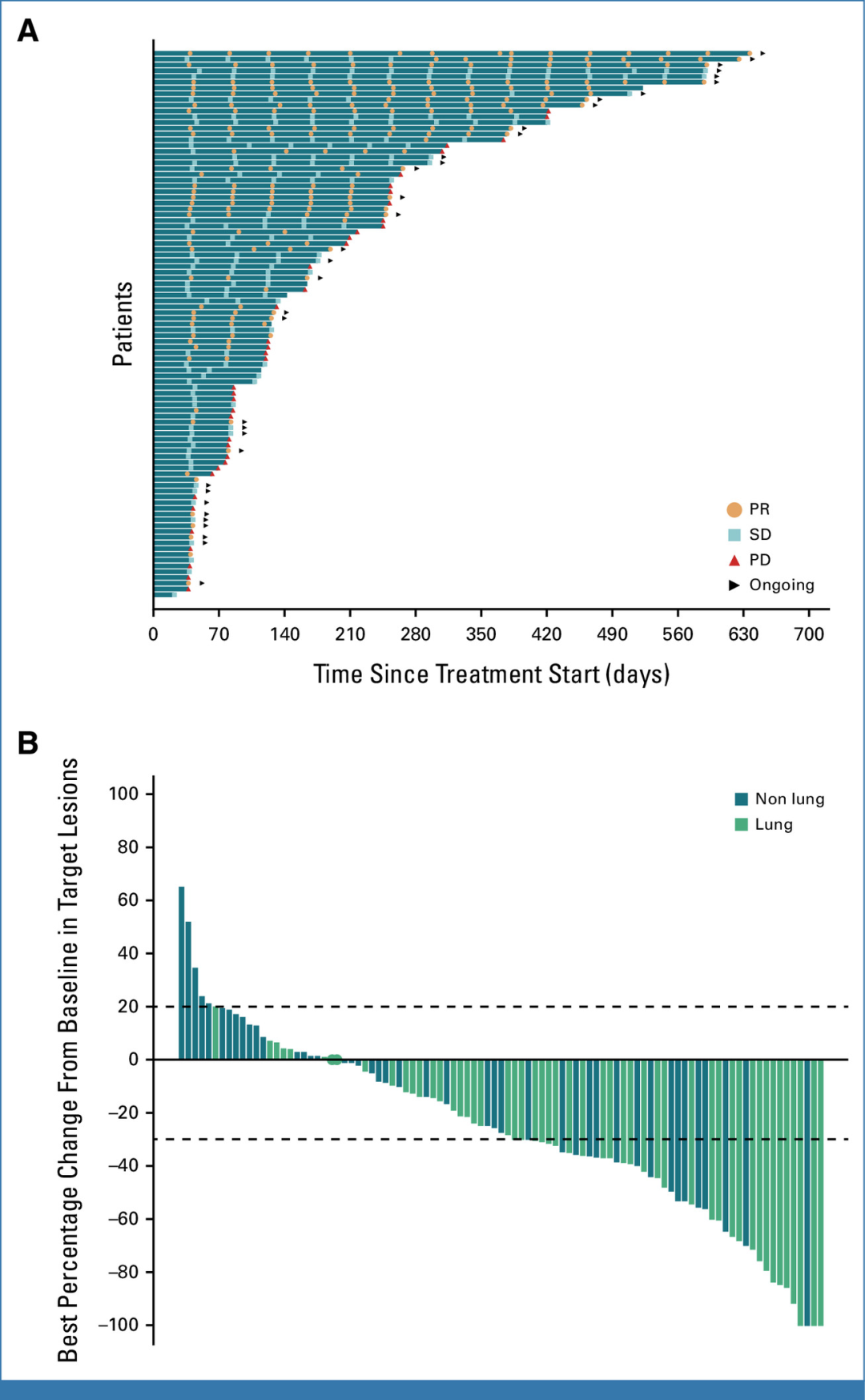
4-
Signal Transduction and Targeted Therapy :中山大学肿瘤防治中心赵洪云教授公布HA121-28在晚期实体瘤和RET融合阳性NSCLC患者中的Ⅰ/Ⅱ期研究数据 [7]。
在NSCLC中,大部分的RET融合患者不吸烟,诊断时常在晚期。这些患者常表现出PD-1低表达和低TMB。因此,RET-TKI为临床未满足的医疗需求提供了很好的解决方案。当前,普拉替尼和塞普替尼已被批准用于治疗RET融合阳性NSCLC患者,但其最终会发生耐药,常见耐药突变包括KIF5B-RET G810C/S/R,常见的脱靶耐药包括MET扩增、PIK3CA突变或PTEN缺失、EGFR扩增、ERBB2扩增、KRAS扩增或突变以及BRAF V600E改变。既往研究认为RET与EGFR作为致癌驱动因素是互斥的,但在部分患者中发现了二者的共存。EGFR信号与RET抑制剂耐药相关,同时靶向RET和EGFR的多靶点TKI可能会延缓耐药,提高疗效。
HA121-28是一种多靶点TKI,抑制RET、EGFR和VEGFR-2。在Ⅰ期研究中,入组133例患者,其中108例是肺癌患者,62例为RET融合阳性。在Ⅱ期研究中,入组48例RET融合阳性、RET抑制剂初治的NSCLC患者,所有患者既往均接受过铂类化疗。
Ⅰ期研究中99.4%的患者都经历过至少1次TEAE,3级及以上TEAE发生率为48.8%。3级及以上TEAE中,最常见的是QT间期延长(15.0%)、腹泻(8.1%)和皮疹(5.6%)。Ⅱ期研究中最常见的3级及以上TEAE为 QT间期延长(31.3%)、腹泻(12.5%)和高血压(18.8%)。这三个不良反应也是最常见的TRAE。安全观察期间未发生治疗相关死亡。RP2D为450 mg。总体来看,RET融合阳性NSCLC患者ORR为26.8%,DCR为72.2%,无CR。在携带CCDC6-RET融合患者中,ORR为46.7%,DOR达14.0个月,中位PFS为14.9个月。在KIF5B-RET融合患者中,ORR为25.4%,DOR达7.7个月,中位PFS为5.5个月。无论患者是否存在脑转移或既往TKI治疗,ORR均类似。靶向外显子组测序显示,TP53野生型患者相比突变患者PR率更高(33.3% vs 91.%),具有SMARCA4、SMARCB1和EZH2改变的患者预后更差。
研究数据显示,与其他RET多靶点TKI类似,HA121-28仍需关注心脏毒性。HA121-28为RET融合患者提供了多靶点治疗方案,但对塞普替尼或普拉替尼一线治疗后进展的患者的活性仍未知。
抗肿瘤机制研究进展
……
1-
Journal of Thoracic Oncology :同济大学附属东方医院周彩存教授揭示清除CCR8 +Treg通过DC细胞增强细胞毒性T细胞抗肿瘤免疫机制 [8]。
Treg是一种免疫异质性T细胞亚群,其在肿瘤内的聚集限制了免疫疗法的疗效。特别地,Treg选择性表达CCR8,是其理想的靶标。在4种荷瘤(NSCLC)小鼠中,CCR8抗体LM-108和PD-1抑制剂联合应用显著抑制了肿瘤生长,同时并没有导致小鼠体重明显下降和全身细胞因子风暴。单细胞RNA-seq和T细胞受体测序分析表明,抗CCR8疗法通过重塑肿瘤微环境、破坏CCR8 +Treg与CCL5 +DC间的相互作用,与PD-1阻断相协同。从机制上来讲,CCR8 +Treg的耗竭与PD-1抑制剂通过激活CCL5 +DC的JAK-STAT通路,促进IL-12分泌,从而促进了CD8 +T细胞的细胞毒作用。总体来看,肿瘤浸润性Treg的CCR8表达与DC和CD8 +T细胞的免疫抑制功能相关,阻碍抗肿瘤免疫。
临床前研究进展
……
1-
Journal of Hematology & Oncology :南开大学张泉教授揭示阻碍sorcin和PAX5的蛋白相互作用促进FBXL12介导的ALDH1A1泛素化,介导胰腺癌铁死亡 [9]。
铁死亡是一种有前途的肿瘤治疗策略,与一些肿瘤的致癌途径相关。基于铁死亡的肿瘤治疗方案可能是对传统促进凋亡的肿瘤药物耐药的恶性肿瘤治疗新选择。在胰腺癌中,sorcin与患者生存和分期呈正相关,可通过非钙结合功能抑制铁死亡。此外,sorcin与细胞质PAX5相互作用并抑制PAX5核转位,返回过来降低了FBXL12蛋白表达,减少ALDH1A1泛素化,进而抑制铁死亡。celastrol直接与sorcin蛋白的Cys194残基结合抑制sorcin和PAX5的相互作用,促进后者的核转位从而通过上述通路逆转对铁死亡的抑制。
研究认为,sorcin是诱导铁死亡的可成药靶点,celastrol是治疗胰腺癌的有前景的治疗药物。
刊后语
大风泱泱,大潮滂滂;大道如砥,医者无疆。
积跬步以至千里,每一期周刊都是恶性肿瘤学科发展的剪影;积小流以成江海,一年周刊浓缩肿瘤领域各科前沿进展的精华!关注CACA周刊,带你领略恶性肿瘤学科发展的四季花开。
CACA周刊,我们下周不见不散!
编辑 | 李瑞源
排版 | 晓晓
审核 | 李瑞源
链接:http://www.lewenyixue.com/2025/03/19/%E3%80%90CACA%E5%89%8D%E6%B2%BF%E5%91%A8%E5%88%8A%E3%80%9190%E6%9C%9F%20%20%E6%B0%98%E4%BB%A3%E8%8D%AF%E7%89%A9%EF%BC%9A/






赶快来坐沙发