Cancer Cell | 吴德华/董忠谊团队揭示远隔效应新靶点及放-免联合治疗新策略
放疗联合免疫治疗 (特指免疫检查点抑制剂) 被认为是一种极具前景的联合治疗模式,目前已得到多项临床研究论证,尤其在局部晚期肺癌患者中,放疗联合免疫治疗已成为标准治疗。 研究表明放疗不仅可以有效控制局部照射肿瘤,更为重要的是,部分患者接受放疗联合免疫治疗后,未受照射的肿瘤也得到了有效控制 。也就是说,局部肿瘤放疗对远处肿瘤产生了治疗效果,犹如“ 隔山打牛 ”,从而极大地提高了抗肿瘤效应。因此,有学者提出了 放疗联合免疫治疗形成“远隔效应” 的学说。然而,在随机临床实验以及我们的临床实践中,放免联合治疗远隔效应的实际发生率比较低 【1, 2】 ,其背后的分子机制至今仍未被阐明。
2025年3月13日, 南方医科大学南方医院放疗科 吴德华/董忠谊 团队,在 Cancer Cell 在线发表了研究论文 PAI-1-driven SFRP2 high cancer-associated fibroblasts hijack the abscopal effect of radioimmunotherapy 【3】 。该研究 发现放免联合治疗时,被照射的肿瘤会释放PAI-1蛋白,诱导远处肿瘤血管周细胞转化为高表达SFRP2的肿瘤相关成纤维细胞(SFRP2 high CAFs),进而阻碍T细胞攻击远侧肿瘤;而靶向PAI-1/SFRP2成功逆转了远侧肿瘤的免疫抵抗,显著增强远隔效应!

首先,作者在各种临床前模型中探究放免联合治疗后远隔效应的发生情况。研究使用MC38结肠癌、LLC1肺癌、B16黑色素瘤、4T1乳腺癌及LLC1-sg Lkb1 肺癌双侧荷瘤模型,发现放免联合治疗仅在MC38及LLC1模型中触发远隔效应,抑制双侧肿瘤并延长生存;而在B16、4T1、LLC1-sg Lkb1 模型中,放免联合治疗虽然能有效抑制照射侧肿瘤生长,但无法有效控制远隔侧肿瘤或延长小鼠生存,即无法诱导远隔效应的发生,并且这与未照射肿瘤处CD8 + T细胞浸润减少相关。为了阐明其潜在的机制,作者对接受ICIs或放免联合治疗的未照射 肿瘤组织进行转录组学测序。分析显示,B16、4T1、LLC1-sg Lkb1 模型在放免联合治疗后,上调最显著的主要是细胞外基质重塑相关通路,3个肿瘤模型共同上调的差异基因都主要表达于 肿瘤相关成纤维细胞 (Cancer-associated fibroblasts, CAFs ) 。于是,作者团队通过体内基质细胞全基因组CRISPR文库筛选,定位到影响远隔侧肿瘤放免联合治疗后基质活化的关键分子SFRP2。生信分析及实验验证表明,SFRP2特异性表达于CAFs,并且放免联合治疗后在远隔侧肿瘤中显著上调。据此,作者团队锁定了阻碍远隔侧免疫细胞浸润的潜在“罪魁祸首”SFRP2 high CAFs。
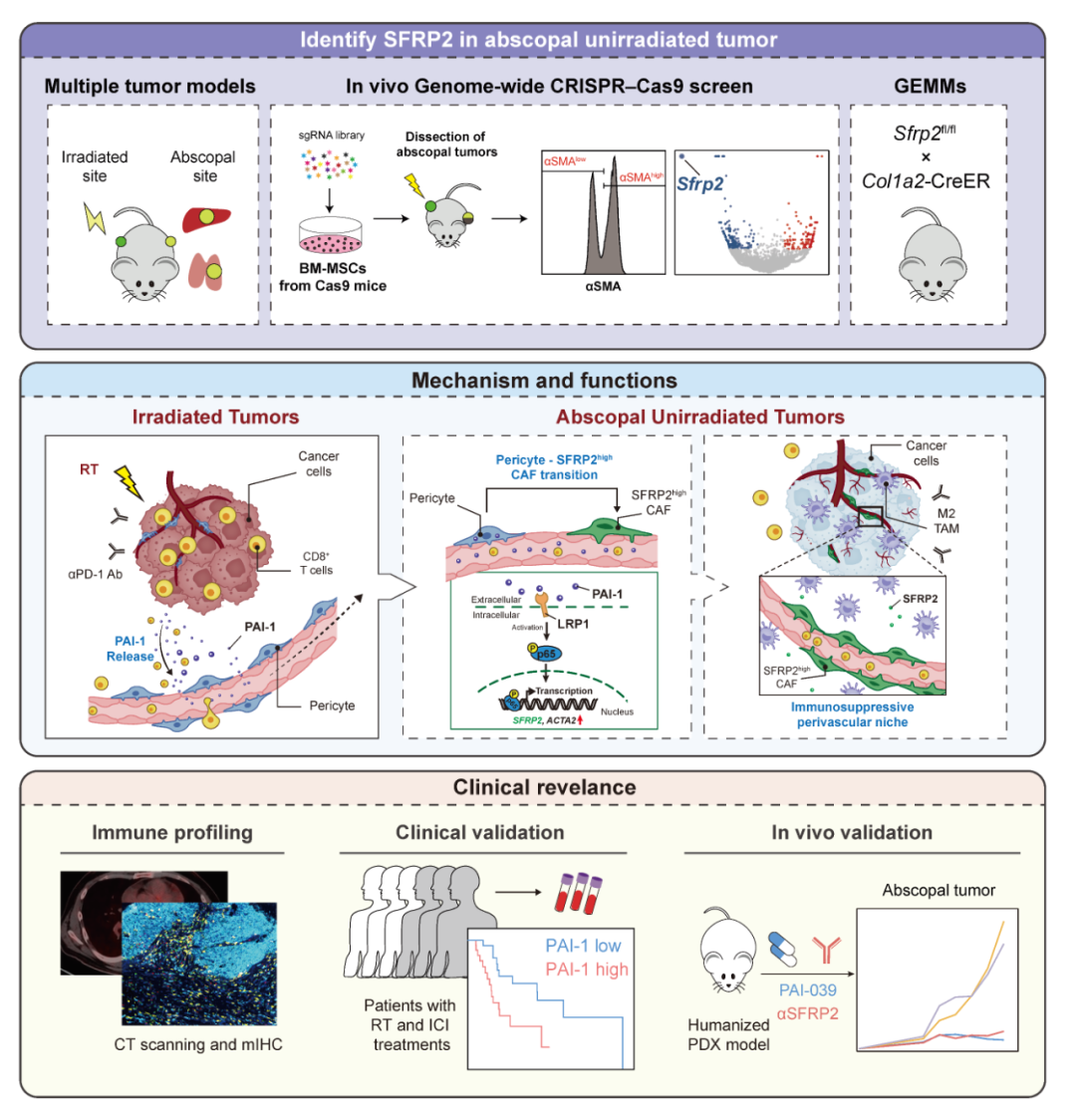
接下来作者想验证,基因或药物阻断CAFs中的SFRP2是否可以增强放免联合治疗的远隔效应。于是作者在 Sfrp2 野生型小鼠 ( Sfrp2 fl/fl ) 和 Sfrp2 条件敲除小鼠 ( Sfrp2 Δ Col1a2 ) 中构建了LLC1-sg Lkb1 肺癌、B16黑素瘤双侧肿瘤模型。发现 Sfrp2 ΔCol1a2 小鼠接受放免联合治疗后,其未照射远隔侧肿瘤明显得到控制,生存率得到改善;使用SFRP2中和抗体也可以得到类似的效果。与 Sfrp2 fl/fl 小鼠相比,放免联合治疗显著促进了 Sfrp2 Δ Col1a2 小鼠远隔未照射肿瘤中CD8 + T细胞浸润,特别是对ICIs反应至关重要的干细胞样CD8 + T祖细胞的增加。此外,放免联合治疗显著增加了 Sfrp2 Δ Col1a2 小鼠远隔未照射肿瘤中CD8 + T细胞活化水平、肿瘤坏死因子和干扰素γ分泌水平以及外周效应记忆T细胞 (TEMs) 水平。综上所述,阻断CAFs中的SFRP2可以激活未照射肿瘤中CD8 + T细胞介导的抗肿瘤免疫,并促进远隔效应发生。
接下来作者进一步探讨SFRP2 high CAFs是如何阻碍远隔效应的发生。作者通过单细胞转录组测序分析了不同处理条件下 Sfrp2 fl/fl 和 Sfrp2 Δ Col1a2 小鼠中未照射肺肿瘤的微环境特征。研究发现,接受放免联合治疗的 Sfrp2 fl/fl 小鼠肿瘤中,CAFs与内皮细胞及M2巨噬细胞的互作网络显著增强,而 Sfrp2 条件性敲除可逆转这种细胞间通讯的异常活跃。深入分析表明,SFRP2 high CAFs通过驱动远端未照射肿瘤形成免疫抑制性血管微环境,进而影响免疫细胞浸润。基于CAFs免疫抑制功能的空间依赖性特征,研究者进一步研究了SFRP2 high CAFs及其下游靶细胞的空间定位关系,揭示其通过构建“围血管免疫抑制生态位”阻碍CD8 + T细胞浸润的关键过程。机制研究显示:其一,SFRP2 high CAFs通过抑制内皮细胞羟基前列腺素脱氢酶 (HPGD) 的表达,削弱CD8 + T细胞的浸润能力;其二,敲除 Sfrp2 的CAFs可通过促进巨噬细胞分泌CXCL4,显著增强CD8 + T细胞的募集。
那放免联合治疗是如何诱导远隔侧肿瘤出现这样一群SFRP2 high CAFs的呢?本研究通过整合人肺癌单细胞转录组测序数据集与体内谱系追踪技术,系统解析了放免联合治疗诱导SFRP2 high CAFs的起源机制。细胞轨迹分析提示周细胞可能作为SFRP2 high CAFs的潜在来源,这一假说通过 Cspg4 -creERT2; Rosa26 - tdTomato 小鼠模型的谱系追踪实验获得验证。进一步探究放免联合治疗介导远端未照射肿瘤周细胞表型重塑的分子机制,发现对肿瘤的射线照射可能是触发远隔效应的起始事件。小鼠外周血血清蛋白质组学等实验揭示了Ⅰ型纤溶酶原激活物抑制剂 (PAI-1) 在该过程的关键作用:经放射处理的肿瘤细胞分泌PAI-1入血后,通过与远隔未照射肿瘤内血管周细胞表面LRP1受体结合,激活p65磷酸化信号轴,进而驱动SFRP2和ACTA2的协同转录,最终促使周细胞向SFRP2 high CAFs转分化。值得注意的是, PAI-1抑制剂可有效逆转远隔未照射肿瘤的微血管免疫抑制生态,具体表现为SFRP2表达显著下调、新生血管密度降低以及CD163 + 肿瘤相关巨噬细胞 (TAM) 浸润减少,并最终增强放免联合治疗的远隔效应。
本研究最终在人源化肺癌PDX模型中系统性验证了靶向干预SFRP2或PAI-1的临床转化价值。 研究数据证实,通过抑制SFRP2或PAI-1信号通路可显著增强放免联合治疗诱导的远隔效应。这一发现不仅揭示了SFRP2/PAI-1轴作为增强放免联合治疗远隔效应的关键调控靶点,更在转化医学层面展现出明确的临床应用前景,为拓展放免联合治疗治疗的临床获益提供了实验依据。
综上所述, 该研究创新性地着眼于远隔未照射肿瘤的免疫微环境,揭示了放免联合治疗打击下,肿瘤转而“派遣”PAI-1入血以“策反”远隔侧肿瘤周细胞成为SFRP2 high CAFs,阻碍远隔效应发生的新机制。 研究进一步靶向免疫微环境,通过拦截“信使”PAI-1或阻断SFRP2以阻止周细胞的“叛变”,重振远隔侧抗肿瘤免疫,为实现放免联合治疗的疗效最大化提供新方向。
原文链接:
https://www.cell.com/cancer-cell/abstract/S1535-6108(25)00076-5
制版人: 十一
参考文献
2. McBride, S., et al., Randomized Phase II Trial of Nivolumab With Stereotactic Body Radiotherapy Versus Nivolumab Alone in Metastatic Head and Neck Squamous Cell Carcinoma. J Clin Oncol , 2021. 39 (1): p. 30-37.
3. Zhang, Y.P., et al., PAI-1-driven SFRP2(high) cancer-associated fibroblasts hijack the abscopal effect of radioimmunotherapy. Cancer Cell, 2025.
链接:http://www.lewenyixue.com/2025/03/17/Cancer%20Cell%20%7C%20%E5%90%B4%E5%BE%B7%E5%8D%8E-%E8%91%A3%E5%BF%A0/





赶快来坐沙发