宿主对抗GD2 mAb(单克隆抗体)的免疫反应可能会导致抗药抗体产生,加速抗体清除并影响治疗效果。尽管去除鼠源抗原表位可以降低这一风险,但即使是嵌合抗体仍可能引发免疫反应。为减少敏化风险,MSK的研究者开发了Naxitamab(原称人源化3F8,Hu3F8),一种IgG1亚型人源化mAb。临床前研究表明,Naxitamab相较于其他抗GD2 mAb具有更高的GD2亲和力(高10倍)、更强的白细胞介导的抗体依赖性细胞毒性(ADCC)及降低但仍然有效的补体依赖性细胞毒性(CDC)。增强的ADCC与更好的治疗反应相关,而较低的CDC可能减少由补体激活引起的疼痛毒性。鉴于体外研究显示抗GD2 mAb与ADCC存在剂量-反应关系,高剂量应用可能增强抗肿瘤效果,且Dimutuximab(ch14.18)的临床研究亦表明较高血清水平与更好的治疗反应相关,因此MSK的专家们认为,高剂量的Naxitamab在神经母细胞瘤的治疗中具有可行性。
在I/II期研究中,包括一项关键国际试验(NCT03363373),Naxitamab联合GM-CSF在难治性高危神经母细胞瘤(HR-NB)骨及骨髓病变中表现出安全性和疗效,并因此获得FDA快速通道审批。这些积极结果促使研究者进一步开展II期临床试验,以评估该免疫疗法在HR-NB 首次次完全缓解患者中的应用价值。
近日,纪念斯隆凯特琳癌症中心的 B. H. Kushner,S. Modak,N.-K. V. Cheung 等在 Clinical Cancer Research 上发表了题为 A phase II trial of Naxitamab plus stepped-up dosing of GM-CSF for patients with high-risk neuroblastoma in first complete remission 的文章, 我们一起来了解下。
https://doi.org/10.1158/1078-0432.CCR-24-3427
缩写:
mAb:monoclonal antibodies,单克隆抗体
HR-NB:high-risk neuroblastoma, 高危神经母细胞瘤
GM-CSF:Granulocytemacrophage colony-stimulating factor, 粒细胞巨噬细胞集落刺激因子
CR:complete remission, 完全缓解
CNS:central nervous system, 中枢神经系统
BM:bone marrow, 骨髓
ADCC:antibody-dependent cellular cytotoxicity, 抗体依赖性细胞毒作用
CDC:complement-dependent cytotoxicity, 补体依赖性细胞毒作用
HAHA:human anti-human antibody, 人抗人抗体
入组标准包括MYCN扩增的2/3/4/4S期(任何年龄)或年龄大于18个月的MYCN非扩增的4期疾病,并且主要器官功能障碍等级<3(根据不良事件通用术语标准4.0版)。完全缓解(CR)由国际神经母细胞瘤反应标准(INRC)定义, 但未包含微小残留病灶(MRD) 。原发肿瘤(包括3期患者)必须在入组前切除。原发部位的放疗可以在入组前或入组后进行。
在2017年2月15日至2020年7月15日期间,共59名患者入组,年龄范围为5.5个月至17.8岁(中位数3.5岁),诊断为Ⅲ/Ⅳ期神经母细胞瘤(NB)后4个月至3.8年(中位数7个月)。其中,53例为Ⅳ期,6例为Ⅲ期。30名患者(51%)中检测到MYCN扩增。所有患者均接受过高危NB诱导化疗,其中18例(31%)曾接受抗GD2单抗治疗(8例联合伊立替康-替莫唑胺方案);13例(22%)接受过二线治疗;11例(19%)接受了大剂量化疗联合自体造血干细胞移植(ASCT);3例(5%)接受了¹³¹I-MIBG治疗。此外,4例患者因毒性反应而中止了另一种抗GD2单抗(dimutuximab)治疗,13例(22%)在诱导治疗后仍为原发难治性疾病(即未能达到完全缓解),但经二线化疗和/或抗GD2单抗治疗后达到首次CR。
每个免疫治疗周期包括:1)在-4至0天(周三至周日)皮下注射GM-CSF 250 µg/m2/天的初始剂量,然后在+1至+5天(周一至周五)增加到500 µg/m2/天;2)在+1、+3和+5天(周一、周三、周五,即每周期3次)静脉注射naxitamab,每次30-90分钟。Naxitamab剂量为3 mg/kg/次(9 mg/kg/周期,即约270 mg/m2/周期),并在GM-CSF后约1小时开始。如果绝对中性粒细胞计数>20,000/µl,则暂停GM-CSF。预处理包括阿片类药物和抗组胺药。
患者最多可接受5个周期。从周期结束到下一个周期开始的间隔为2至4周,直到第4个周期,然后为6至8周,直到第5个周期。这种灵活性是为了适应社会原因和床位可用性。每周期后检查人抗人抗体(HAHA),如果HAHA阳性,则延迟naxitamab+GM-CSF,直到HAHA转为阴性。如在使用鼠源3F8的前身研究(MSK方案Clinicaltrials.gov NCT02100930)中,允许HAHA阳性患者接受低剂量维持方案,如伊立替康-替莫唑胺或利妥昔单抗(Rituximab)±环磷酰胺免疫治疗以抑制HAHA。当HAHA转为阴性时,可以恢复naxitamab+GM-CSF。
异维甲酸(Isotretinoin)160 mg/m²/天,口服14天/疗程,在第2周期后开始,免疫治疗间歇期服用,最多持续6个疗程。
共59名患者接受了naxitamab+GM-CSF治疗,总计244个周期。其中:40例完成5个周期,4例完成4个周期,2例完成3个周期,9例完成2个周期,4例完成1个周期。未完成5个周期的主要原因包括早期疾病进展(PD,n=4,均为中枢神经系统受限)和HAHA阳性(n=6)。在8个治疗周期中,由于病毒感染(n=2)、社交因素(n=2)、肝酶升高(n=1)、结肠炎(n=1)、高血压(n=1)或无反应性(n=1),患者未能完成既定的3次naxitamab输注。
10/59例(17%)患者出现HAHA阳性,发生在第1周期(n=6)、第2周期(n=2)、第3周期(n=1)或第4周期(n=1)。其中4例曾接受dimutuximab治疗,HAHA出现较早(3例在1个周期后,1例在2个周期后)。3例HAHA阳性患者在研究期间出现疾病进展(PD)。5例因HAHA阳性导致naxitamab+GM-CSF延迟的患者,接受了维持和/或抗HAHA治疗,包括:利妥昔单抗+环磷酰胺+伊立替康-替莫唑胺(n=2),dimutuximab+GM-CSF(n=2),利妥昔单抗+环磷酰胺(n=1)。
异维甲酸(Isotretinoin)治疗情况:24例患者完成6个疗程。14例因PD、不耐受或小肠梗阻,仅完成1-5个疗程。21例未在研究期间服用,其中20例因既往已服用/出现严重毒性,1例因第2周期后出现结肠炎,为避免并发症而停用。
入组后,39名患者接受了原发部位的巩固放疗,其中36名在第一个周期后,3名在第二个或第三个周期后。其他20名患者在入组前接受了放疗。
试验结束后,50名患者接受了额外的抗NB治疗,包括二价疫苗(n=44)、二氟甲基鸟氨酸(DFMO)(n=4)或疫苗+葡聚糖后接DFMO(n=2)。这些治疗在最后一次naxitamab给药后1至4个月(中位数2个月)开始。9名患者未接受额外治疗,原因包括研究期间PD(n=7)或社会问题(n=2)。
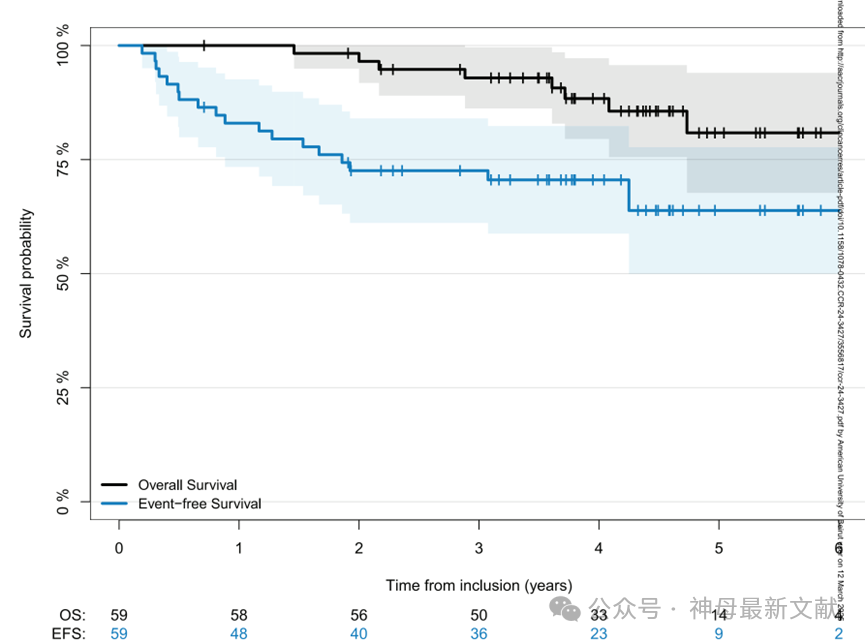
图1. 59例患者整体队列的无事件生存率(EFS)和总生存率(OS)
共发生3例晚期事件:2例复发,分别发生于36.5个月和51.0个月;1例继发恶性肿瘤(骨肉瘤),发生于51.0个月。
入组后36个月,EFS为73%(95%置信区间:61%-84%),OS为93%(95%置信区间:86%-100%)(图1)。
共有19起事件:(1)18起复发,时间为2.3至51.0个月(中位数10.2个月,仅2起超过24个月),其中8名患者因PD在入组后1.4至4.7年(中位数3.2年)死亡;(2)1名患者在入组后51.0个月发生继发性骨肉瘤。
6起复发仅限于CNS。4起较早,时间为1.5至3.5个月(1起在第二个周期后,3起在第四个周期后),2起较晚,时间为22和36.5个月;3/6名患者在复发后1.3+、4.1+和4.8+年仍存活。挽救治疗各不相同,但在所有患者中包括复发部位切除、颅脊髓照射和伊立替康-替莫唑胺。4名患者接受了omburtamab的鞘内放射免疫治疗。
其他局部复发包括4名患者在4.6至20.0个月时在单个骨部位复发,4名患者在6.0至15.0个月时在软组织复发;其中5名患者在复发后2.1+至4.4+年(中位数3.5+年)达到第二次完全缓解。另外4名患者在9.5至51.0个月时在骨骼/骨髓复发;1名患者在复发后4.0+年仍存活,1名患者在非常晚期的复发(51.0个月)后最近才开始挽救治疗。
18起复发中有4起发生在仅接受2个周期naxitamab+GM-CSF的患者中,原因是HAHA阳性或之前接受过3、5和15个周期的dimutuximab+化疗。3起复发发生在5名因HAHA阳性接受维持治疗的患者中。
入组时(pre-MRD) 57/59例患者有BM样本可供检测,第2周期免疫治疗后及异维A酸开始前(post-MRD)58/59例患者有BM样本可供检测。
pre-MRD 阳性显著关联较差的EFS(p<0.001):
4例pre-MRD(+)患者中,3例在post-MRD检测时转为阴性,但最终均复发。
仅有3例患者在post-MRD时仍为阳性,其中2例pre-MRD时为阴性,所有post-MRD(+)患者均复发。
-
诊断至Naxitamab治疗的时间越长,EFS越差(p=0.04)。
-
MYCN扩增的III期患者在24个月时的EFS趋势优于IV期(100% vs. 69%,p=0.09)。
-
不影响EFS的因素:既往原发耐药、接受2线治疗史、既往接受抗GD2单抗治疗、既往接受ASCT。
OS未进行预后分析,因事件(死亡)过少(仅8例)。
免疫治疗的急性副作用是可控制的,允许门诊治疗。naxitamab或GM-CSF的每日剂量从未减少。常见的相关毒性包括1-2级疼痛、荨麻疹、咳嗽、发热和高血压或低血压,如预期。在之前接受过dimutuximab治疗的患者中未发现异常毒性。3名患者出现短暂性1-2级Adie瞳孔(瞳孔散大、畏光、调节异常)。主要器官的毒性仅限于短暂性2-3级肝毒性(12个周期,10名患者)和短暂性神经源性膀胱(1名患者)。未发生毛细血管渗漏综合征。GM-CSF耐受性良好,无任何不良反应。4个周期因可能与方案治疗相关的毒性而中断,包括肝毒性、结肠炎、高血压和无反应。
HR-NB患者首次CR期接受naxitamab+GM-CSF治疗的36个月EFS为73%,OS为93%,结果令人鼓舞。由于大多数患者还接受了异维A酸(isotretinoin)、疫苗和/或DFMO,因此疗效不能完全归因于naxitamab+GM-CSF。与Mora等人报道的HR-NB患者相比(36个月EFS/OS: 58%/80%),本研究EFS/OS略有提高,可能与后续治疗有关。与其他抗GD2单抗治疗相比,naxitamab+GM-CSF的生存率相当或更优,且治疗方案具有门诊3天/周期的给药优势。
-
在COG ANBL0032试验中,自体干细胞移植(ASCT)后接受dimutuximab联合GM-CSF和IL-2治疗的患者,其初始队列自免疫治疗起2年无事件生存率(EFS)和总生存率(OS)分别为66%和86%,而在后续队列中分别为69%和84%。 (注:"初始队列"指的是试验开始时最早的一组患者,而"后续队列"通常是指在试验中期或后期加入的患者组。这两组患者在时间点、接受治疗的顺序或特定条件上可能有所不同,导致其结果可能具有变异,因此需要单独分析以评估不同阶段治疗的效果。)
-
在SIOPEN ENSG 5试验中(未包含GM-CSF),接受dimutuximab beta±IL-2治疗的ASCT患者,从单抗(mAb)治疗开始计算,3年EFS和OS分别为60%和70%。
-
在COG ANBL0532试验中,自体干细胞移植后接受dimutuximab联合GM-CSF和IL-2治疗的患者,根据是否接受串联(tandem)或单次ASCT,其从免疫治疗开始计算的3年EFS/OS分别为73%/84%和55%/74%。
仅诊断至naxitamab治疗时间较长与EFS较差相关(p=0.04),可能反映部分患者需要更长时间才能达到首次CR,提示不良预后。其他因素(原发耐药、二线治疗史、抗-GD2单抗免疫治疗史、ASCT)未显著影响EFS,可能受限于样本量较小。 骨髓MRD阳性显著关联疾病进展(PD) ,即使部分患者在2个周期后转阴,但最终仍复发。
HAHA阳性率为17%,与Dimutuximab的HACA率11%和20%以及Dimutuximab beta的19%和22%相近。这些抗药物抗体的预后意义仍不确定。(HACA 是“Human Anti-Chimeric Antibodies”的缩写,即人体针对嵌合抗体产生的抗体。)
18例复发中,14例为局灶性复发,5/8例非CNS局灶复发者已实现再次CR,表明局灶性复发仍有较高治愈可能。6例CNS复发(全部为孤立复发),可能归因于血脑屏障阻挡抗体进入中枢神经系统。MYCN扩增比例较高(51% vs. 26%)可能解释本研究CNS复发率高于Mora等人的研究。
CNS复发救治策略:全脑脊髓照射、鞘内放射性单抗(4例接受)及鞘内化疗均有潜力。
本研究的局限性包括患者群体的异质性、广泛的既往治疗和异维甲酸的可变使用。患者数量少和事后生物统计学分析是评估预后因素的重要缺点。50/59名患者接受试验后疫苗和/或DFMO治疗,无法确定naxitamab+GM-CSF对EFS和OS的关键问题的影响。CNS复发率高,需要努力预防这一可能归因于抗体缺乏CNS渗透的毁灭性事件。Naxitamab+GM-CSF耐受性良好,包括在门诊环境中,这支持考虑将这种免疫治疗作为帮助巩固HR-NB患者首次完全缓解的选择。
责编

制作
排版 | Sheila 校对 | uu
Purpose:Naxitamab is a humanized form of the murine anti-GD2 monoclonal antibody (mAb) 3F8. In an international trial, naxitamab+GM-CSF was effective against chemo-resistant high-risk neuroblastoma (HR-NB), leading to approval by the Food and Drug Administration. We now report results with patients in 1st complete remission (CR).
Patients and methods:The primary objective of this phase II protocol 16-1643 (Clinicaltrials.gov NCT03033303 ) was to assess event-free survival (EFS) of HR-NB patients in 1st CR treated with naxitamab+GM-CSF plus isotretinoin. HR-NB was defined as MYCN-amplified disease (any age) or metastatic disease at age >18 months. Cycles of immunotherapy were administered monthly up to 5 cycles and comprised: 1) subcutaneously-administered priming doses of GM-CSF 250µg/m2/day on days -4-to-0 (Wednesday-Sunday), followed by a step-up to 500µg/m2/day on days +1-to-+5 (Monday-Friday), and 2) naxitamab infused intravenously (30-90") on days +1, +3, and +5 (Monday-Wednesday-Friday, i.e., 3 doses/cycle). Naxitamab was 3mg/kg/infusion (9mg/kg/cycle, i.e., ~270mg/m2/cycle). Isotretinoin 160mg/m2/day started post-cycle 2, x14 days/course, x6 courses.
Results:Fifty-nine HR-NB patients (53 stage 4, 6 stage 3) were enrolled 2/2017-7/2020. At 36 months, EFS/OS were 73%/93%, but 50/59 patients received post-protocol treatment (vaccine and/or DFMO). 6/18 relapses were isolated in the central nervous system (CNS). Longer time from diagnosis to enrollment was a significantly adverse prognostic factor (p=0.04). 21/59 patients took no isotretinoin. Treatment was tolerable allowing outpatient administration.
Conclusions:Naxitamab+GM-CSF is a good option to consolidate 1st CR of HR-NB patients, including those who did not undergo ASCT. Efforts to prevent CNS relapse are warranted.
DOI: 10.1158/1078-0432.CCR-24-3427
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2025/03/17/CCR%EF%BD%9CNaxitamab%E7%94%A8%E4%BA%8E%E9%AB%98%E5%8D%B1%E7%A5%9E%E7%BB%8F%E6%AF%8D/








赶快来坐沙发