《自然》子刊:中南大学团队揭示黑色素瘤免疫治疗精准靶标
恶性黑色素瘤是一种以黑色素细胞异常增殖及代谢-免疫失稳态为重要特征的致死性皮肤疾病。尽管免疫检查点抑制剂PD-1/PD-L1单抗显著改善了部分黑色素瘤患者的生存,但其反应率仍不理想,仅有15-25%的跨多种肿瘤的患者表现出积极反应,且大约三分之一的初始应答者会复发。因此,识别预测性生物标志物和耐药机制对于提高免疫检查点阻断疗法的疗效至关重要。
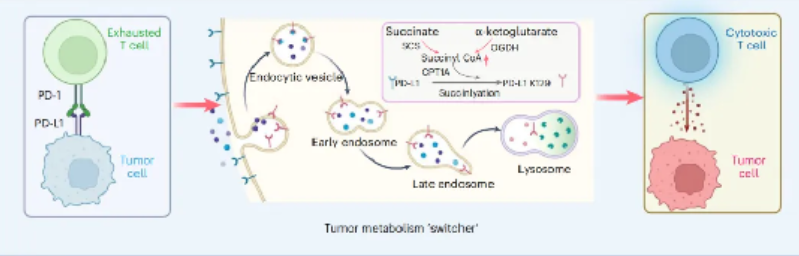
传统研究多聚焦于PD-L1的转录调控,但其蛋白稳定性的动态机制长期未明,研究表明,除了能量生产,线粒体还通过蛋白翻译后修饰(Post translational modification, PTMs),如乙酰化、丙二酰化和琥珀酰化来调节蛋白质功能。因此深入挖掘PTM机制是领域内一个重要的研究方向。此外,肿瘤代谢重编程对免疫微环境的影响逐渐成为研究热点,尤其是线粒体代谢产物(如α-酮戊二酸、琥珀酸)如何通过翻译后修饰调控免疫检查点蛋白,成为破解耐药的关键突破口。
近日,芙蓉实验室、中南大学陈翔教授、刘洪教授、刘静教授合作联合在国际顶级期刊《自然-遗传学》( Nature Genetics )杂志发表了“ Alterations in PD-L1 succinylation shape anti-tumor immune responses in melanoma ”的原创研究性论文。该研究首次揭示线粒体代谢酶CPT1A通过琥珀酰化修饰调控PD-L1蛋白降解的关键核心机制, 提出了CPT1A活化剂联合免疫治疗抗黑色素瘤的全新治疗策略,为黑色素瘤免疫治疗提供精准靶标。
通过多组学分析,研究团队揭示了琥珀酰辅酶A(succinyl-CoA)的核心调控作用。代谢干预激活PD-L1降解通路,补充α-酮戊二酸(DMK)或琥珀酸(DES)可显著提升肿瘤细胞内琥珀酰辅酶A水平,并通过溶酶体途径加速PD-L1降解。机制上,阐明了CPT1A作为琥珀酰转移酶可催化PD-L1第129位赖氨酸(K129)发生琥珀酰化修饰,诱导PD-L1经晚期内体-溶酶体途径降解。
基因编辑实验证实,K129R突变可抵抗降解,而K129E突变(模拟琥珀酰化)使PD-L1半衰期显著缩短,这一发现为破解免疫治疗耐药提供了全新视角。在临床前模型中, 研究创新性地提出了CPT1A活化剂苯扎贝特(Bezafibrate)作为免疫治疗增敏剂,有望为晚期黑色素瘤患者带来更安全、可及的联合治疗方案。
临床应用上,基于CPT1A与PD-L1的蛋白表达构建的疗效预测模型也展现出了较高的效能,为患者精准分层提供了重要理论依据。这一成果的临床转化潜力,标志着基础研究与实际医疗需求的高度融合。
本研究首次揭示了琥珀酰化修饰是PD-L1降解的重要“分子开关”,突破了传统蛋白稳定性研究的范式。CPT1A作为兼具代谢与免疫双重调控功能的关键酶,为逆转免疫治疗耐药提供了新靶点。这一发现不仅限于黑色素瘤,还可能为肺癌、结直肠癌等依赖代谢重编程的实体瘤提供普适性治疗策略;对公众健康具有深远影响,苯扎贝特作为已上市的安全药物,联合疗法有望大幅减少新药研发投入,让更多患者受益。
并且,通过饮食或代谢干预调节体内琥珀酰辅酶A水平,或成为辅助癌症治疗的新方向。例如,富含α-酮戊二酸前体的食物(如西兰花、菠菜)可能具有潜在协同效应。同期基于CPT1A开发简易筛选免疫治疗优势人群的检测工具,将更有利于推动精准医疗普及。
未来研究将进一步探索CPT1A-PD-L1调控轴在其他癌种中的普适性,并优化代谢药物与免疫疗法的联合方案。此外,团队计划推进基于CPT1A的临床检测工具研发,助力精准治疗策略的制定。
综上,这篇文章揭示了琥珀酰辅酶A通过调控PD-L1的琥珀酰化和降解,增强T细胞介导的抗肿瘤免疫反应,并提出了CPT1A作为潜在的治疗靶点和生物标志物,为黑色素瘤的免疫治疗提供了新的策略。
本文的通讯作者为芙蓉实验室、中南大学陈翔教授、刘洪教授和刘静教授,第一作者为中南大学梁龙副研究员、匡欣薇研究员与博士研究生何依。
近年来,研究团队在肿瘤免疫治疗领域发表了一系列原创性研究。如腺苷调控肿瘤PD-L1新机制(2020, Cancer Cell )、癌症免疫治疗的性别相关分子差异(2020, Nature Communications )、MMP调控肿瘤免疫新机制(2020, Genome Medicine )、Sunitinib调控肿瘤免疫治疗新机制(2020, Advanced Science )、癌症免疫治疗的免疫相关不良反应性别相关差异(2021, Journal of the National Cancer Institute )、自噬诱导剂对抗肿瘤药物的敏化作用(2022, Nature communications )、发展新型抗肿瘤免疫刺激纳米药物(2022, CHEMICAL ENGINEERING JOURNAL )、阿苯达唑增强抗肿瘤免疫的新机制(2022, Journal for immunotherapy of cancer )和节律分子RORA增强抗肿瘤免疫的新机制(2024, Cancer Research )。
该项研究也是芙蓉实验室肿瘤免疫方向近期的系列重要工作之一。芙蓉实验室长期招聘各类中青年人才/全职博士后等并提供丰厚的待遇。请有意申请者请将您的简历发送至邮箱: xyyxyyxrsb@csu.edu.cn 。
[1] Liang, L., Kuang, X., He, Y. et al. Alterations in PD-L1 succinylation shape anti-tumor immune responses in melanoma. Nat Genet 57, 680–693 (2025). https://doi.org/10.1038/s41588-025-02077-6
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2025/03/17/%E3%80%8A%E8%87%AA%E7%84%B6%E3%80%8B%E5%AD%90%E5%88%8A%EF%BC%9A%E4%B8%AD%E5%8D%97%E5%A4%A7%E5%AD%A6%E5%9B%A2%E9%98%9F%E6%8F%AD%E7%A4%BA%E9%BB%91%E8%89%B2%E7%B4%A0%E7%98%A4%E5%85%8D/
THE END






赶快来坐沙发