Mol Cancer | 免疫治疗新突破:揪出癌细胞逃避铁死亡的 “元凶”
撰文: Candy
IF= 27.7
推荐度: 
亮点:
研究首次明确脂肪酸结合蛋白 7 ( Fabp7 )在癌细胞逃避铁死亡和抗肿瘤免疫中的核心作用机制,确定了 Fabp7 是提高免疫治疗效果的潜在靶点,从脂质代谢、基因表达、表观遗传等多个层面深入探究癌细胞逃避铁死亡的机制。
癌症,这个当今社会谈之色变的健康杀手,一直是医学领域研究的重中之重。在癌症治疗的漫漫征程中,免疫治疗近年来成为备受瞩目的焦点,为攻克癌症带来了新的希望。然而,癌细胞的顽强抵抗使得免疫治疗面临诸多挑战,其中癌细胞逃避铁死亡的机制一直是科学界亟待破解的难题。
近期在《 MolecularCancer 》杂志上发表的一项重要研究 “ Cancer cells avoid ferroptosis induced by immune cells via fatty acidbinding proteins ” ,为我们揭示了这一复杂过程背后的关键因素———脂肪酸结合蛋白 7 ( FABP7 ),癌细胞通过上调脂肪酸结合蛋白 7 ( Fabp7 )逃避铁死亡和抗肿瘤免疫的机制,为提高免疫治疗效果提供潜在新靶点。
1 、免疫治疗耐药的肿瘤改变了脂质代谢谱,以避免铁死亡
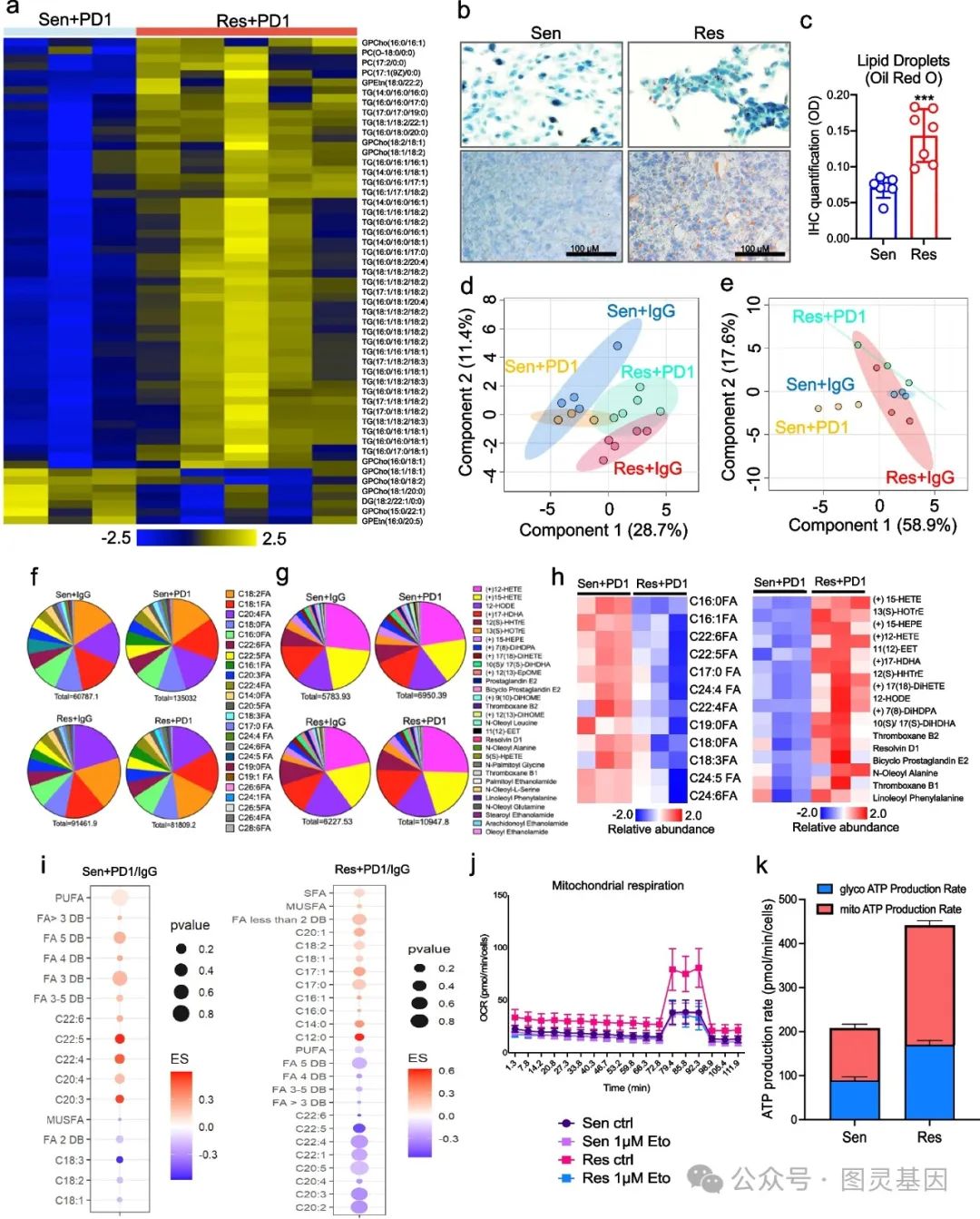
研究人员通过对 PD1 敏感和耐药肿瘤的对比研究,发现 PD1 耐药肿瘤通过改变脂质代谢谱逃避铁死亡。在脂质组学分析中,其甘油三酯水平升高,经油红 O 染色验证脂质积累增加。此外,两类肿瘤的全球脂质和脂肪酸谱差异显著, PD1 耐药肿瘤在接受抑制剂治疗后,虽总脂肪酸水平低于 PD1 敏感肿瘤,但脂肪酸代谢物水平更高,且富含更多铁死亡保护性脂质。
同时, PD1 耐药肿瘤的线粒体脂肪酸氧化增强, ATP 生成率更高。总的来说,这些表明研究结果表明, PD1 耐药性肿瘤通过增加 TGs 、 SFA 和 MUFA 的水平来重编程其代谢,同时降低 PUFA 的水平。这种重编程增强了线粒体 FAO 和 ATP 的产生,促进了铁死亡的逃避并有助于对 PD1 抑制剂的耐药性(图 1 )。
图 1. 免疫治疗耐药的肿瘤改变了脂质代谢谱以避免铁死亡
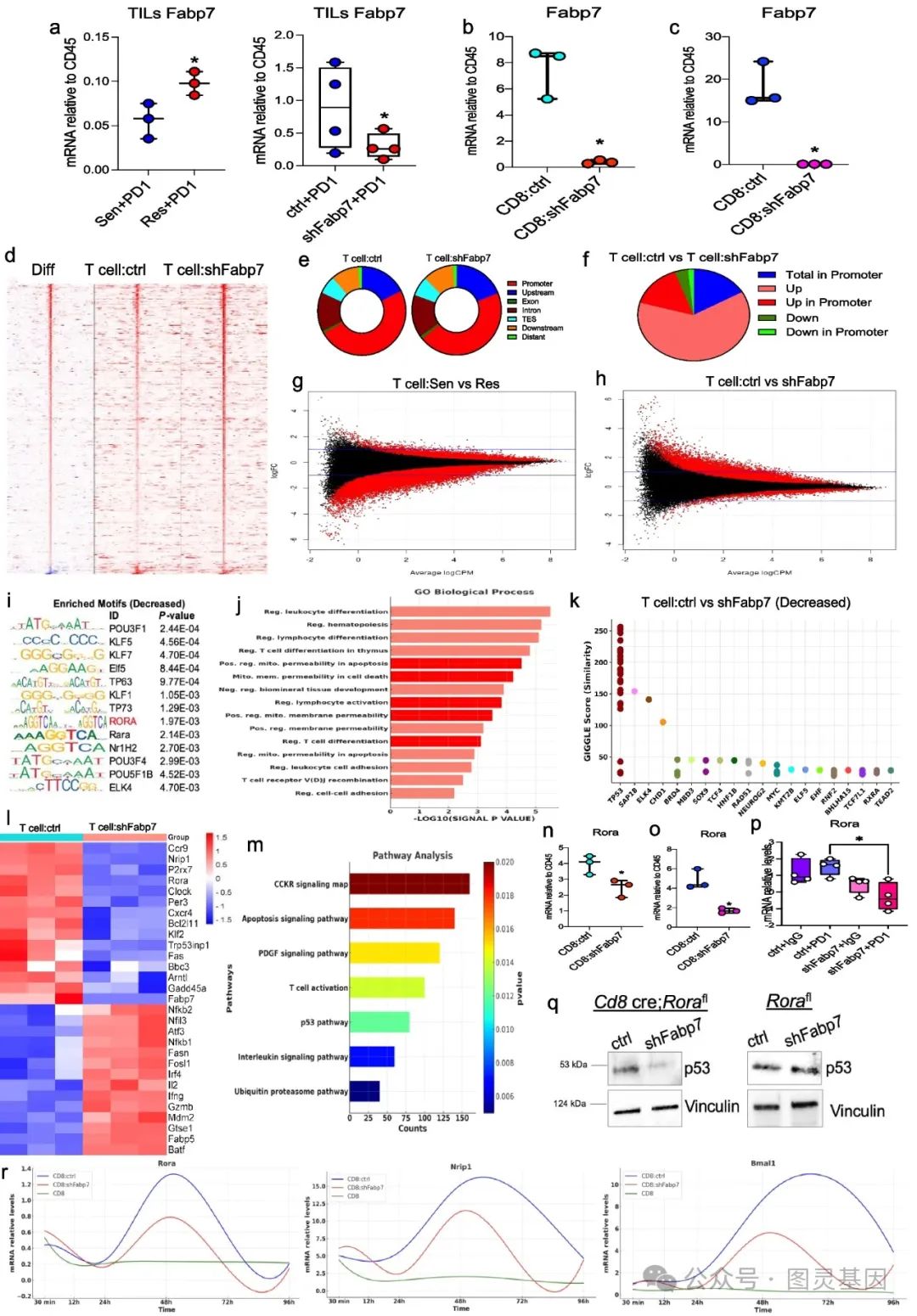
2 、免疫治疗耐药性肿瘤中的脂质伴侣 Fabp7 上调通过表观遗传重编程调节铁死亡相关基因
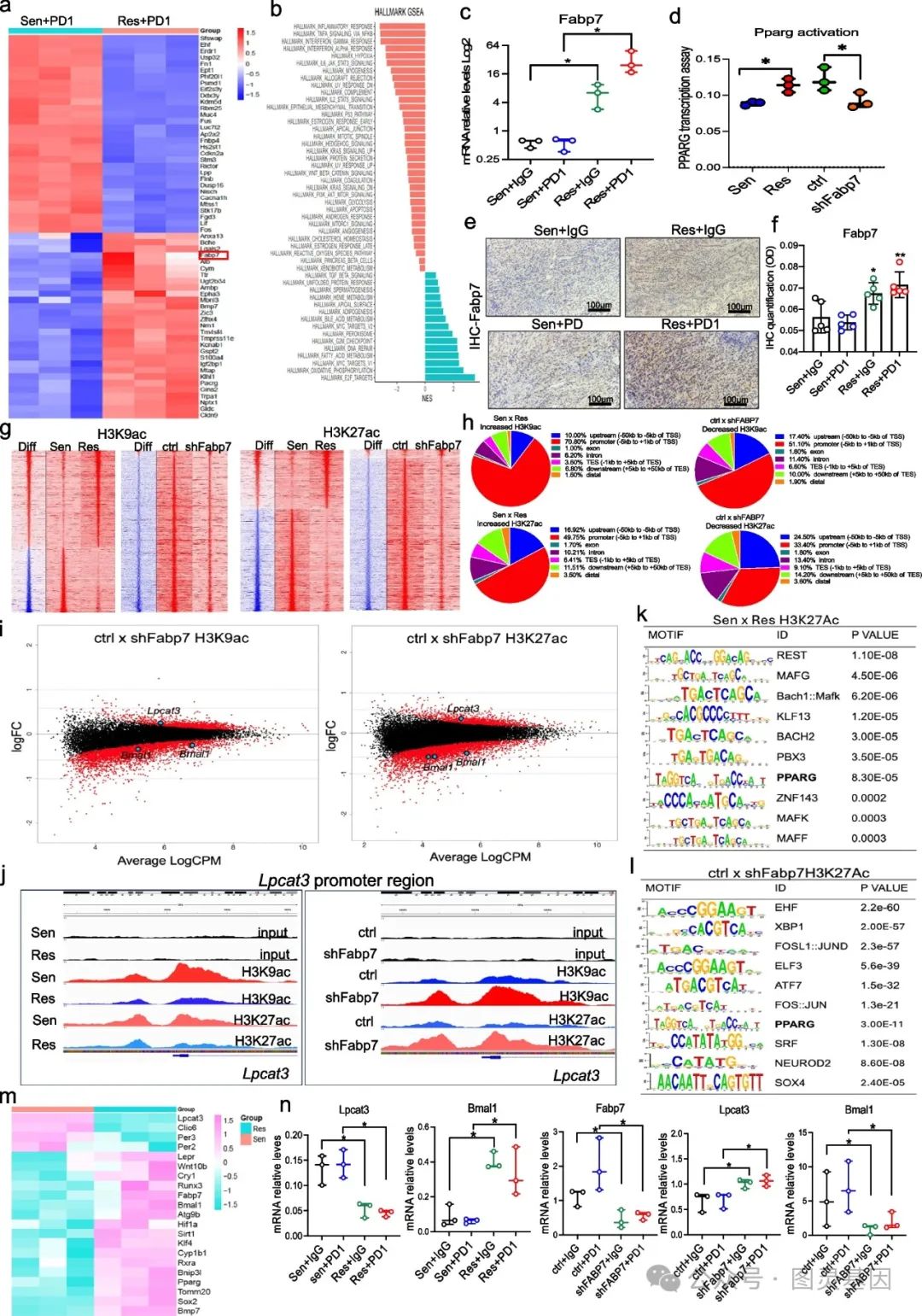
对 PD1 敏感和耐药肿瘤进行基因表达谱分析,发现 Fabp7 在耐药肿瘤中显著上调,且与脂肪酸代谢等相关通路的上调有关。通过敲低 Fabp7 实验验证其对 PPAR γ 激活的影响,利用 ChIP-seq 分析发现 Fabp7 可调节 H3K27ac 和 H3K9ac 的乙酰化模式,进而影响铁死亡相关基因 Lpcat3 和 Bmal1 的表达。
此外,通过多种实验方法,如基因表达谱分析、 qPCR 等,验证了 Fabp7 对其他相关基因的调控作用。同时,研究还发现 Fabp7 可能影响 Bmal1 在肝脏和脑组织中的表达,暗示其对机体生物钟的潜在影响。这表明 Fabp7 在耐药肿瘤中通过表观遗传重编程调节铁死亡相关基因,影响肿瘤细胞的生存和死亡。
图 2. 脂质伴侣 FABP7 通过表观遗传重编程保护肿瘤免受免疫治疗介导的铁死亡
3 、 Fabp7 改变脂质组成和线粒体功能,以保护免疫治疗耐药性肿瘤免受铁死亡
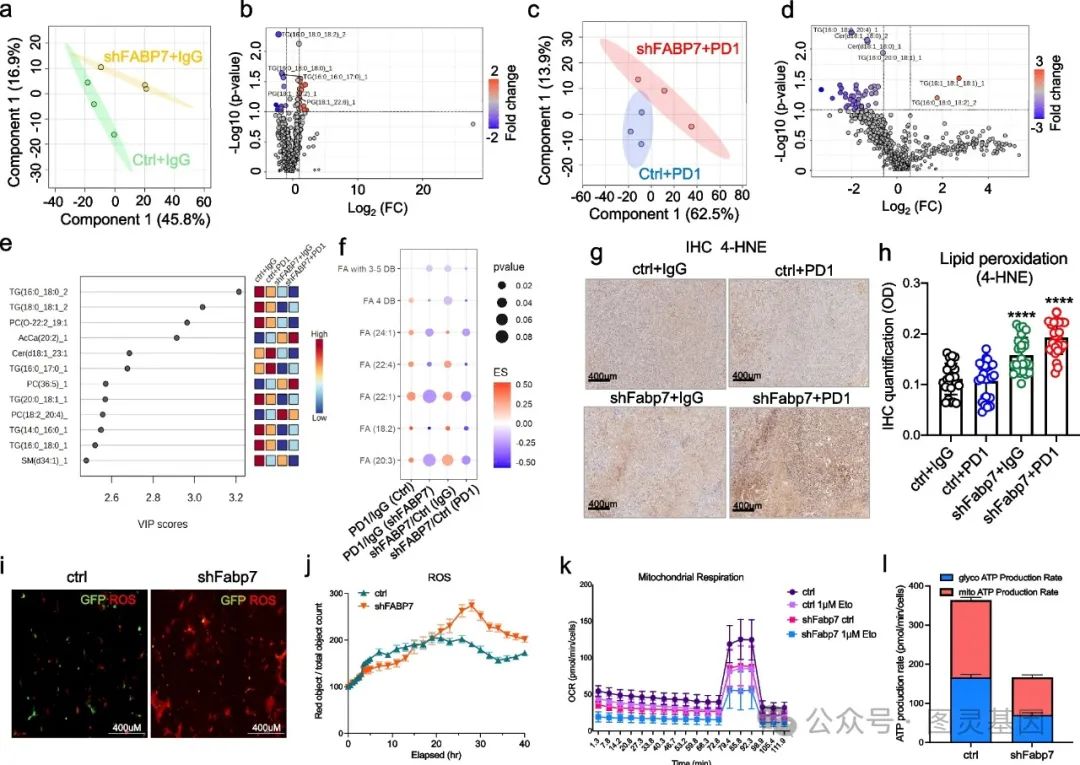
对 Res-ctrl 和 Res-shFabp7 肿瘤进行脂质组学分析,发现敲低 Fabp7 后,肿瘤内甘油三酯和单不饱和脂肪酸(如 FA24:1 、 FA 22:1 )水平降低,脂质过氧化增加,通过 4-HNE 免疫组化染色得以证实。同时, Res-shFabp7 肿瘤的线粒体相关脂质和结构变化,且其 ROS 水平升高,线粒体功能和 FAO 受影响, ATP 生成减少。此外,研究还发现 Fabp7 对肿瘤细胞的自噬和线粒体自噬有潜在影响。
研究结果表明, Fabp7 通过改变脂质组成和改善线粒体功能来保护 PD1 耐药肿瘤免受铁死亡,从而降低对铁死亡的敏感性。这些变化以 TGs 、 MUFA 和特异性脂肪酸的增加,加上 ROS 水平和脂质过氧化降低为突出表现,强调了 Fabp7 在癌细胞存活中的作用,并表明其作为增强免疫治疗疗效的靶点的潜力。
图 3. Fabp7 改变脂质组成和线粒体功能,以保护免疫治疗耐药性肿瘤免受铁死亡
4 、癌细胞上调 Fabp7 以破坏生物钟基因并促进 CD8 + T 细胞凋亡
研究发现肿瘤浸润淋巴细胞( TILs )中 Fabp7 表达在 PD1 耐药肿瘤中高于敏感肿瘤,且在与敲低 Fabp7 的癌细胞共培养的 CD8+T 细胞中表达降低,同时肿瘤细胞分泌的 Fabp7 可能影响 TILs 中 Fabp7 的表达。通过 ATAC-seq 和 RNA-seq 分析,发现 Fabp7 影响 CD8+T 细胞的基因表达和转录因子活性,导致与凋亡相关的基因和通路变化,如 Rora 和时钟调节基因的下调。
进一步研究证实 Fabp7 通过 Rora-p53 轴促进 CD8+T 细胞凋亡,且其与 Rora 存在相互作用,影响 CD8+T 细胞中昼夜节律基因的表达模式。这些表明癌细胞通过上调 Fabp7 扰乱 CD8+T 细胞的昼夜节律基因表达,促进其凋亡,从而营造免疫抑制的肿瘤微环境。。
图 4. 癌细胞上调 Fabp7 以破坏昼夜节律时钟基因并促进 CD8+ T 细胞凋亡
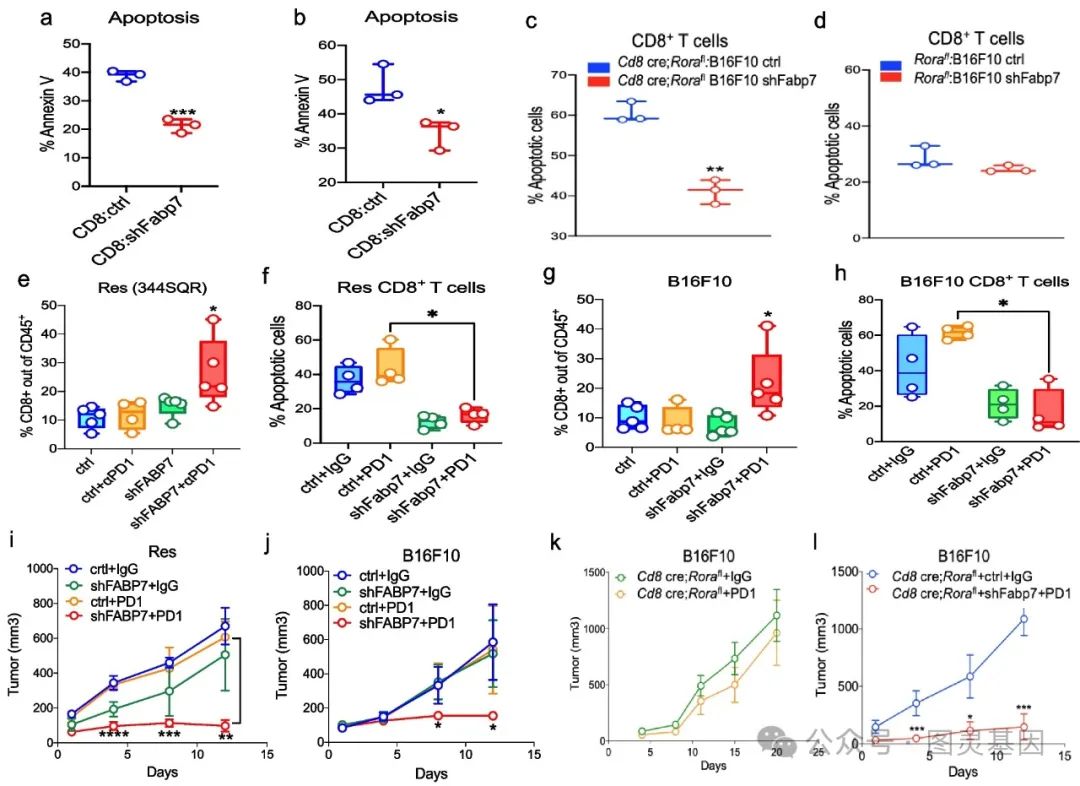
5 、敲低 FABP7 可恢复耐药性肿瘤对免疫治疗的敏感性
在体内实验中,将敲低 Fabp7 的癌细胞( Res-shFabp7 或 B16F10-shFabp7 )接种到小鼠体内,用 PD1 抑制剂处理后,发现肿瘤内 CD8+T 细胞浸润增加,凋亡减少。同时,敲低 Fabp7 使耐药肿瘤对免疫治疗的敏感性增强,肿瘤生长受到抑制,该结果在两种独立的小鼠模型( 129Ev 和 B16F10 )中得到验证。
此外,实验表明 Rora 单独存在时对 PD1 抑制反应无显著影响,而 Fabp7 敲低是肿瘤对 PD1 治疗产生反应的必要条件。这说明敲低 FABP7 可恢复耐药肿瘤对免疫治疗的敏感性,为提高免疫治疗效果提供了潜在的靶点。
图 5. 敲低 FABP7 可恢复耐药性肿瘤对免疫治疗的敏感性
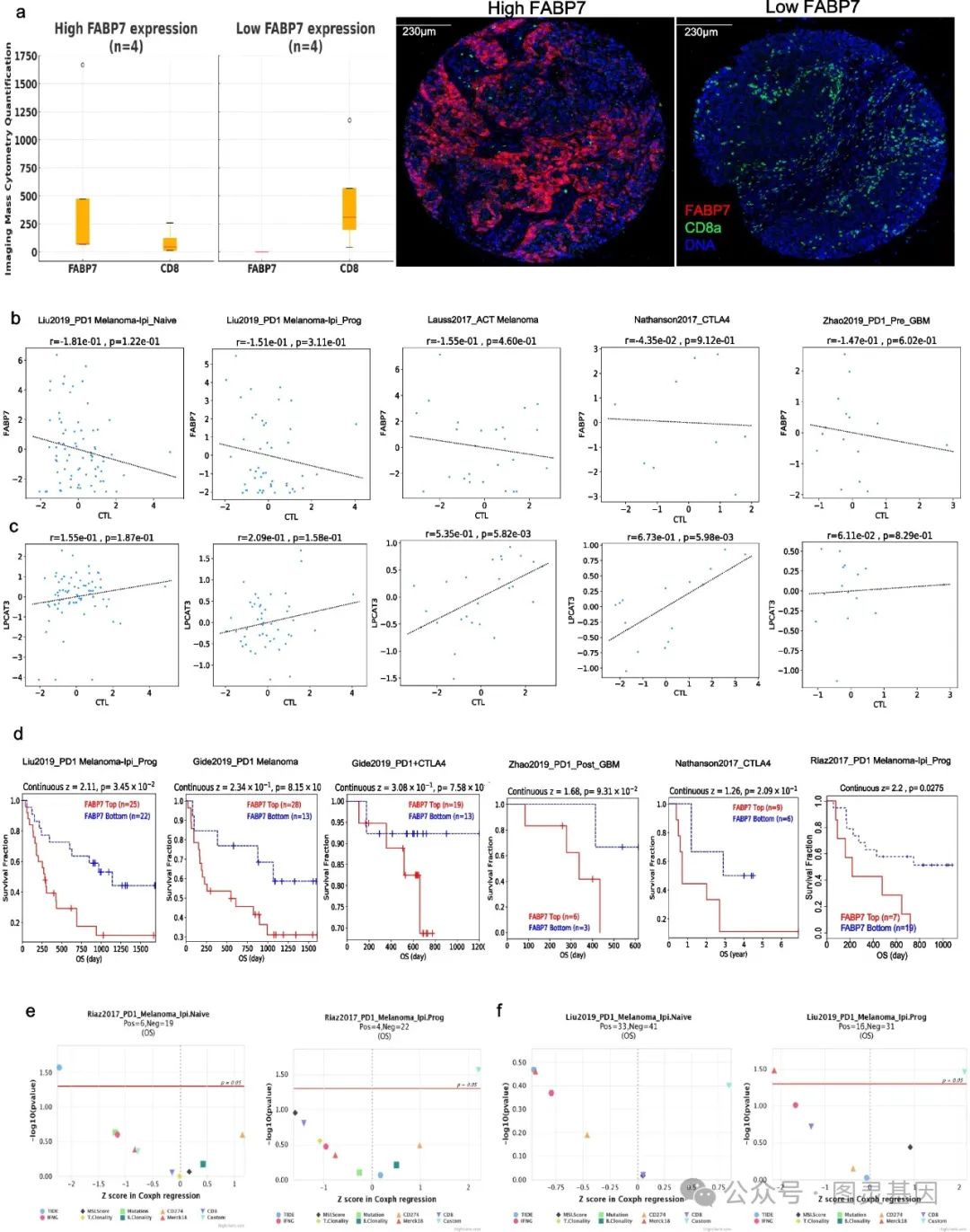
6 、 FABP7 表达与免疫治疗患者的 CD8 T 细胞浸润和患者预后相关
通过对黑色素瘤患者的 ImagingMass Cytometry 分析,发现 FABP7 高表达的肿瘤组织中 CD8 T 细胞浸润较少,低表达则浸润较多。利用 TIDE 模块分析更大队列患者数据,证实 FABP7 表达与 CD8 T 细胞浸润呈负相关,与 LPCAT3 表达呈正相关。
同时, FABP7 高表达患者的总生存期和无进展生存期较短,且 FABP7 表达可作为免疫治疗反应的重要预测指标,与其他已建立的生物标志物相当。这表明 FABP7 表达与免疫治疗患者的免疫细胞浸润和生存结果密切相关,可作为潜在的生物标志物。
图 6. FABP7 表达与免疫治疗患者的 CD8 T 细胞浸润和患者预后相关
该研究揭示癌细胞通过上调 Fabp7 逃避免疫介导的铁死亡,该蛋白重塑脂质代谢、扰乱免疫细胞昼夜节律调节。靶向 Fabp7 有望增强免疫治疗效果,为癌症治疗提供新策略,但目前针对 Fabp7 的小分子药物存在靶向选择性问题,开发高特异性小分子药物是未来方向。
教授介绍
James W. Welsh ,就职于德克萨斯大学 MD 安德森癌症中心放射肿瘤学系。在放射肿瘤学和癌症免疫治疗领域,他有着丰富的研究经验,致力于寻找提高癌症治疗效果的新方法。研究领域包括但不限于免疫放射学,涉及多个方面,如运行了许多抗 CTL A-4 和抗 PD1 与辐射的首次试验,以及免疫治疗与辐射的临床前模型测试等。
参考文献
Freitas-Cortez,M. A., Masrorpour, F., Jiang, H., Mahmud, I., Lu, Y., Huang, A., Duong, L. K.,Wang, Q., Voss, T. A., Kettlun Leyton, C. S., Wei, B., Chan, W. K., Lin, K.,Zhang, J., Tsouko, E., Ganjoo, S., Barsoumian, H. B., Riad, T. S., Hu, Y.,Leuschner, C., … Welsh, J. W. (2025). Cancer cells avoid ferroptosis induced by immunecells via fatty acid binding proteins. Molecular cancer, 24(1), 40.
链接:http://www.lewenyixue.com/2025/03/12/Mol%20Cancer%20%7C%20%E5%85%8D%E7%96%AB%E6%B2%BB%E7%96%97%E6%96%B0%E7%AA%81%E7%A0%B4/







赶快来坐沙发