双抗ADC药物:抗癌治疗的下一次革命?
导读
抗体偶联药物( ADC )被称为 “ 魔法子弹 ” ,通过抗体精准靶向肿瘤细胞,递送细胞毒性药物,兼具靶向治疗的精准性和化疗的强效杀伤力。在过去的十年里, ADC 在治疗实体瘤和血液肿瘤方面逐渐成熟,成为抗肿瘤药物研究的一个革命性领域。
虽然 ADC 的发展取得了显著的成功,但意外毒性和耐药性的出现带来了巨大的挑战。而双抗 ADC ( BsADC )作为 ADC 的升级形态,结合了双抗与 ADC 的双重优势,成为肿瘤治疗领域最具潜力的新方向。其核心在于 “ 双靶点 ” 或 “ 双表位 ” 设计,可同时阻断两条信号通路、增强肿瘤特异性、克服耐药性,而且还显著改善内化,并减少对正常细胞的误伤。这些独特的优势使 BsADC 成为下一代 ADC 领域的一支重要力量。
- 02 -
双抗ADC: 为何“1+1>2”?
传统 ADC 仅靶向单一抗原,但肿瘤的高度异质性常导致靶点表达不足或突变逃逸。双抗 ADC 通过同时靶向两种抗原或同一抗原的两个表位,构建起双重防线:
精准靶向,减少脱靶毒性
双抗 ADC 可同时结合同一抗原的两个表位(如 HER2 双表位)或两个不同靶点(如 EGFR/HER3 ),大幅提升对肿瘤细胞的识别特异性。例如, HER2 双抗 ADC 能通过双表位结合促进受体聚集和内吞,减少因单靶点表达不足导致的脱靶风险。
双重阻断,克服耐药难题
肿瘤细胞的异质性和动态进化常导致单靶点药物失效。双抗 ADC 通过同时抑制两条驱动信号通路(如 EGFR 和 HER3 ),可延缓甚至逆转耐药性产生。
协同增效,增强内吞效率
双抗的 “ 交联效应 ” 能加速抗体 - 抗原复合物的内吞,提升毒素进入肿瘤细胞的效率。研究表明,双抗 ADC 的内吞速率是单抗 ADC 的 2-3 倍,显著增强杀伤效果。
拓宽治疗窗口,优化安全性
通过双靶向机制,双抗 ADC 可在降低毒素用量的同时维持疗效,减少对正常组织的损伤。例如,百利天恒的 BL-B01D1 ( EGFR/HER3 双抗 ADC )在临床前研究中显示出更优的安全性窗口。
- 03 -
双抗ADC设计:精巧的“分子工程”
目前已知 BsADC 的靶点主要集中在 HER2 、 EGFR 和 c-MET 上。 ADC 的各个成分,包括抗体、连接子和有效载荷都需要独立的优化,对这些关键成分中的任何一个进行微小的修改都会导致临床特征的实质性改变。因此,在设计未来的 BsADCs 时,抗体、连接子 - 有效载荷复合物的优化和偶联策略应被视为相互连接的网络,需要一种整体的方法。
双特异性抗体
构建 BsADCs 的首要考虑因素在于明智地选择合适的靶标组合。靶点选择是 ADC 成功开发的基本前提,对最终治疗窗口和全身毒性产生关键影响。鉴于传统 ADC 面临的普遍脱靶毒性和临床耐药性的挑战,以下标准有助于指导靶点选择:
优先选择协同作用的靶点组合 :例如 EGFR/c-MET 可共同抑制耐药通路, MUC1/EGFR 则利用前者高表达特性增强肿瘤靶向性。
结构优化 :如 ZW49 采用二价 HER2 结合,增强受体聚集效应; AZD9592 ( EGFR/c-MET )使用 Fab-scFv 融合结构,平衡两个靶点的亲和力差异,减少 EGFR 正常组织毒性。
连接子
BsADCs 中的连接子是抗体和细胞毒性有效载荷之间的关键连接,在有效载荷释放和药物稳定性中发挥着至关重要的作用。理想的连接子应在血浆中表现出稳定性,同时促进肿瘤中的有效释放。目前, ADC 中的连接子可分为可裂解和不可裂解连接子。可裂解 linker (如 Val-Cit )依赖肿瘤微环境中的蛋白酶活化,减少系统性毒性;不可裂解 linker 依赖抗体在溶酶体中的完全降解,安全性更高。
有效载荷
细胞毒性有效载荷在很大程度上决定了整体抗肿瘤效果和潜在的不良反应。考虑到 ADC 的低渗透性, ADC 的理想有效载荷需要在纳摩尔至皮摩尔水平上表现出高药效。此外,这些有效载荷应具有足够的血浆稳定性、低免疫原性和适当的水溶性。最后,有效载荷应具有与抗体偶联的可用基团。
BsADCs 中有效载荷的旁观者杀伤效应是一个值得讨论的关键方面。对于 ADC 的 PK/PD 特性来说,这是一把双刃剑。虽然旁观者杀伤效应可以提高 ADC 在异质性肿瘤环境中的整体疗效,但它也会在肿瘤周围的正常组织中造成脱靶杀伤的风险。这种效应依赖于可裂解的连接子和疏水性有效载荷。如果其中一种靶抗原在正常组织(如 c-Met )中具有一定水平的表达, BsADCs 应避免施加具有旁观者效应的有效载荷。
此外,新型药物有效载荷对 BsADC 的开发至关重要。新出现的有效载荷,如 PROTAC 、铁死亡诱导物、寡核苷酸等,有助于 BsADC 领域药物选择的扩展。新药的开发可以显著丰富 BsADCs 领域的选择性药物类型。
- 04 -
研发现状:全球竞争格局大透视
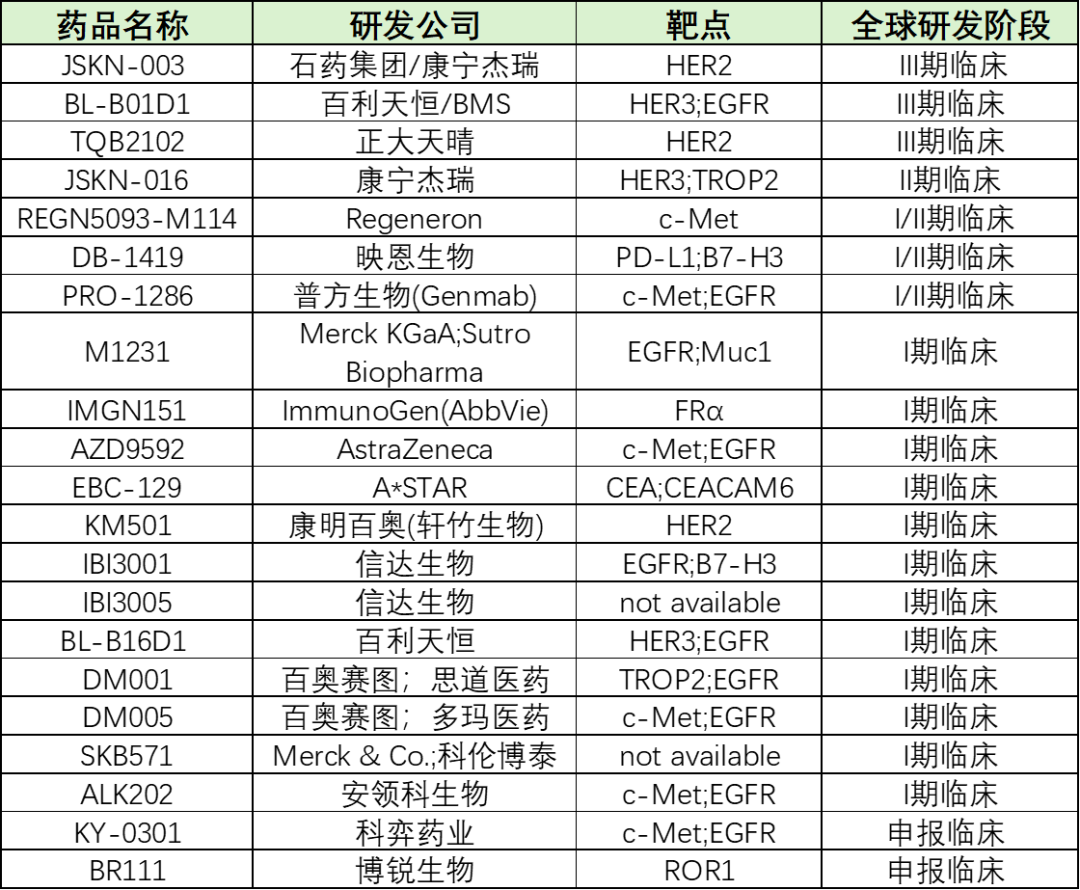
根据医药魔方数据库,全球进入临床阶段的双抗 ADC 有 19 款,其中只有 3 款处于临床 III 期, 1 款处于临床 II 期, 4 款进度领先的双抗 ADC 均为国产创新药,包括百利天恒和 BMS 合作的 BL-B01D1 、康宁杰瑞和石药集团合作的 JSKN-003 、正大天晴的 TQB2102 以及康宁杰瑞的 JSKN-016 ,表明国产创新药在双抗 ADC 药物领域全球领先地位。其中,百利天恒和 BMS 合作的 BL-B01D1 研发进度领先,国内 7 个注册临床同步推进, 4 项适应症纳入突破性治疗品种名单。 BL-B01D1 海外临床试验也在顺利推进, 2025 年有望进入 III 期注册临床阶段。
- 05 -
挑战与未来:解决技术瓶颈,向“智能药物”进化
BsADC 代表了一种融合 ADC 和 BsAbs 优势的新型治疗类别。然而,其面临的挑战依然存在,主要归因于实体瘤的复杂性,包括异质性、组织学障碍和渗透性差等。必须完善 BsADC 的设计策略以克服这些挑战。
拓宽抗体骨架 : BsADCs 目前的靶点选择仍然有些有限,主要集中在 HER2 、 c-MET 和 EGFR 上。然而,双特异性策略有可能扩大靶点的范围,包括那些内化不良或低表达的靶点。
清除不均匀的偶联 : 通过基于官能团的有效载荷的随机化学耦合来构建 BsADCs 具有异质偶联的风险。这种异质性可能会破坏双特异性结合模式,并改变 BsADCs 的物理和 PK 特性。位点特异性结合策略可以产生具有均匀 DAR 的 BsADCs ,同质 DAR 不仅提高了药物递送的准确性,还确保了治疗反应的一致性,使其成为 BsADCs 设计和开发的关键考虑因素。
明确两个靶标之间的参数 : BsADCs 的多价结合模式和参数施加了相互的限制和依赖性。两个目标之间的设计考虑需要仔细检查,特别是在亲和力大小、表达和价态的变化方面。解决这些关键点需要全面筛选具有不同亲和力的结合臂的组合,以实现最佳的生物活性。
转运 : BsAbs 可以通过将 BsAb 的初始特异性仅作为第二种特异性的转运模式的方法进行导航。一个例子是 BsAb 平台利用低亲和力转铁蛋白受体携带β - 分泌酶抗体,促进有效通过血脑屏障。已经报道了靶向 CD63 、 PRLR 和 APLP2 的 BsADCs 显示出辅助转运的能力。
解决潜在的安全问题 :虽然 BsADCs 致力于增强特异性,从而减轻脱靶毒性和副作用,但以 ZW49 、 MEDI4276 和 BL-B01D1 为例的早期临床数据表明,其临床安全性不如预期。脱靶毒性是 ADC 相关毒性的主要特征。然而,仅仅依靠 BsAbs 可能无法充分解决减少脱靶毒性。除了抗体创新之外,围绕连接子 - 有效载荷复合物的关键研究也是必不可少的,包括连接子稳定性、同质偶联策略、 DAR 和旁观者杀伤效应的考虑。
- 06 -
结语:中国力量引领双抗ADC新时代
参考文献:
1. Bispecific antibody drug conjugates: Making 1+1>2. Acta Pharmaceutica Sinica B. 20 January 2024
链接:http://www.lewenyixue.com/2025/03/11/%E5%8F%8C%E6%8A%97ADC%E8%8D%AF%E7%89%A9%EF%BC%9A%E6%8A%97%E7%99%8C%E6%B2%BB%E7%96%97%E7%9A%84%E4%B8%8B%E4%B8%80%E6%AC%A1%E9%9D%A9%E5%91%BD%EF%BC%9F/