Nature子刊:惊人反转!限制天冬酰胺,CD8+T细胞抗癌能力飙升40%+
复发转移性鼻咽癌(RM-NPC)始终是一道难以逾越的关卡。PD-1单抗的单药治疗效果不佳,客观反应率低,患者在经历一线治疗后仍面临高复发率的困境。如何突破肿瘤微环境的重重阻碍,唤醒T细胞的抗肿瘤潜力?
01▼免疫治疗的“瓶颈”与天冬酰胺的“新钥匙”
尽管免疫检查点抑制剂(ICIs)为多种实体瘤带来了突破性进展,但在复发转移性鼻咽癌(RM-NPC)患者中,PD-1单抗的单药治疗效果并不理想。研究表明,RM-NPC患者对PD-1单抗的客观反应率仅为10%~20%,且多数患者在治疗后仍出现疾病进展。这种局限性主要源于RM-NPC复杂的肿瘤微环境,其特征为免疫抑制细胞的浸润、T细胞浸润受限以及免疫检查点信号的过度激活。此外,RM-NPC的治疗还受到肿瘤细胞代谢重编程的阻碍,这使得T细胞在肿瘤微环境中难以维持持续的抗肿瘤活性。
RM-NPC患者通常在经历一线化疗、放疗或免疫治疗后,仍面临疾病复发和转移的风险。目前的治疗策略,包括含铂化疗方案和免疫检查点抑制剂的联合应用,虽然在一定程度上提高了患者的生存率,但整体疗效仍不尽如人意。既往研究表明,天冬酰胺剥夺能够通过代谢重编程增强T细胞的效应功能,然而对实体瘤中的疗效未知。
2025年3月,中国台湾长庚大学医学院杨皇煜博士团队与瑞士洛桑大学合作,共同在Nature Metabolism杂志发表了一篇题为“Asparagine deprivation enhances T cell antitumour response in patients via ROS-mediated metabolic and signal adaptations”的研究,聚焦于天冬酰胺限制对T细胞抗肿瘤活性的影响,提出了一个创新的治疗思路,探讨了天冬酰胺限制联合免疫检查点抑制剂在RM-NPC中的潜在价值。
02▼临床与基础研究的“双轨并行”
本研究采用单中心、前瞻性同情使用研究设计,纳入9例复发转移性鼻咽癌患者,这些患者既往接受过标准治疗且病情仍进展。研究分为两个阶段,首先对患者使用L-天冬酰胺酶,随后序贯给予帕博利珠单抗治疗。对照组则仅接受帕博利珠单抗单药治疗。
研究的主要终点为无进展生存期和客观反应率,次要终点包括生物标志物变化、毒副反应等。同时,研究还通过小鼠模型进一步探讨天冬酰胺限制对T细胞抗肿瘤效应的机制,包括B16-OVA肿瘤模型联合OT-1 T细胞过继治疗实验,以及B16-F10和MTCQ1肿瘤模型的联合治疗实验。
03▼天冬酰胺限制为CD8+T细胞“加油”,增强抗肿瘤“战斗力”
天冬酰胺限制增强CD8⁺T细胞的效应功能研究发现,天冬酰胺限制显著提升了CD8⁺T细胞的效应功能。在体外实验中,天冬酰胺剥夺条件下培养的CD8⁺T细胞,其IFNγ和颗粒酶B的表达水平显著提高,与对照组相比,IFNγ+GzmB+ T细胞比例从18.1%提升至44.1%(P<0.0001,图1)。此外,在人CD8⁺T细胞中也观察到类似结果,表明天冬酰胺限制能够直接激活CD8⁺T细胞,增强其杀伤肿瘤细胞的能力。
图1 在天冬酰胺限制和对照条件下培养的CD8⁺T细胞中加入20 mM NAC(N-乙酰半胱氨酸)3天后,通过流式细胞术检测IFNγ和颗粒酶B的表达
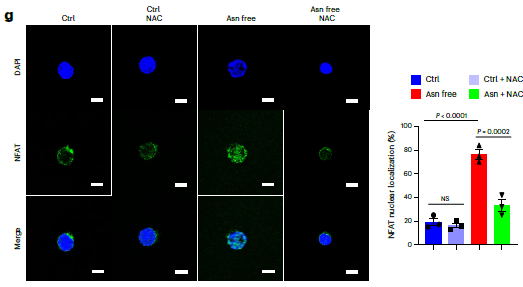
天冬酰胺限制通过ROS-NFAT信号通路重塑T细胞代谢研究进一步揭示了天冬酰胺限制的作用机制。天冬酰胺限制诱导T细胞内活性氧(ROS)水平上升,激活NFAT信号通路,促进NFAT的核转位(P<0.0001,图2)。ROS的增加并非简单的氧化应激,而是作为一种信号分子,推动NFAT进入细胞核,进而上调IFNγ和颗粒酶B等效应分子的表达。此外,天冬酰胺限制还增强了T细胞的线粒体代谢,表现为线粒体生物合成相关基因(如Tfb1m、Polrmt和Tfam)表达水平的显著上调(P<0.05),为T细胞的持续激活提供了能量支持。
图2 通过共聚焦显微镜成像检测NFAT定位(绿色)和DAPI(蓝色)染色的CD8⁺T细胞
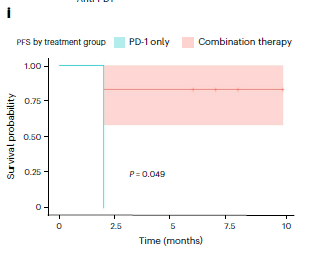
天冬酰胺限制与抗PD-1联合治疗显著改善临床预后在临床应用中,天冬酰胺限制联合抗PD-1治疗取得了显著的疗效。研究纳入6例复发转移性鼻咽癌患者,结果显示,联合治疗组的中位无进展生存期(PFS)为9.8个月,显著长于对照组的3.2个月(P=0.049,图3)。联合治疗组的客观反应率(ORR)为50%,而对照组为0%。具体而言,联合治疗组中3例患者达到部分缓解,3例病情稳定,而对照组患者均出现疾病进展。
图3 按治疗组别划分的无进展生存率(PFS)
天冬酰胺限制调节肿瘤微环境代谢,增强免疫治疗效果代谢组学分析显示,天冬酰胺限制显著改变了肿瘤微环境中的代谢物组成。治疗后,患者血清中的天冬酰胺和谷氨酰胺水平显著降低,而天冬氨酸和谷氨酸水平显著增加(图4)。这种代谢物的变化不仅为T细胞的代谢重编程提供了支持,还增强了免疫治疗的效果。在小鼠模型中,联合治疗组的肿瘤微环境中IFNγ和颗粒酶B的表达水平显著提高,表明天冬酰胺限制通过调节肿瘤微环境代谢,为T细胞的激活和抗肿瘤作用提供了更有利的条件。
天冬酰胺限制诱导的代谢适应性增强T细胞的抗肿瘤功能研究还发现,天冬酰胺限制诱导的代谢适应性在增强T细胞抗肿瘤功能中发挥了重要作用。长期培养的CD8⁺T细胞在天冬酰胺限制条件下,表现出更强的效应功能。这种适应性反应包括线粒体代谢的增强、ROS水平的上调以及抗氧化反应的激活。这些变化使得T细胞在天冬酰胺限制的条件下能够更好地应对肿瘤微环境中的代谢压力,从而更有效地发挥抗肿瘤作用。
04▼总结
本文创新性地揭示了天冬酰胺限制在增强CD8+T细胞抗肿瘤活性中的关键作用,为实体瘤治疗提供了新的思路和潜在的联合治疗策略。其临床前和临床研究结果均表明,天冬酰胺限制与免疫检查点抑制剂的联合应用具有显著的协同抗肿瘤效应,有望改善复发转移性鼻咽癌等实体瘤患者的预后。这一发现不仅丰富了肿瘤免疫治疗的理论基础,也为开发更有效的免疫治疗方案提供了重要参考。
参考文献
CHANG HC, TSAI CY, HSU CL, et al. Asparagine deprivation enhances T cell antitumour response in patients via ROS-mediated metabolic and signal adaptations[J]. Nat Metab. [2025-3-5]. DOI: 10.1038/s42255-025-01245-6.
“医学论坛网”发布医学领域研究成果和解读,供专业人员科研参考,不作为诊疗标准,使用需根据具体情况评估。
链接:http://www.lewenyixue.com/2025/03/10/Nature%E5%AD%90%E5%88%8A%EF%BC%9A%E6%83%8A%E4%BA%BA%E5%8F%8D%E8%BD%AC%EF%BC%81%E9%99%90%E5%88%B6%E5%A4%A9%E5%86%AC%E9%85%B0%E8%83%BA/






赶快来坐沙发