【CACA前沿周刊】87期 难以置信!清除肿瘤的主力军并不总是T细胞?
本期看点
序言
不管是初高中时代的生物课本还是大学里的免疫学教材,亦或是声名鹊起的免疫检查点抑制剂、CAR-T细胞疗法,都在潜移默化地为我们灌输着“T细胞是清除肿瘤的主力军”这一概念。
似乎T细胞就是那个站在舞台中央,被聚光灯照耀着的主角。
在T细胞为主角的故事里,剧情是这样的:
凋亡或坏死的肿瘤细胞释放抗原,被抗原呈递细胞(如巨噬细胞、树突状细胞等,其中树突状细胞尤为重要)摄取并加工后提呈给CD4 + T细胞或CD8 + T细胞,使这两类T细胞活化并增殖。当肿瘤细胞不表达或低表达共刺激分子时,CD8 + T细胞还需要活化的CD4 + Th辅助激活为CTL。
激活后的CTL主要通过穿孔素-颗粒酶途径和Fas-FasL途径对肿瘤细胞进行杀伤。
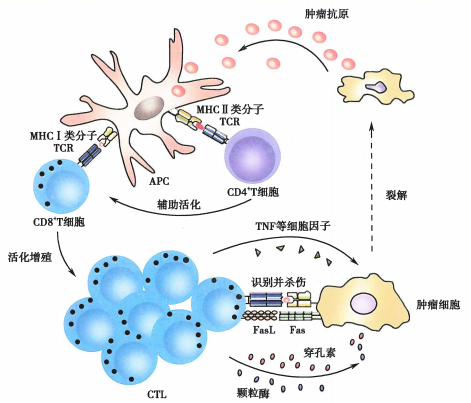
其他的免疫细胞如NK细胞、巨噬细胞、树突状细胞、肥大细胞等与T细胞的关系像是绿叶衬红花。
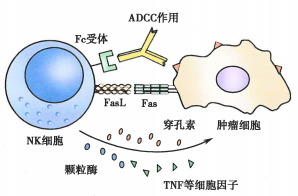
NK细胞虽然没有特异性但可以通过抗体依赖性的细胞介导的细胞毒作用(ADCC)、Fas-FasL途径、穿孔素-颗粒酶途径以及释放TNF等细胞因子等方式杀伤肿瘤细胞。
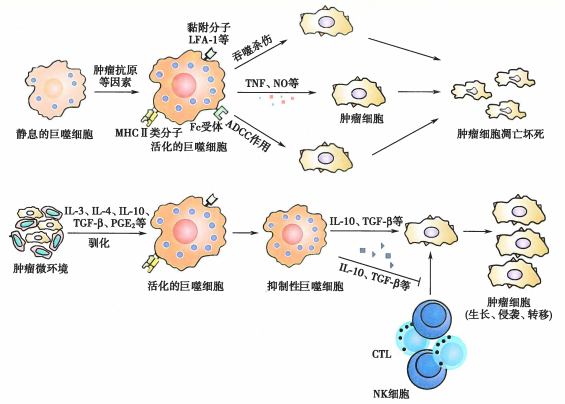
对于巨噬细胞,既往研究更关注它们的双重作用。一方面,巨噬细胞作为专职抗原呈递细胞通过提呈肿瘤抗原诱导特异性抗肿瘤免疫应答,活化后可非特异性吞噬或通过ADCC杀伤肿瘤细胞,同时还可以分泌TNF、NO等细胞毒性因子间接杀伤肿瘤细胞。另一方面,被肿瘤细胞“驯化”的肿瘤相关巨噬细胞又发挥着免疫抑制的作用,为肿瘤的生长培育温床。
在T细胞的主角光环照耀下,许多以T细胞为核心的疗法诸如CAR-T、TILs疗法及免疫检查点阻断疗法迅速发展,在血液肿瘤中取得了良好的战绩。
随着细胞疗法向实体瘤进军,CAR-T的短板愈发凸显。截至2024年6月,ClinicalTrials.gov数据显示,针对实体瘤的CAR-T细胞临床试验总数为405项,状态各不相同,但多数结果不佳。
尽管CAR-T在实体瘤中显示出一定的活性迹象,但迄今为止的临床试验结果依旧令人失望,没有观察到持续高的持久反应率。在经历了四代更新后的CAR-T,依然难以跨越实体瘤这座大山。
“追不到的梦想换个梦不就得了”,一部分研究者将目光投向了CAR-NK、CAR-NKT、CAR-M等一系列新型细胞疗法。
CAR-NK的研究开始较早,尽管也获得了一些积极数据,但外周血来源的CAR-NK依然面临着浸润困难、寿命短、不持久等挑战。在肿瘤微环境的缺氧和可溶性抑制因子的损害下,CAR-NK往往一蹶不振,转化为功能失调的亚型。
实体瘤的肿瘤微环境像一座固若金汤的碉楼,拦住了过继细胞们前进的脚步。
不过,其他细胞进不去的地方,巨噬细胞却可以渗透进去。
2021年,靶向HER2的CAR-M疗法CT-0508完成了第一例患者给药。这是CAR-M的一小步,却是细胞疗法征服实体瘤的一大步。初步数据显示,该疗法安全性良好,没有剂量相关的毒性。
除此之外,治疗卵巢癌和腹膜间皮瘤的MCY-M11、治疗CD5阳性外周T细胞淋巴瘤的MT-101正在临床研究中,而治疗肝癌的CAR-iMAC以及北京协和靶向c-Met治疗胰腺癌的CAR-M正在临床前试验阶段。
这些研究证明了巨噬细胞治疗肿瘤的巨大潜力,这似乎有点颠覆我们的认知。难道我们需要重新审视巨噬细胞在抗肿瘤免疫中的地位?
今年6月,Marit J van Elsas等在 Cancer Cell的一篇研究中指出,接受免疫治疗后,肿瘤中激活的CD8 +T细胞能够通过CCR5信号通路招募巨噬细胞并将其极化为晚期活化的iNOS +M1样巨噬细胞。这些巨噬细胞在肿瘤微环境中发挥着强大的抗肿瘤效应,能够利用多种抗肿瘤效应等来直接攻击肿瘤细胞。而且,这些巨噬细胞还表达CXCL9和CXCL10等分子通过正反馈促进T细胞活化。
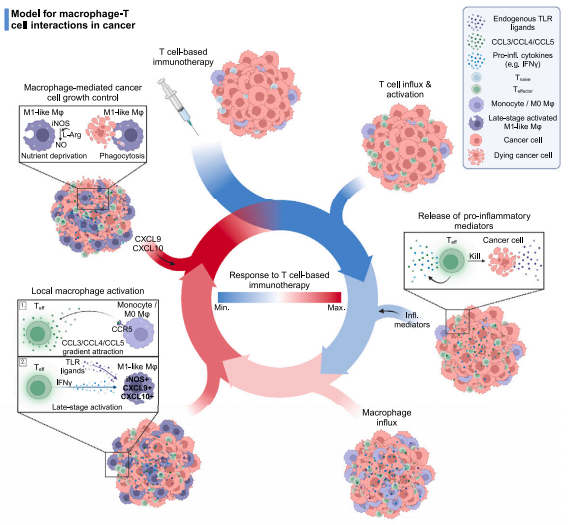
该研究发现巨噬细胞和T细胞之间既可以为对方“打辅助”,同时各自具备充当“主力”的能力。在对免疫治疗有响应的患者中,CD8 +T细胞和M1型巨噬细胞的数量都显著升高。
该研究还发现,免疫治疗时清除肿瘤内的CD8 +T细胞或M1型巨噬细胞显著限制了抗肿瘤反应,而清除中性粒细胞和NK细胞则几乎没有影响。
对于“双主角”的抗肿瘤免疫,基于T细胞的免疫疗法需要重点关注M1型巨噬细胞的参与。同时,应当十分谨慎对待巨噬细胞或中性粒细胞抑制疗法与基于T细胞的免疫疗法的联合应用。
近期越来越多的证据支持巨噬细胞在抗肿瘤免疫中的关键地位。巨噬细胞既可以分化为M1与CD8 + T细胞正反馈调节互相促进抗肿瘤免疫,也可以分化为M2与Treg协同推动免疫抑制。
作为抗肿瘤剧场的两位主角,巨噬细胞和T细胞的两台天平相互关联,牵一发而动全身,共同主导着抗肿瘤免疫的走向。
基于巨噬细胞对实体瘤的浸润优势,CAR-M技术作为靶向巨噬细胞疗法的一支主力军实现了快速发展。或许靶向巨噬细胞拥有与免疫检查点阻断平分秋色的潜能,而二者联合又将谱写怎样的辉煌?我们拭目以待。
诊断、筛查技术进展
……
1-
Nature Medicine :温州医科大学附属眼视光医院瞿佳教授、张康教授、北京大学王劲卓教授开发基于自我改进生成基础模型的综合医学影像生成系统并探索其临床应用 [1]。
在众多临床和研究设计中,高质量医学图像数据集的不足限制了AI临床应用的潜能。该现象在不常见的情景、非代表性人群和新兴成像模式中尤为突出,在这种情况下,多样且全面的数据集往往是匮乏的。
为解决该挑战,研究者引入了称为MINIM的联合医学图像-文字生成模型,该模型可以基于文本描述,通过多种图像模式整合多器官来源的医学图像。研究者通过临床评估和严格的客观测量验证了MINIM合成图像的高质量。MINIM在处理先前未见过的数据域时展现出增强的生成能力,展现出其作为通用型医学AI的潜能。
研究结果显示,MINIM的整合图像有效补充了现有的数据集,增强了诊断、报告生成以及自监督学习等多医学应用的表现。通常情况下,MINIM增强了眼部应用12%的表现,胸部15%,脑部13%,乳腺17%。
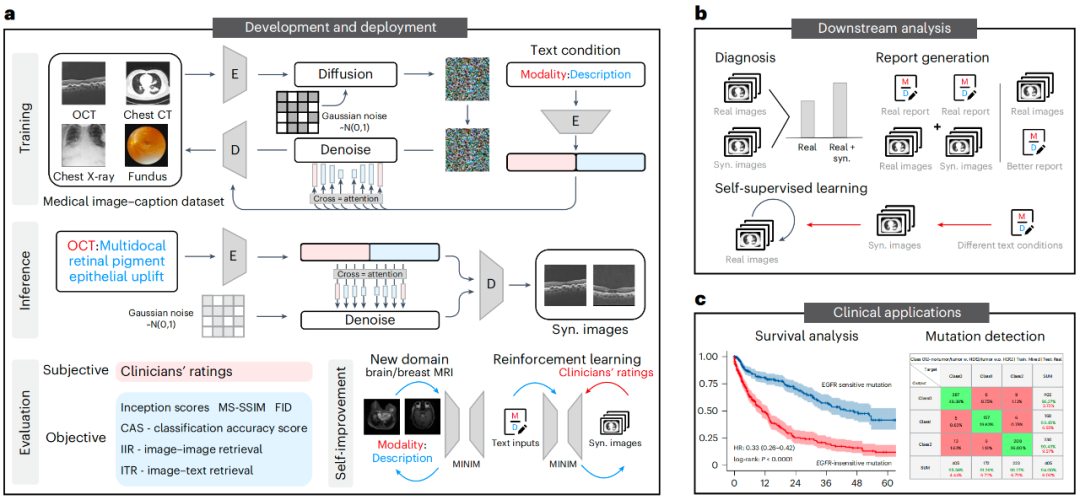
另外,研究者证明了MINIM用于HER2阳性乳腺癌MRI图像的精确预测的临床应用潜力。在一个大型回顾性模拟分析中,研究者还证明了MINIM利用肺癌CT图像识别靶向治疗敏感的EGFR突变患者的临床潜能。一旦成功识别,可提高患者5年生存率。
尽管上述结果充满希望,未来仍需更多多样化和前瞻性设定来验证和改进模型以增强其全能性和稳健性。
内科治疗进展
……
1-
Signal Transduction and Targeted Therapy :南京医科大学附属肿瘤医院朱陵君教授、江苏省卫生健康委员会鲍军教授公布交替改良的CAPOX/CAPIRI联合贝伐珠单抗治疗初治不可切除转移性结直肠癌的Ⅱ期研究结果 [2]。
交替FOLFOX/FOLFIRI治疗转移性结直肠癌展现出鼓舞人心的效果。该研究旨在评估交替改良CAPOX/CAPIRI联合贝伐珠单抗治疗初治不可切除转移性结直肠癌的疗效和安全性。治疗方案为:诱导治疗包括卡培他滨1000 mg/m 2bid D2~8和D16~22,奥沙利铂85 mg/m 2D1,伊立替康150 mg/m 2D15,贝伐珠单抗5 mg/kg D1,15,28天一个周期,最多6个周期。维持治疗为卡培他滨1000 mg/m 2bidD2~15,贝伐珠单抗7.5 mg/kg D1,21天一个周期。
研究共纳入52例患者,中位随访时间为25.0个月。mPFS为11.0个月。亚组分析显示中性粒细胞比淋巴细胞比例<5或RAS野生型有更长的PFS。ORR为73%,DCR为94%。平均响应深度、转化率以及无疾病证据率分别为46%±26.3%、23%和19%。mOS为28.1个月,3~4级TRAE发生率为33%,未有治疗相关死亡。最常见3~4级AE为高血压(25%)、中性粒细胞计数降低(6%)、手足综合征(4%)。1例患者发生3~4级腹泻,未有患者发生3~4级周围神经病变。
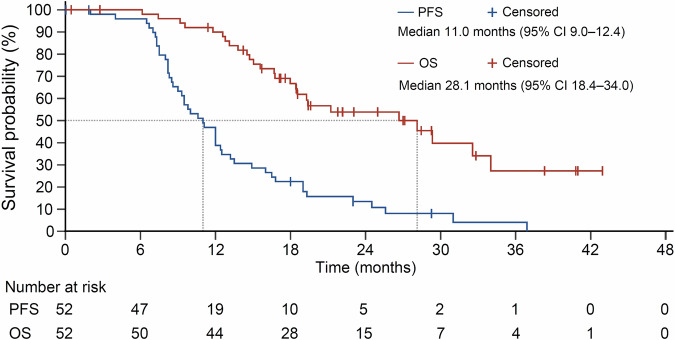
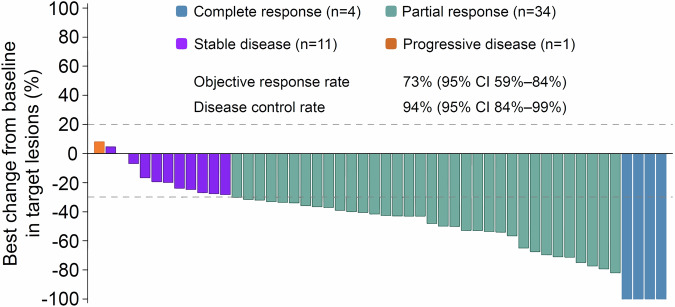
研究结果表明,交替改良的CAPOX/CAPIRI联合贝伐珠单抗方案具有可靠的疗效和可接受的安全性,有望成为初治不可切除转移性结直肠癌患者的新选择。
2-
Nature :中和GDF-15可克服实体瘤对抗-PD-(L)1疗法的耐药性 [3]。
使用抗体阻断免疫检查点分子的肿瘤免疫疗法在多种实体瘤中都有应用并显著增强了治疗效果。然而,免疫疗法的响应率有限,并肿瘤常出现进展。肿瘤微环境中的可溶性以及细胞结合分子负向调节肿瘤免疫。近期,在多种肿瘤中大量分泌的细胞因子——GDF-15被证明影响抗肿瘤免疫。
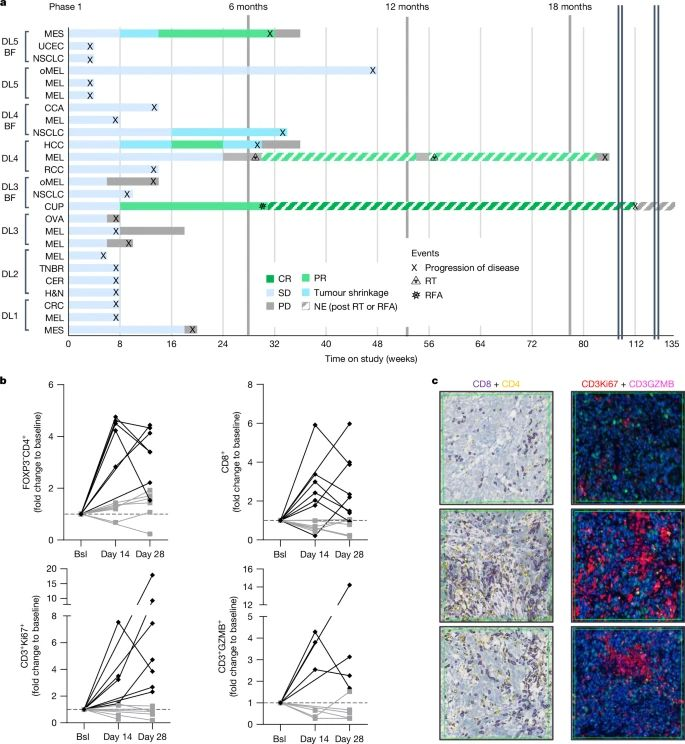
在临床前模型中,GDF-15阻断协同增强抗PD-1介导的免疫检查点阻断效率。在首个人体Ⅰ-Ⅱa期研究(GDFATHER-1/2a)中,接受抗PD-(L)1治疗后复发的患者接受抗GDF-15单抗visugromab(CTL-002)联合纳武利尤单抗治疗。部分非鳞状非小细胞肺癌和尿路上皮癌患者实现了持续且深度的缓解。根据Atlas数据库,这两种肿瘤常因GDF-15产生免疫抑制。给药后,肿瘤中的细胞毒性T细胞表现出浸润、增殖、IFN-γ相关通路活性以及颗粒酶B表达增强。
中和GDF-15展现出克服免疫检查点抑制剂耐药的能力,有望成为新兴疗法。
3-
JAMA :复旦大学附属肿瘤医院邵志敏教授公布卡瑞利珠单抗联合化疗作为早期或局晚期三阴性乳腺癌患者的新辅助治疗——CamReliefⅢ期研究 [4]。
对于早期或局晚期三阴性乳腺癌患者的优选新辅助治疗方案是4药化疗方案,包括蒽环类、环磷酰胺、紫杉烷类以及铂类。阻断PD-(L)1疗法应用于新辅助治疗已在多瘤种中展示出改善疗效的作用,卡瑞利珠单抗也在三阴性乳腺癌中展示出更优秀的抗肿瘤活性。
该研究旨在评估卡瑞利珠单抗联合化疗作为早期或局晚期三阴性乳腺癌患者的有效性和安全性。主要终点为pCR(ypT0/Tis ypN0)。
研究纳入来自中国40所医院的441例患者,随机(1:1)接受卡瑞利珠单抗(200 mg)或安慰剂,每两周一次。化疗包括:前16周接受白蛋白紫杉醇(100 mg/m 2)+卡培他滨(曲线下面积1.5),D1,8,15,每28天一个周期。随后8周内每2周接受一次表柔比星(90 mg/m 2)+环磷酰胺(500 mg/m 2)。

中位随访时间14.4个月,卡瑞利珠单抗+化疗组56.8%的患者实现pCR,安慰剂+化疗组为44.7%。在新辅助治疗阶段,3级及以上AE发生率分别为89.2% vs 83.1%,严重AE发生率分别为34.7% vs 22.8%。卡瑞利珠单抗联合化疗组有2例患者出现致命AE。
在早期或局晚期三阴性乳腺癌患者中,添加卡瑞利珠单抗显著改善pCR。
4-
Signal Transduction and Targeted Therapy :复旦大学附属肿瘤医院解婧教授、孟志强教授、黄胜林教授公布SHR-1701联合法米替尼用于经治晚期胆道癌或胰腺导管腺癌Ⅱ期研究的临床和生物标志物分析 [5]。
晚期胆道癌和胰腺导管腺癌预后较差,治疗选择较少。研究者发起一项Ⅱ期研究来评估SHR-1701联合法米替尼用于治疗标准治疗失败的晚期胆道癌或胰腺导管腺癌患者的有效性和安全性。SHR-1701是一个双功能融合蛋白,靶向PD-L1和TFG-β。法米替尼是多靶点受体酪氨酸激酶抑制剂。
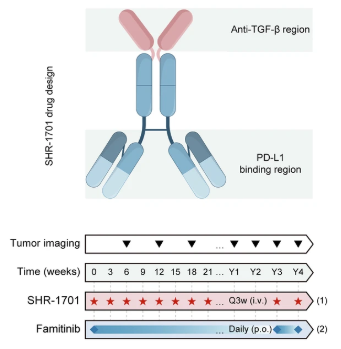
研究入组51例患者。胆道癌亚组ORR为28%,DCR为80%,mPFS为5.1个月,mOS为16.0个月。胰腺导管腺癌亚组ORR为15.2%,DCR为60%,mPFS为2.1个月,mOS为5.3个月。3或4级TRAE发生率为29.4%,未发生5级TRAE。
探索性分析显示,原发肿瘤切除史、外周血免疫表型改变、不同的免疫-代谢谱与治疗获益相关。集成了六个基因特征的免疫/代谢得分作为预测多队列免疫治疗响应的生物标志物,使得入组患者可以最大程度上从该疗法获益。
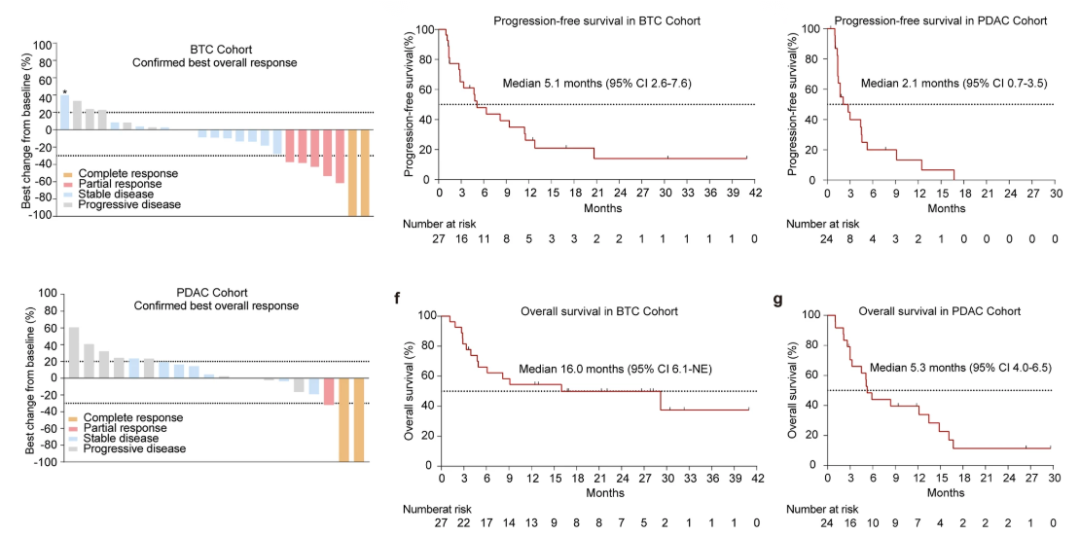
该研究提供了支持SHR-1701联合法米替尼用于治疗复发胆道癌和胰腺导管腺癌患者后线治疗的疗效和安全性的概念验证数据,凸显了同时靶向PD-L1、TGF-β以及血管生成通路的治疗潜力。
抗肿瘤机制研究进展
……
1-
Signal Transduction and Targeted Therapy :中国医学科学院肿瘤医院徐兵河院士、马飞教授揭示HER2低表达转移性乳腺癌ctDNA的基因组景观 [6]。
HER2低表达乳腺癌患者群体规模较大,需要进一步研究提供更深入的临床指导。该研究回顾性分析了1071例转移性乳腺癌患者特征及其ctDNA数据来研究患者的临床病理及遗传学改变。研究者在2个前瞻性临床研究和1个回顾性研究中探索了HER2低表达对不同治疗方案的影响。
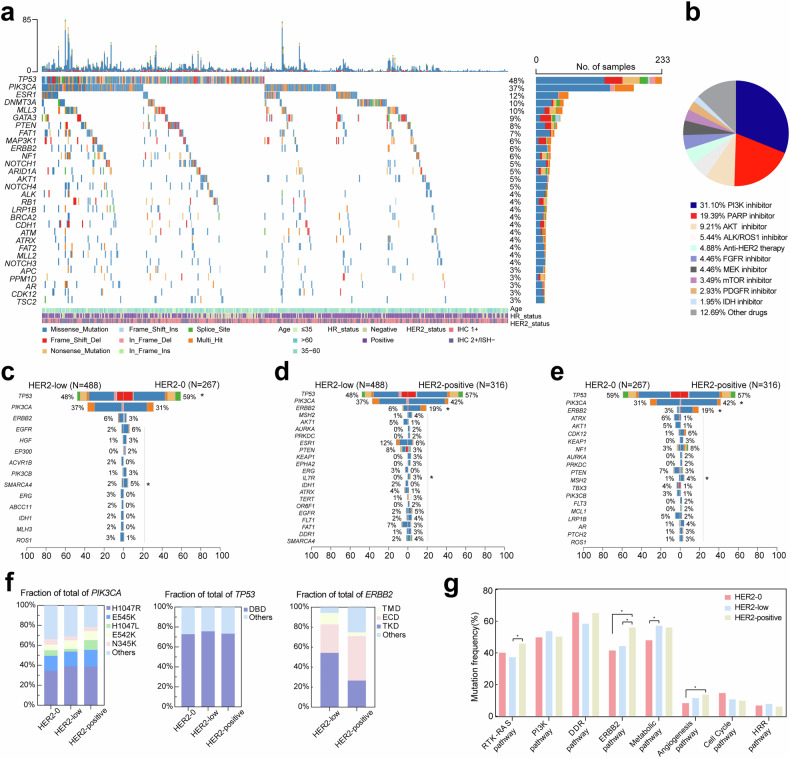
研究发现,TP53、PIK3CA以及ESR1是常见的突变基因。相比HER2-0亚组,HER2低表达患者的突变与代谢通路改变相关性更高。另外,在接受吡咯替尼的ERBB2突变患者中,HER2低表达亚组相比HER2-0亚组预后更好。特别地,研究未观察到两个亚组在对化疗、内分泌治疗、CDK4/6i治疗的响应方面有显著统计学差异。有趣的是,在代谢通路相关基因突变的患者中,HER2低表达亚组相比HER2-0亚组对上述疗法的响应都要好。另外,动态分析显示分子肿瘤负担指数降低或在初始2个治疗周期后实现早期清除的HER2低表达转移性乳腺癌患者生存期延长。此外,研究者将HER2低表达患者分为3个亚群,并提供更精确的治疗方案指导。
该研究为HER2低表达乳腺癌患者提供了宝贵的生物学见解,为个性化治疗策略提供指导。
2-
Nature Genetics :上海市肺科医院张鹏教授、张乐乐教授,同济大学王晨飞教授,同济大学附属同济医院孙毅教授通过多组学分析发现非小细胞肺癌免疫化疗耐药因子 [7]。
尽管免疫检查点阻断疗法已经改变了非小细胞肺癌的治疗范式,但很多患者仍有耐药现象。该研究通过分析了232080个细胞的单细胞转录组学数据以及19个患者在免疫化疗前肿瘤的空间解析转录组学,发现肿瘤细胞和分泌型磷蛋白1阳性巨噬细胞与XI型胶原蛋白Alpha 1(COL11A1)阳性肿瘤细胞相关成纤维细胞相互作用,促进胶原蛋白纤维在肿瘤边界处沉积和纠缠,阻碍T细胞浸润并导致预后变差。研究者同时揭示了三级淋巴结构(TLS)在肿瘤微环境中的突出地位。激活的TLS与预后改善相关,而低氧微环境会抑制TLS发展并导致预后变差。
本研究为非小细胞肺癌免疫化疗反应相关的不同细胞和分子成分提供了创新见解,有助于未来进一步优化个体化免疫化疗。
3-
Cancer Cell :南开大学曹雪涛院士发现抑制胞内CD28通过靶向PD-L1增强抗肿瘤免疫并克服抗PD-1耐药 [8]。
揭秘肿瘤免疫逃逸机制有助于为增强免疫疗法疗效提供靶点。本研究通过三阴性乳腺癌小鼠模型的体内全基因组CRISPR功能缺失筛选,发现CD28的非经典功能可促进免疫逃逸。敲除肿瘤细胞的CD28增加Ⅰ型经典树突状细胞(cDC1)进而肿瘤特异性CD8 T细胞浸润,在体内药物诱导CD28敲低抑制先前建立的肿瘤生长并克服抗PD-1耐药。而且,高表达CD28的人三阴性乳腺癌细胞与PD-L1表达上调、CD8 T细胞浸润减少以及更差预后相关。
从机制上来说,CD28蛋白在细胞核中直接结合到CD274的mRNA并招募剪接体因子SNRPB2以稳定CD274的mRNA,促进PD-L1表达和免疫逃逸。
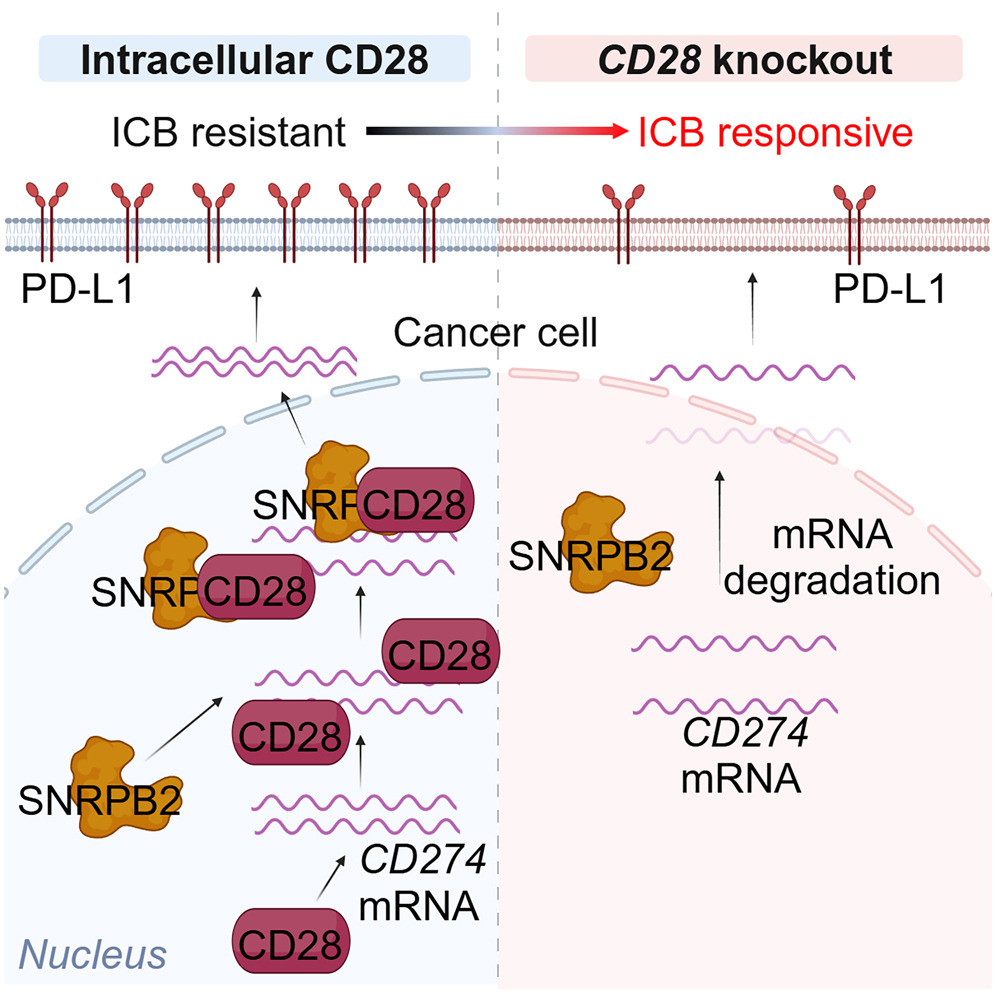
该研究认为,干扰肿瘤中CD28介导的免疫逃逸可能是增强乳腺癌免疫治疗疗效的潜在方法。
刊后语
大风泱泱,大潮滂滂;大道如砥,医者无疆。
积跬步以至千里,每一期周刊都是恶性肿瘤学科发展的剪影;积小流以成江海,一年周刊浓缩肿瘤领域各科前沿进展的精华!关注CACA周刊,带你领略恶性肿瘤学科发展的四季花开。
CACA周刊,我们下周不见不散!
编辑 | 李瑞源
排版 | 晓晓
审核 | 李瑞源
链接:http://www.lewenyixue.com/2025/02/18/%E3%80%90CACA%E5%89%8D%E6%B2%BF%E5%91%A8%E5%88%8A%E3%80%9187%E6%9C%9F%20%E9%9A%BE%E4%BB%A5%E7%BD%AE%E4%BF%A1%EF%BC%81%E6%B8%85/






赶快来坐沙发