Adv Sci丨王魁团队揭示抗氧化酶PRDX6促癌的非酶活机制
过氧化物还原酶PRDXs蛋白家族是细胞内重要的抗氧化酶之一,可通过维持肿瘤细胞氧化还原稳态在肿瘤发生发展过程中发挥重要调控作用。以往研究主要聚焦其酶活功能,PRDXs是否发挥非酶活功能尚不清楚。
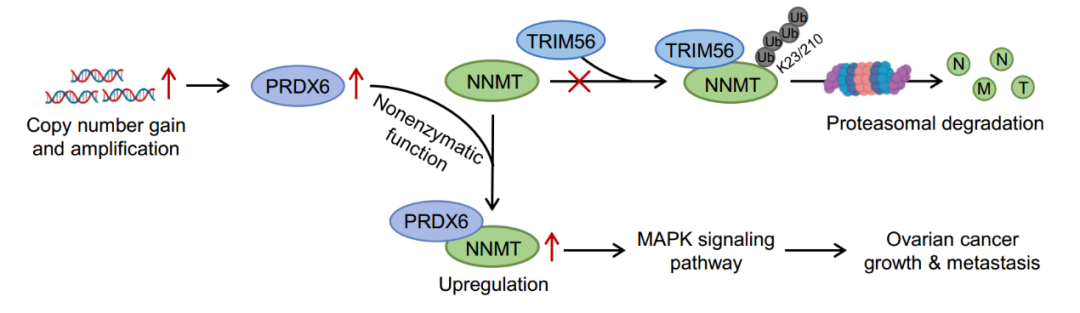
近日,四川大学华西基础医学与法医学院 王魁研究员 团队在 Advanced Science 杂志上在线发表题为 PRDX6 Prevents NNMT Ubiquitination and Degradation as a Nonenzymatic Mechanism to Promote Ovarian Cancer Progression 的研究论文。 该研究揭示了PRDX6促进卵巢癌进展的非酶活机制,发现PRDX6与NNMT竞争性互作,从而抑制TRIM56介导的NNMT泛素化和蛋白酶体降解,促进卵巢癌细胞的生长和转移 。
为了探究PRDXs蛋白家族在卵巢癌进展中的作用,研究团队使用Kaplan-Meier Plotter在线工具发现,仅PRDX6的高表达与卵巢癌患者的总生存期和无进展生存期呈负相关。TCGA数据库和GTEx数据集分析表明,PRDX6在卵巢癌中由于基因拷贝数增加和基因扩增而表达上调。接下来,研究团队在卵巢癌细胞中对PRDX6进行过表达和敲除,证实了PRDX6在体内外促进卵巢癌细胞生长和转移。为了确定PRDX6是否通过其酶活功能促进卵巢癌进展,研究团队构建了PRDX6酶失活突变体。值得注意的是,在PRDX6敲除的细胞中回补PRDX6酶失活型突变体仍能一定程度上缓解PRDX6敲除对卵巢癌细胞生长和转移的抑制作用,表明PRDX6可通过非酶活功能发挥促癌作用。
为了探讨PRDX6促癌的非酶活调控机制,研究团队通过免疫沉淀和质谱分析,鉴定出 N -烟酰胺甲基转移酶 (NNMT) 为PRDX6的直接下游靶标。PRDX6以不依赖于酶活的方式与NNMT相互作用,且PRDX6能够上调NNMT的蛋白水平。研究团队进一步研究了PRDX6上调NNMT的机制,发现PRDX6可竞争性阻断E3泛素连接酶TRIM56与NNMT的结合,从而抑制NNMT 在第23 和 210 位赖氨酸的泛素化修饰及蛋白酶体降解。最后,研究团队通过RNA-Seq分析和功能实验,证实了PRDX6介导的NNMT上调可激活MAPK信号通路,从而促进卵巢癌细胞生长和转移。在小鼠皮下瘤和腹腔转移模型中,过表达PRDX6显著促进了卵巢癌的生长和转移,而敲低NNMT则可显著抑制这一作用。在卵巢癌病人组织样本中,PRDX6与NNMT蛋白水平呈显著正相关,且PRDX6和NNMT同时高表达的患者预后更差。
综上所述,该研究揭示了 PRDX6 通过非酶活途径促进卵巢癌进展的新机制,刷新了对抗氧化酶功能的传统认知,为卵巢癌治疗提供了新的思路。
四川大学华西基础医学与法医学院硕士研究生吴星云、博士研究生王茂和华西第二医院罗丽副主任技师为该论文的共同第一作者;四川大学华西基础医学与法医学院王魁研究员为本文通讯作者。
原文链接:https://doi.org/10.1002/advs.202416484
制版人:十一
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2025/02/11/Adv%20Sci%E4%B8%A8%E7%8E%8B%E9%AD%81%E5%9B%A2%E9%98%9F%E6%8F%AD%E7%A4%BA%E6%8A%97%E6%B0%A7%E5%8C%96%E9%85%B6PR/
THE END






赶快来坐沙发