JAMA Oncol:CD19和GCC靶向CAR-T治疗结直肠癌的I期临床试验
结直肠癌(CRC)是全球癌症死亡的第二大原因,约一半患者最终发展为晚期、不可治愈的CRC,治疗进展有限。CAR-T细胞疗法在血液系统癌症中取得了显著疗效,但在实体瘤中效果不佳。研究者观察到, 与靶向实体瘤抗原的CAR-T细胞相比,靶向CD19的CAR-T细胞扩增更为显著 。 当自体转导的CD19 CAR-T细胞与非转导的T细胞混合后,在体外扩增后进行输注,这两种细胞类型都会迅速增殖 。此外,CD19 CART还增强了共同输注的靶向实体瘤抗原的CAR-T细胞的增殖,如 GCC (GUCY2C) 。
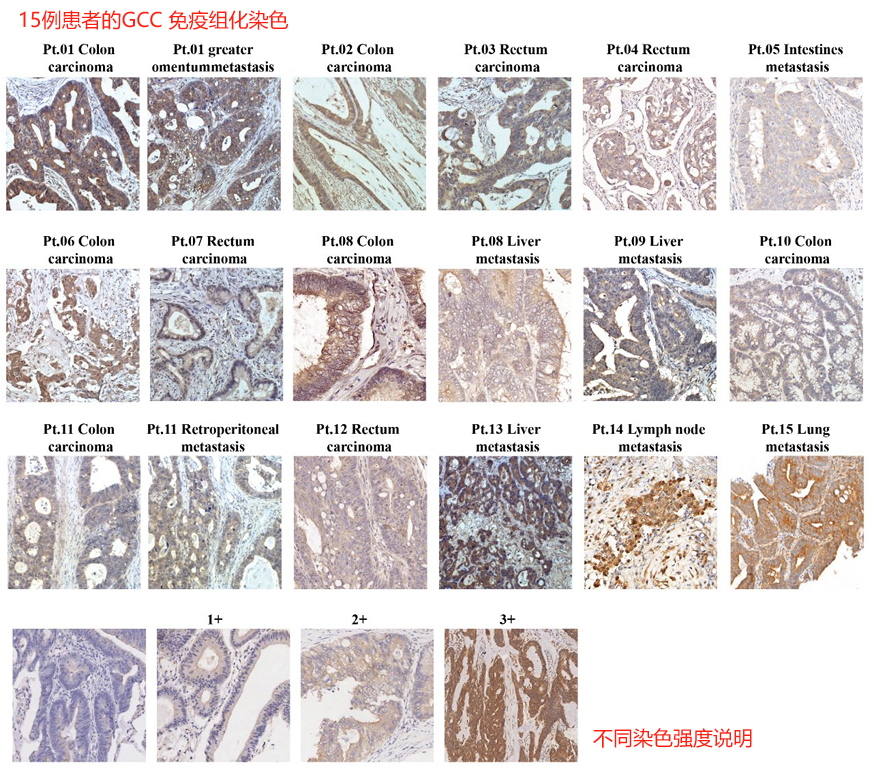
GCC(鸟苷酸环化酶) 是CRC转移中70%至80%表达的抗原,其在正常组织中的表达限于肠道上皮细胞的顶端表面,这些细胞通过紧密连接与系统循环隔离,因此T细胞无法接触。此外,转导编码IFN-γ、IL-6和IL-12的基因,增强了CD19 CAR-T细胞在恶性肿瘤中的增殖、运输和浸润。
今天一起看一项单臂1期临床试验,于2020年12月3日至2022年4月13日在吉林大学第一医院进行,数据分析从2022年5月持续至2024年4月。 15例表达GCC的复发性和难治性mCRC成人患者,接受了GCC19CART治疗,这是一种多种自体CAR-T细胞组成的混合物。
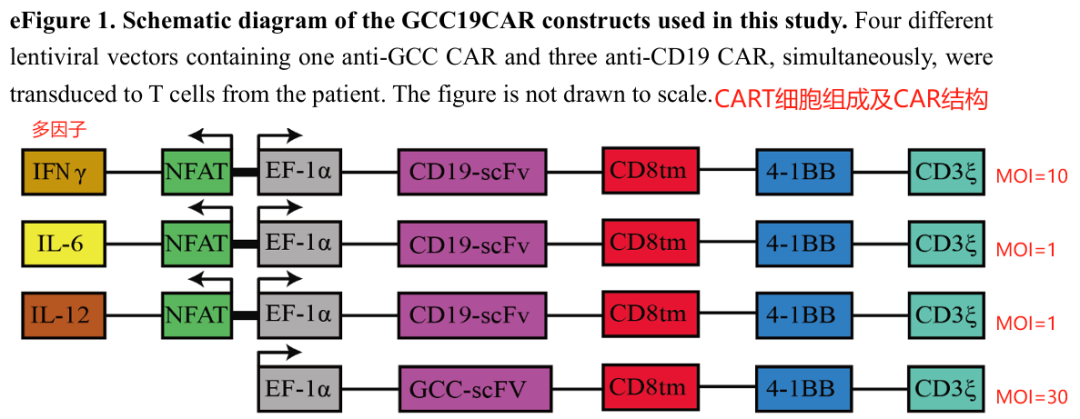
1、靶向CD19和GCC的混合CAR T细胞制备
分离PBMCs后,利用CD4和CD8微珠纯化CD4+和CD8+T细胞。然后用抗CD3和抗CD28微珠刺激后,培养24小时。用四种载体的混合物转导 T细胞 ,这些载体分别编码 GCC -CD8tm-41BB-CD3ζ(GCCCAR) 、 IFN-γ -CD19-CD8tm-41BB-CD3ζ(CD19CAR+IFN-γ) 、 IL-6 -CD19-CD8tm-41BB-CD3ζ(CD19CAR+IL-6) 和 IL-12 -CD19-CD8tm-41BB-CD3ζ(CD19CAR+IL-12) 。
目标细胞转导的MOI值分别为30、10、1和1。
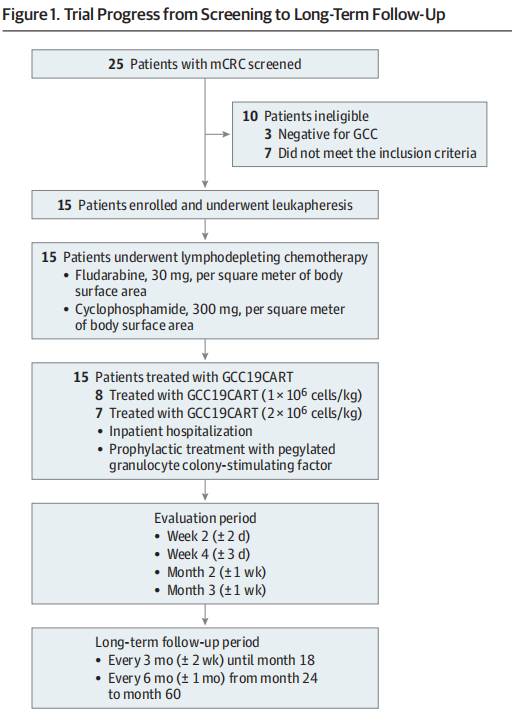
2、临床试验流程
治疗剂量为1×10^6或2×10^6细胞/kg, 共筛选了25名患者,其中15名符合条件并接受了GCC19CART治疗。
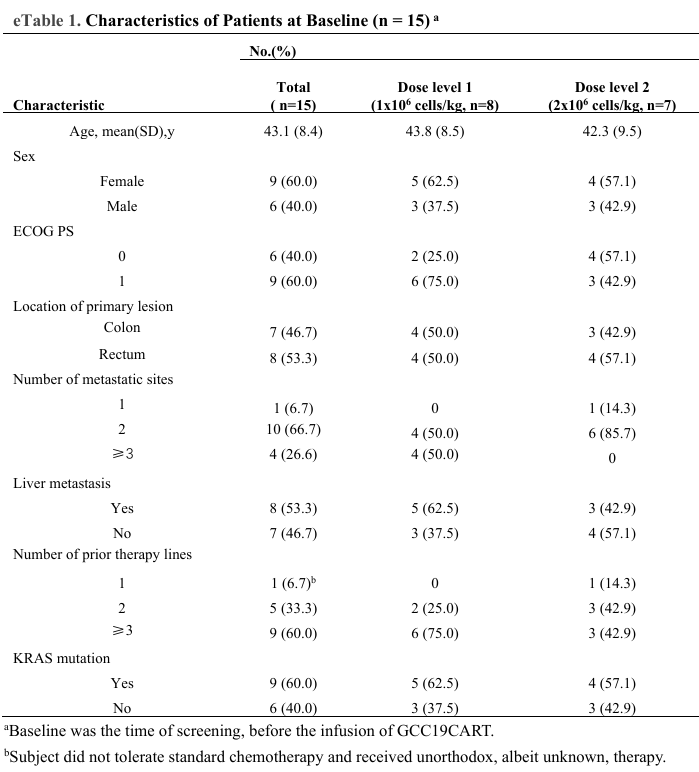
3、15例患者基线
患者的中位年龄为44岁;9例为女性;9例既往经过3线及以上治疗。
4、15患者的组织GCC表达
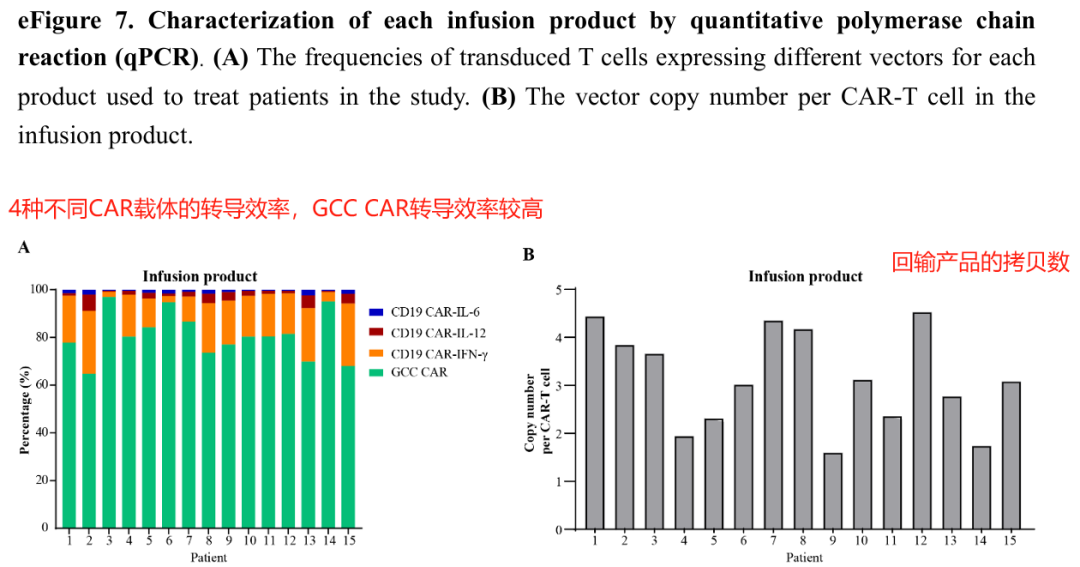
5、回输产品的表征
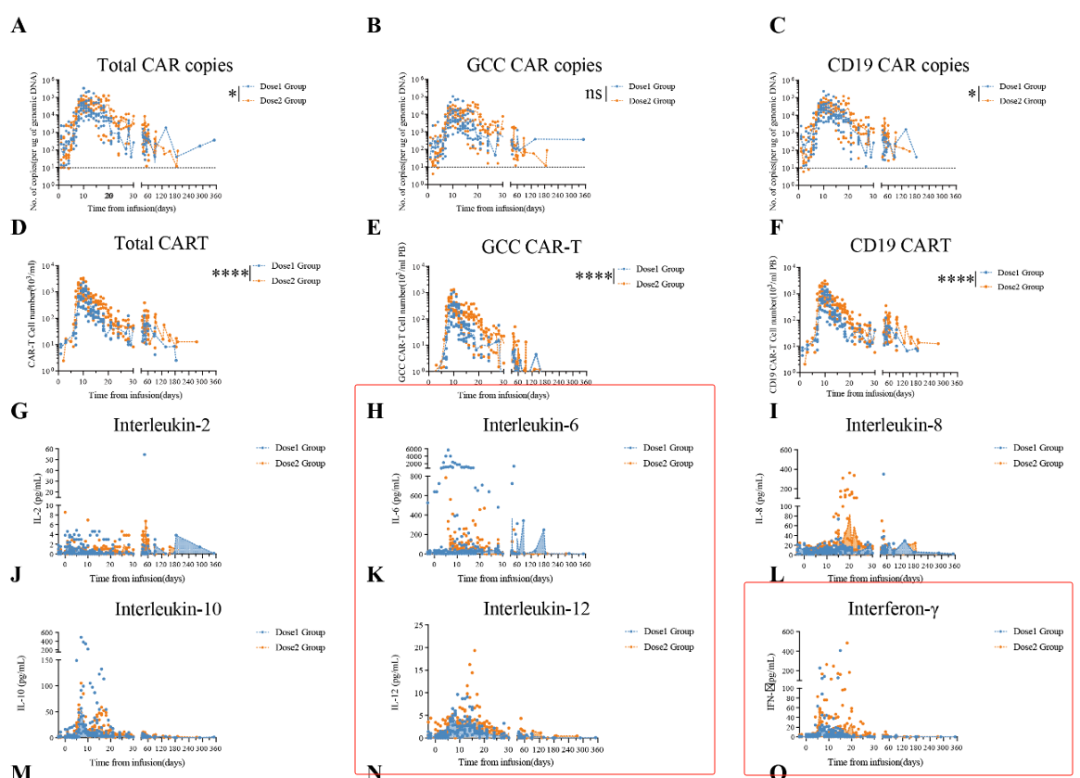
6、回输后CART的扩增和细胞因子释放
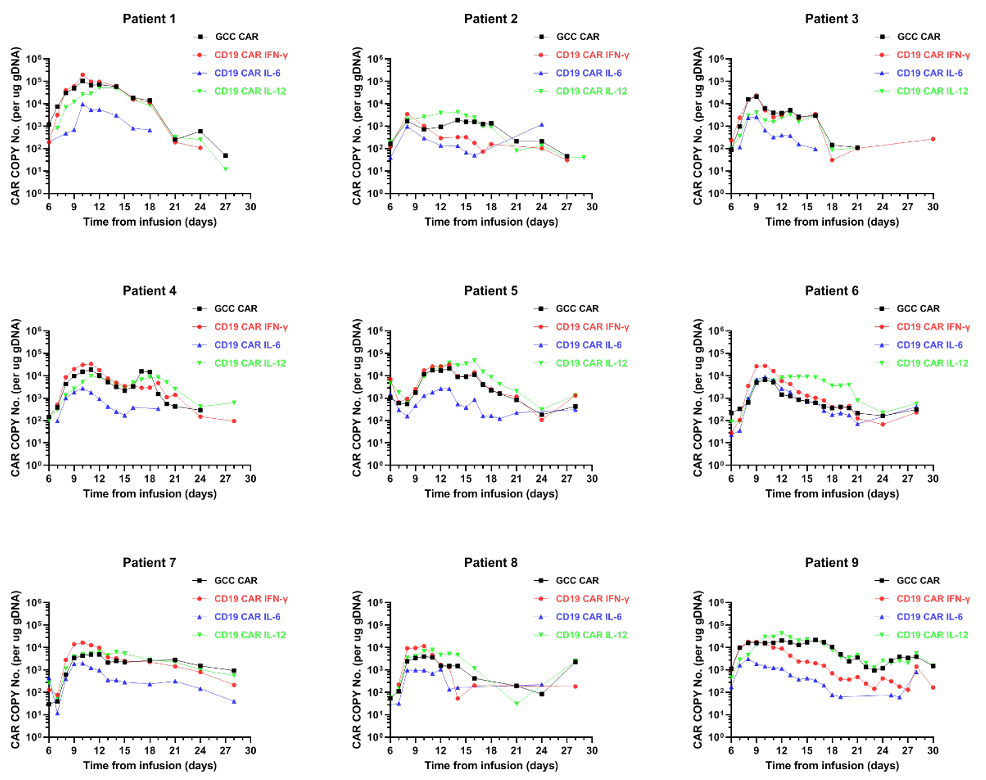
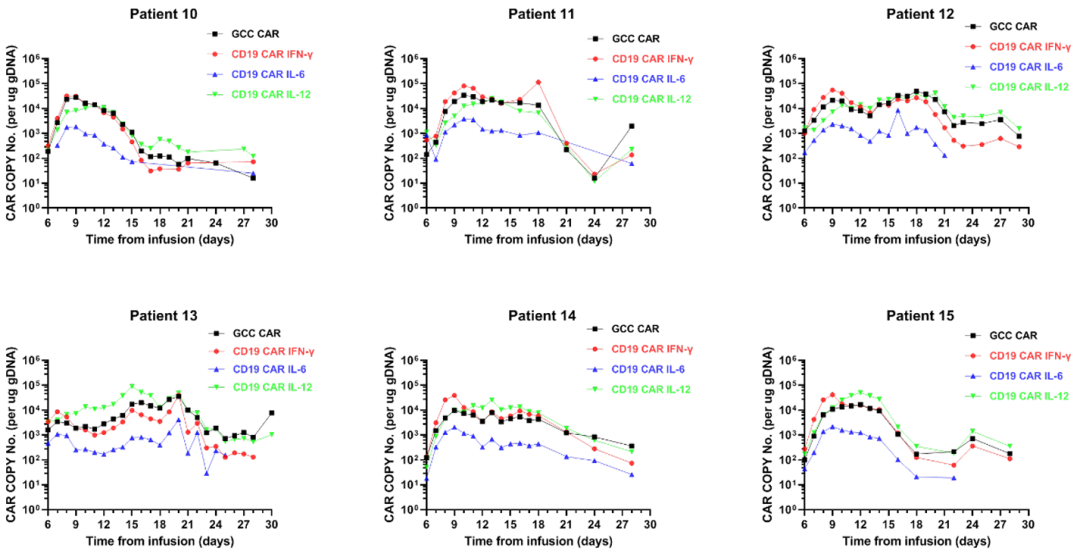
7、外周血的CAR拷贝数
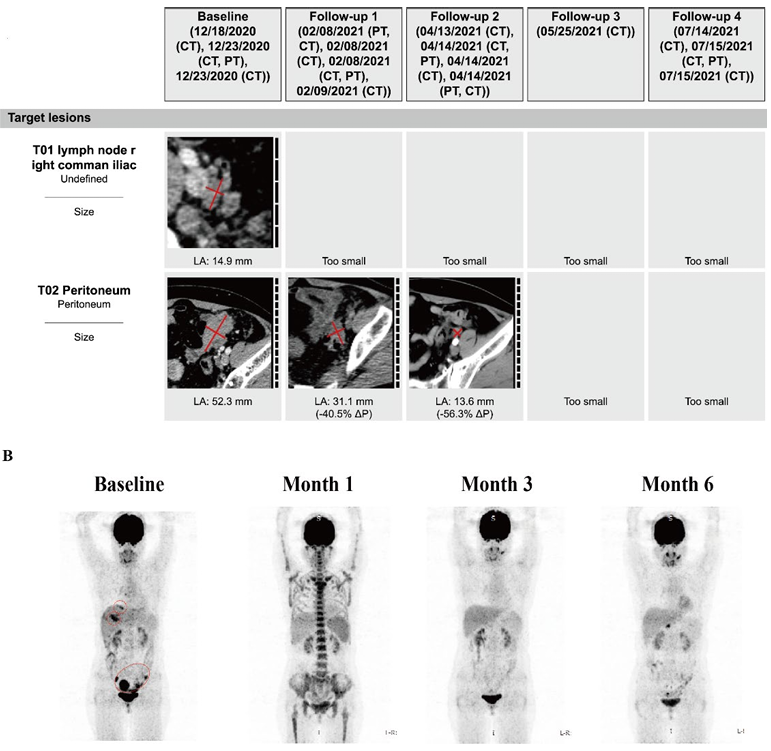
8、患者1接受CAR-T细胞输注后的影像学检查
患者1接受GCC19CART治疗的CT和FDG-PET影像,治疗剂量为每公斤体重1×10^6个细胞。影像检查在治疗前以及治疗后1个月、3个月和6个月进行。CT影像显示腹部和盆腔靶病灶的PR(红色垂直线),以及非靶病灶的缩小(未显示)。肝脏和盆腔转移灶的FDG-PET发射(基线,红色圆圈)在治疗后的所有影像检查中显示出部分代谢缓解PMR。 该患者确认获得部分缓解PR(RECIST 1.1)和部分代谢缓解PMR(PERCIST 1.0)。
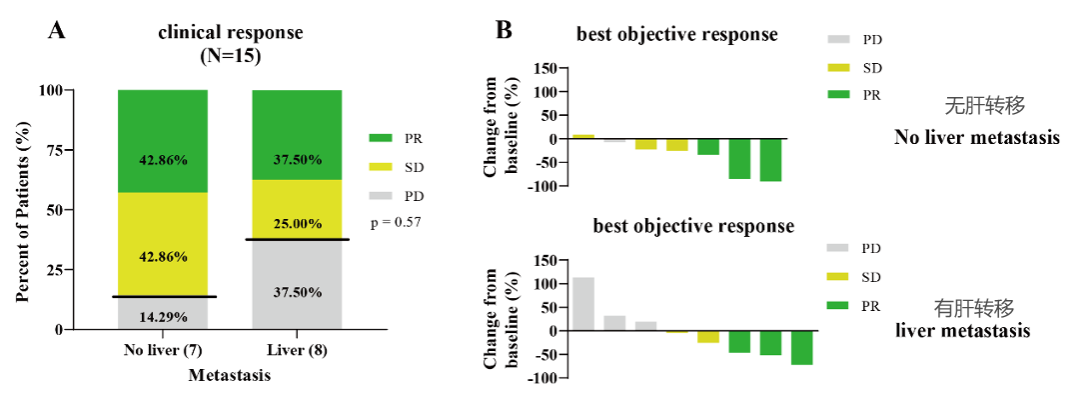
9、回输后的治疗有效率
15名患者中有6名(40%)获得部分缓解(PR) ,其中包括3例未确认的PR;
GCC19 CART治疗在有肝转移的患者中仍然可以取得部分缓解和稳定的疾病状态。
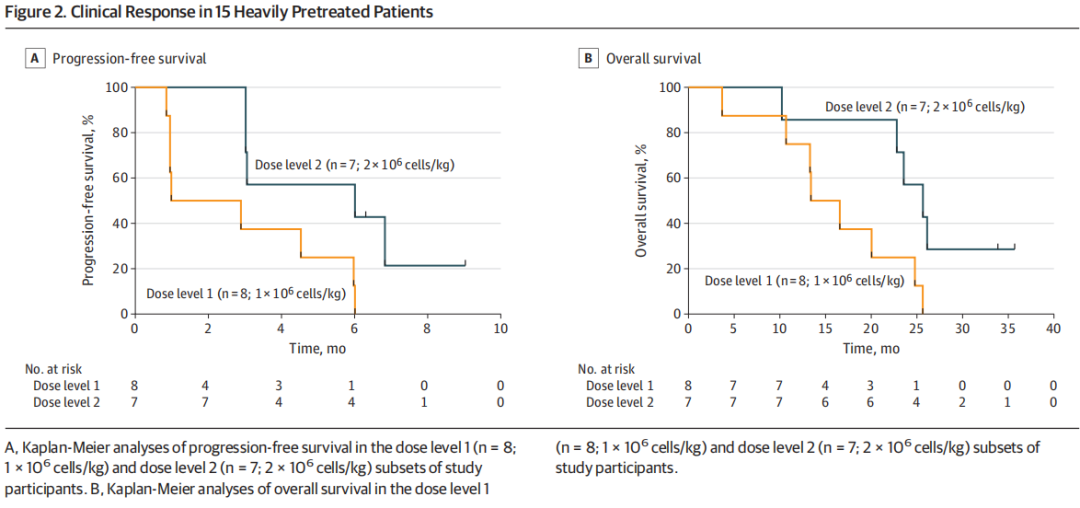
10、15例患者生存情况
在高剂量组中,患者的中位无进展生存期显著高于低剂量组(6.0个月对比1.9个月,P=0.03)。中位总生存期为22.8个月。40%的患者经历了部分反应(PR),包括3例未确认的PR。中位反应持续时间为5.1个月。73%的患者出现了稳定的疾病,总体临床受益率为73%。
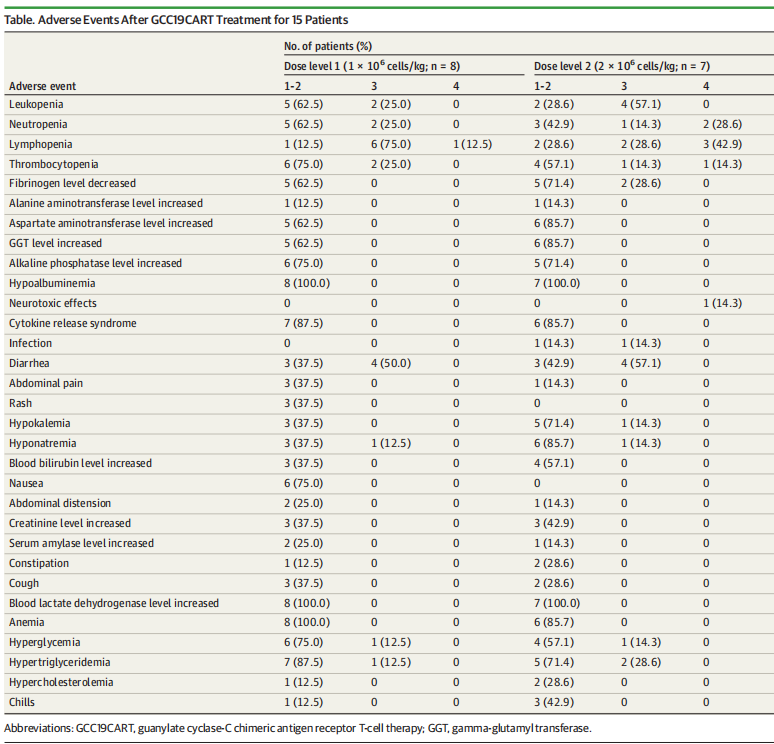
11、15例患者的不良事件
大多数患者(93%)经历了至少一次3级或更高级别的不良事件(AE),其中14例93%的患者发生CRS,但大多数为1-2级,且均为可管理的。腹泻是另一个常见不良事件,发生在93%的患者中。
所有患者均出现了短暂且可逆的血液学AE,主要是1-2级。没有与研究相关的死亡发生。
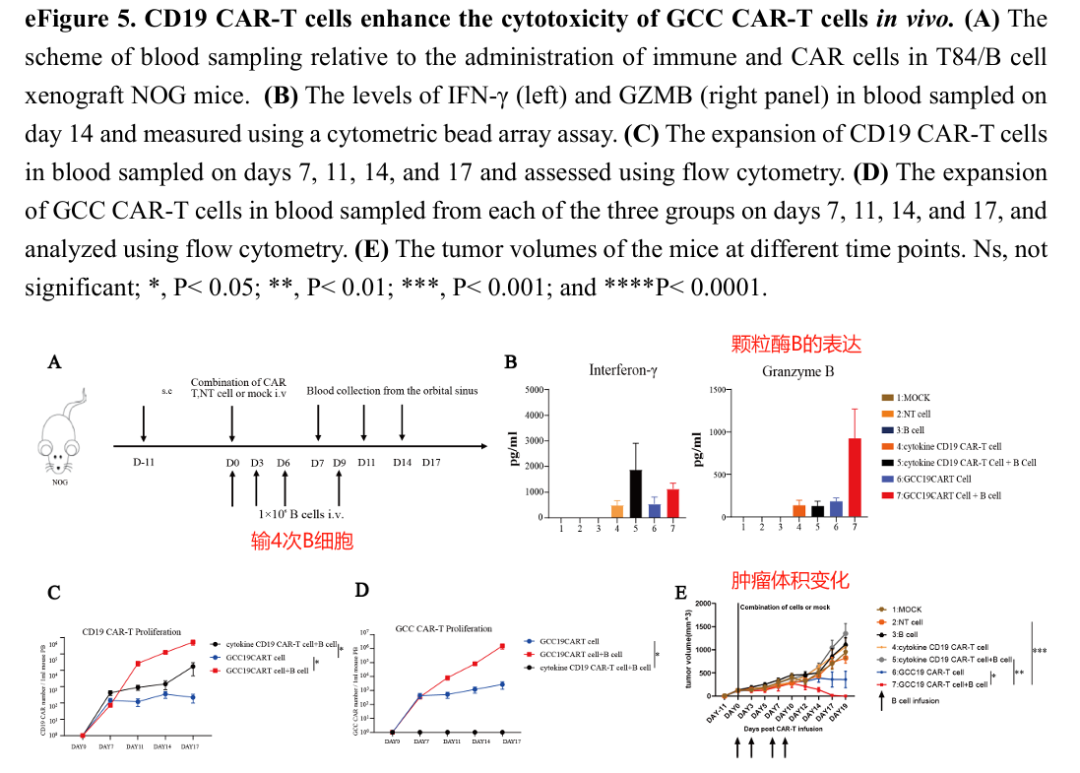
12、CD19 CAR-T细胞在体内增强了GCC CAR-T细胞的细胞毒性
小结
大家都知道,实体瘤疗效不佳的其中一个原因就是CART扩增不良,这项研究创新地提出了刺激CART细胞扩增地新方法, 为未来CRC和其他实体瘤的治疗提供了新的思路!
参考文献:
Chen, Naifei et al. “Chimeric Antigen Receptor T Cells Targeting CD19 and GCC in Metastatic Colorectal Cancer: A Nonrandomized Clinical Trial.” JAMA oncology vol. 10,11 (2024): 1532-1536. doi:10.1001/jamaoncol.2024.3891.
链接:http://www.lewenyixue.com/2025/01/15/JAMA%20Oncol%3ACD19%E5%92%8CGCC%E9%9D%B6/






赶快来坐沙发