Dana-Farber癌症研究所宣布启动RAS治疗中心,专注于RAS突变型癌症的靶向治疗发展
近日,Dana-Farber癌症研究所宣布启动RAS治疗中心。RAS治疗中心是一项多学科计划,旨在通过科学发现、转化研究和临床分析推进新的治疗方法,以改善RAS突变驱动的癌症患者的临床护理。 该中心将促进Dana-Farber科学家和临床医生与行业合作伙伴和学术中心之间的合作,以加快RAS突变型癌症靶向治疗的发展,为患者提供最有希望的治疗选择。
RAS是人类癌症中最常见的突变基因之一。RAS蛋白通常作为控制细胞生长和存活的分子开关起作用。癌症中的RAS突变将这个开关锁定在“开启”状态,进而促进癌症的发展和进展。有数据显示,全世界超过20%的癌症病例携带KRAS、NRAS和HRAS三种RAS基因中的一种突变。仅在美国,RAS突变型癌症每年就有260,000例,全球约有340万例。 RAS突变在肺癌(32%)、胰腺癌(92%)以及结直肠癌(54%)患者中最为普遍,并且通常比未携带这些突变的癌症患者具有更差的预后和更低的存活率。
来源: Dana-Farber癌症研究所
虽然RAS是癌症最优先的治疗靶点之一,但开发针对靶向药物仍是一项重大挑战。近期的研究进展促进了多种新药的发现,可以抑制这些致癌的RAS突变。美国FDA此前批准了用于治疗KRAS G12C突变的非小细胞肺癌和结直肠癌的RAS抑制剂(sotorasib和adagrasib),对于胰腺癌也有新的治疗方法正在临床研究中。
据悉,RAS治疗中心将由Alice Shaw博士和Andrew Aguirre博士共同领导。Shaw博士领导了肺癌靶向治疗的开发工作,并在开发RAS抑制剂方面拥有丰富的经验。Aguirre博士是一名胃肠道肿瘤学家,同时也是Dana-Farber癌症研究所、哈佛大学Broad研究所和麻省理工学院的一名内科科学家,领导着一个专注于胰腺癌RAS生物学的实验室。他的研究团队已发表多篇关于RAS治疗耐药性的研究文章。

Alice Shaw博士和Andrew Aguirre博士
Shaw博士表示:“RAS是一些最具挑战性癌症的主要驱动因素,包括肺癌、胰腺癌、结直肠癌和子宫内膜癌等。最近,针对RAS突变型癌症的新疗法激增,这为患者创造了前所未有的机会,但也揭示了重要的挑战。这个新启动的中心将使Dana-Farber研究人员能够协调努力,尽快为患者提供最有潜力的新疗法。”
资料显示,RAS治疗中心主要是通过以下方式,为RAS突变型癌症患者发现和开发最有效的RAS靶向疗法:
-
严格的临床前研究,以了解RAS生物学,分析新的治疗方法,并阐明耐药性机制;
-
合理设计有效的对抗耐药性的组合策略;
-
快速激活和累积最有前景RAS靶向疗法的临床试验;
-
反向转化研究,直接向每个患者学习;
-
强有力的学术-产业合作。
目前,数十种新的RAS抑制剂正在进行临床试验评估,这些新疗法将彻底改变RAS突变癌症的治疗。 RAS治疗中心的一个重要任务是支持新型RAS抑制剂的开发,其中许多已经进入临床试验阶段或处于先进的临床前研究中。 Dana-Farber研究所目前也在进行一些临床试验,专注于RAS突变型癌症的潜在新疗法。同时,该中心的关键目标之一是通过解决对RAS抑制剂耐药性的挑战来改善治疗结果。
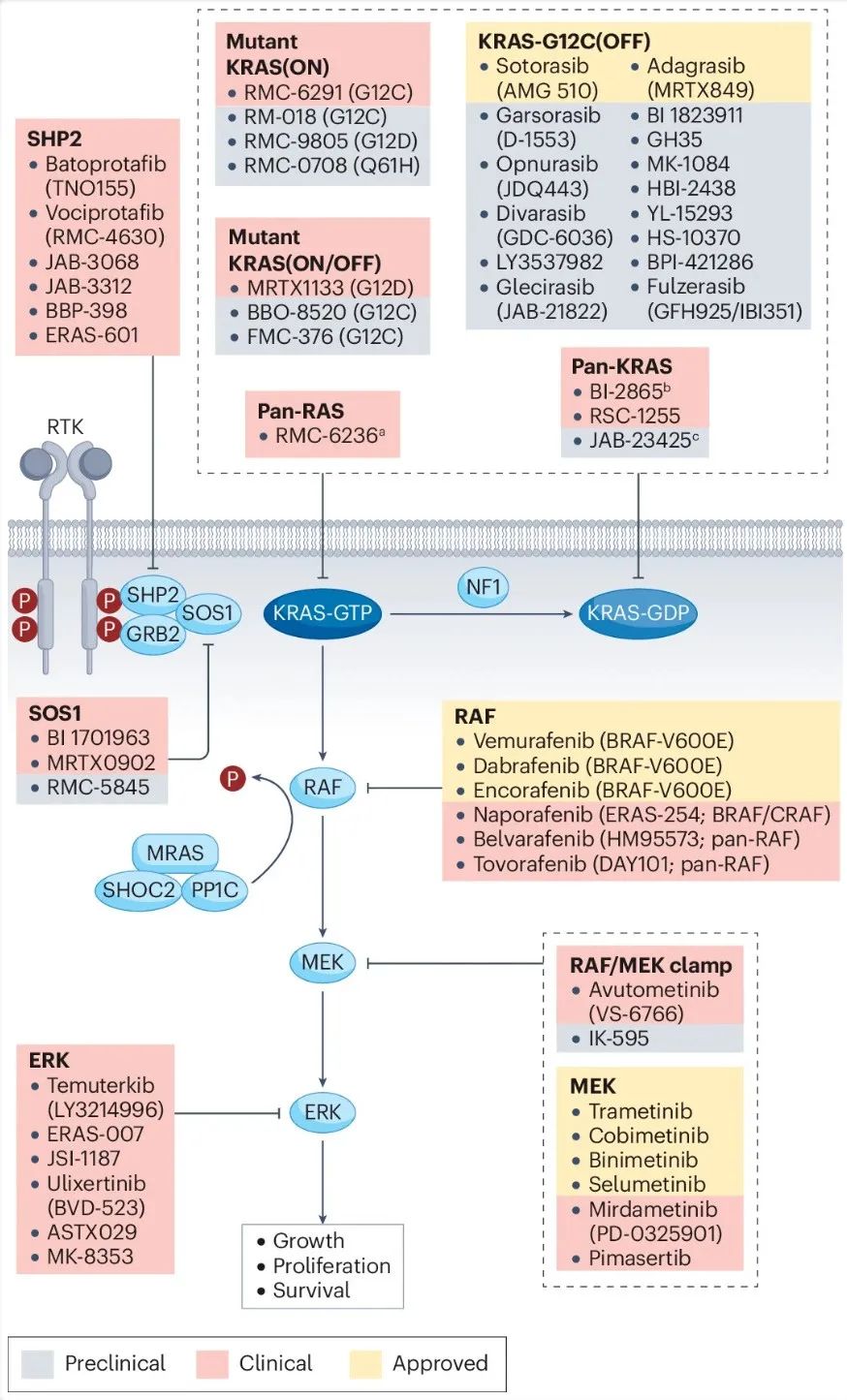
图:RAS信号通路及其抑制剂的临床和临床前研究。来源: Nature Reviews Cancer
几乎所有患者都存在RAS抑制剂的治疗耐药性。Aguirre博士表示:“虽然RAS靶向治疗有巨大的前景,但治疗耐药性仍然是一个重大问题,需要创新的联合治疗方法。新型RAS抑制剂的情况非常复杂,在临床试验中有数十种针对RAS突变的新疗法。 这些新疗法以不同的方式靶向RAS突变,需要一种综合的方法来理解这些新疗法,为每个患者确定正确的药物或药物组合。我们将与其他学术和行业伙伴密切合作,目标是提高我们对不同肿瘤类型治疗耐药性的理解,发现RAS突变型癌症中的新漏洞,并对新疗法进行最有效的临床试验。”
近年来,随着越来越多RAS抑制剂进入临床试验以及新型药物组合显示的初步效果,RAS抑制剂的研发及众多有前景的联合治疗策略已经改变了RAS突变型癌症的治疗格局。同时,开发更持久和具有治愈效果的疗法仍需采用联合治疗方法。新启动的RAS治疗中心致力于利用新的RAS靶向治疗与传统治疗如化疗、免疫治疗、手术以及研究性治疗相结合,以提高RAS驱动型癌症患者的治愈率。
相信RAS治疗中心的启动将促进更多临床医生、产业和学术中心的合作,加深对RAS生物学机制的理解,加快RAS相关抑制剂的研发,为RAS突变肿瘤的治疗带来新突破和希望。
链接:http://www.lewenyixue.com/2025/01/15/Dana-Farber%E7%99%8C%E7%97%87%E7%A0%94%E7%A9%B6%E6%89%80%E5%AE%A3%E5%B8%83%E5%90%AF%E5%8A%A8/