Nature子刊:华西医院吴泓/兰天团队发现环状RNA编码蛋白促进肝癌发展,并找到潜在治疗药物

撰文丨王聪
编辑丨王多鱼
排版丨水成文
肝细胞癌 (HCC) 是全球第六大常见癌症,也是癌症相关死亡的第三大原因。由于大多数患者在晚期才被诊断出来,所以有效的治疗方法很少。目前,用于晚期 HCC 系统治疗的主要药物是多激酶抑制剂和免疫检查点阻断剂 (ICB) 。然而,口服多激酶抑制剂在临床应用中显示出有限的益处。靶向 PD-1 的免疫检查点阻滞剂通过阻止 PD-L1 与 PD-1 的结合,抑制抗肿瘤效应 T 细胞的耗竭,从而彻底改变了多种晚期恶性肿瘤的治疗。但不幸的是,尽管最初取得了成功,但抗 PD-1 耐药的发生率高达 70% - 80%;因此,HCC 复发和治疗反应失败的情况很常见。研究 ICB 耐药的潜在机制可能有助于开发新的治疗策略和新型药物,以克服晚期 HCC 对 ICB 治疗的耐药性。
2025年1月2日,四川大学华西医院 吴泓 、 兰天 等人在 Nature 子刊 Nature Communications 上发表了题为: The protein circPETH-147aa regulates metabolic reprogramming in hepatocellular carcinoma cells to remodel immunosuppressive microenvironment 的研究论文。
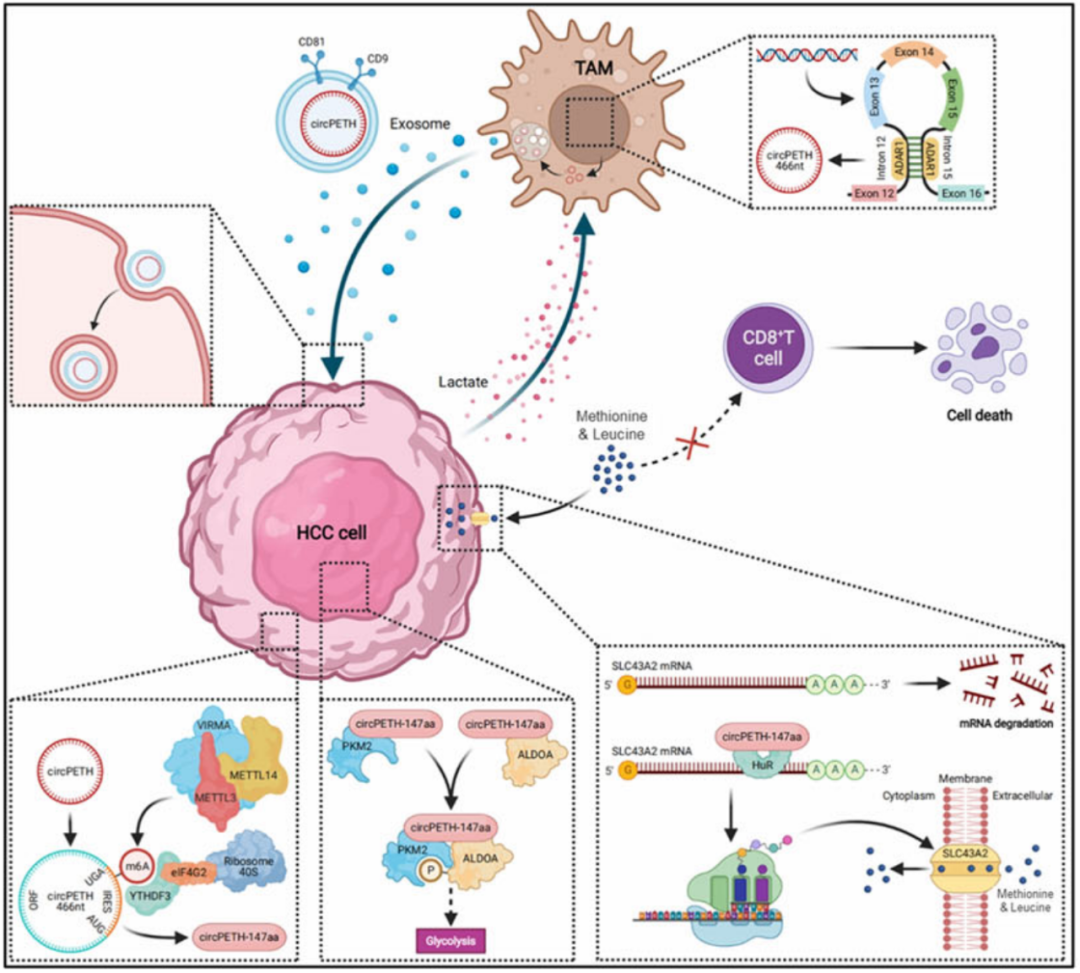
该研究发现由环状 RNA circPETH 编码的一种新型蛋白质—— circPETH-147 aa ,其调节肝癌细胞代谢重编程,重塑免疫抑制微环境,从而促进肿瘤发展。该研究还程功筛选到了 circPETH-147 aa 的小分子抑制剂—— norathyriol,可作为 一种有前景的 肝细胞癌 (HCC) 潜在治疗 药物,有助于减轻晚期肝细胞癌 对免疫检查点阻断剂 (ICB) 的耐药性 。
为了 维持其恶性生物学特性,肝细胞癌 (HCC) 细胞往往会通过改变其代谢表型来与邻近的正常细胞竞争相对有限的营养物质,这种现象被称为 代谢重编程 。
有氧糖酵解,即 Warburg 效应,是肿瘤细胞中一种重要的葡萄糖代谢形式;在此过程中,即便氧气充足,肿瘤细胞也会消耗大量葡萄糖并产生大量乳酸。
越来越多的证据表明,有氧糖酵解对多种生物合成途径、生物过程以及负责生成促进癌细胞转移和免疫逃逸的信号代谢物的过程产生显著的多方面影响,随后形成免疫抑制性的 肿瘤微环境 (TME) 。
肿瘤微环境 (TME) 中的效应 T 细胞的耗竭,被认为是 肝细胞癌 (HCC) 发生 ICB 耐药的关键因素。 肿瘤相关巨噬细胞 (TAM) 作为 TME 中最丰富的炎症细胞,与多种癌症患者的不良预后和免疫治疗反应不良高度相关。TAM 可通过增加肿瘤细胞的糖酵解能力和转移潜能,抑制 T 细胞介导的对肿瘤细胞的杀伤,从而加速肿瘤进展。然而,TAM 在肝癌代谢重编程和免疫抑制性的 TME 中的确切作用尚不清楚,需要进一步研究。
环状 RNA (circRNA,也叫做环形 RNA) ,是一类共价闭合的单链 RNA 转录物。越来越多的研究描述了 circRNA 在多种生物学调控过程中的重要性,包括生物发育、细胞分化和凋亡、免疫反应、肿瘤发生和转移。
近年来,circRNA 被发现也是一种可翻译的 RNA,它携带开放阅读框 (ORF) 和内部核糖体进入位点 (IRES) ,能够招募核糖体,从而在没有 5' 帽结构的情况下启动翻译,进而产生具有调控癌细胞恶性生物学行为能力的新蛋白质。
已有研究报道, circRNA 参与肿瘤与免疫细胞之间的相互作用,影响肝细胞癌 (HCC) 细胞对免疫治疗的耐药性。还有研究显示,TAM 可以释放 细胞外囊泡 (EV) ,将不同种类的 RNA 传递到肿瘤细胞,从而调节细胞表型的获得。然而,由 TAM 分泌的 细胞外囊泡 负载的 circRNA 是否在有氧糖酵解和对 ICB 治疗的抵抗中发挥关键作用,目前尚不清楚。
在这项新研究中,研究团队发现, circPETH (一种来源于低密度脂蛋白受体基因的第13-15号外显子的circRNA) 被包装在 肿瘤相关巨噬细胞 (TAM) 分泌的 细胞外囊泡 (EV) 中,并被肝细胞癌 (HCC) 细胞摄取,从而促进 HCC 细胞的糖酵解和转移 。
此外,该研究还鉴定了一个由 circPETH 编码的蛋白—— circPETH-147aa ,并阐明了其在肝癌代谢重编程和免疫抑制性的肿瘤微环境 (TME) 中的作用。
最后,研究团队通过高通量筛选,发现了 circPETH-147aa 的一个小分子抑制剂—— norathyriol ,并评估了其降低肝细胞癌 (HCC) 对免疫检查点阻断剂 (ICB) 耐药的能力。
从机制上来说,由 circPETH 以 m6A 驱动方式编码了一种新型蛋白—— circPETH-147aa , 通过 MEG 口袋促进 PKM2 催化的 ALDOA-S36 磷酸化。此外,此外,circPETH-147aa 通过增加 HuR 依赖性的 SLC43A2 mRNA 稳定性,并导致细胞毒性 CD8 + T 细胞中甲硫氨酸和亮氨酸缺乏,从而损害抗肝细胞癌免疫。
更重要的是,通过虚拟筛选和实验筛选,研究团队发现了一种小分子—— norathyriol ,可作为 circPETH-147aa 的有效抑制剂。其可逆转 circPETH-147aa 促进的肝细胞癌细胞代谢和转移表型的获得,增强抗 PD-1 单抗的治疗疗效,并提高细胞毒性 CD8 + T 细胞的功能。这些结果表明, norathyriol 是一种很有前景的肝细胞癌 (HCC) 潜在治疗药物,有助于减轻晚期肝细胞癌对免疫检查点阻断剂 (ICB) 的耐药性。
https://www.nature.com/articles/s41467-024-55577-0
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2025/01/09/Nature%E5%AD%90%E5%88%8A%EF%BC%9A%E5%8D%8E%E8%A5%BF%E5%8C%BB%E9%99%A2%E5%90%B4%E6%B3%93-%E5%85%B0%E5%A4%A9%E5%9B%A2%E9%98%9F/
THE END








赶快来坐沙发