Lancet | 中山大学徐瑞华教授团队全球首发!Claudin 18.2 ADC治疗晚期胃癌/胃食管结合部腺癌
【CMT&CHTV 医学前沿·临床经典】
胃癌是全球癌症相关死亡的主要原因之一,尤其是晚期胃癌及胃食管结合部癌患者,其临床预后较差,治疗选择有限。Claudin-18.2(CLDN18.2)是一种在胃癌及胃食管结合部癌中高表达的靶点,其在肿瘤细胞中的表达与肿瘤的侵袭和转移密切相关。近年来,针对CLDN18.2的靶向治疗策略不断涌现,包括单克隆抗体、嵌合抗原受体T细胞(CAR-T)等。这些治疗手段在临床应用中仍存在一定的局限性,如疗效有限、副作用较大等。
抗体-药物偶联物(ADC)是一种将单克隆抗体与细胞毒性药物通过化学连接剂连接而成的新型抗癌药物,其能够将细胞毒性药物精准地递送到肿瘤细胞中,从而在提高疗效的同时降低系统性毒性。CMG901是一种新型的CLDN18.2特异性ADC,由人源化抗CLDN18.2单克隆抗体与微管破坏剂单甲基奥瑞他汀E(MMAE)通过可切割连接剂连接而成。在前期的体外实验和动物模型研究中,CMG901显示出良好的抗肿瘤活性和安全性。
2025年1月6日,中山大学肿瘤防治中心徐瑞华教授团队在《柳叶刀·肿瘤》(The Lancet Oncology)上公布了CMG901治疗晚期胃癌/胃食管结合部腺癌患者的I期临床试验结果。
01
▼
研究设计
该研究是一项多中心、开放标签、单臂、I期临床试验,包括剂量递增和剂量扩展两个阶段。研究共纳入了来自中国31个医院的晚期实体瘤患者,包括胃癌、胃食管结合腺癌患者。纳入患者均为18岁及以上,对标准治疗无效或无可用的标准治疗方案,且ECOG体力状态评分为0-1,预期寿命至少为3个月,且至少有一个可测量的病灶。
患者每3周接受一次静脉注射CMG901,剂量从0.3-3.4 mg/kg(剂量递增阶段)到2.2-3.0 mg/kg(剂量扩展阶段),直至疾病进展、不可接受的毒性反应、开始新的抗肿瘤治疗、退出研究或死亡。研究的主要终点为剂量递增阶段的不良事件和剂量限制性毒性反应,以及剂量扩展阶段的客观缓解率和推荐的II期剂量。
客观缓解定义为经后续影像学检查至少4周后确认的部分或完全缓解。安全性评估包括所有至少接受过一次CMG901治疗且至少有一次用药后安全性评估的患者。抗肿瘤活性评估包括所有至少接受过一次CMG901治疗的患者(全分析集)和所有至少接受过一次CMG901治疗且至少有一次用药后影像学评估且无重大方案偏离的患者(疗效分析集)。
01
▼
研究结果
安全性
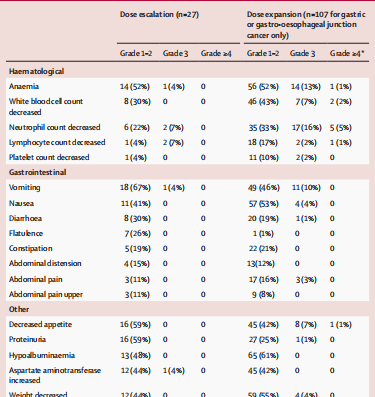
剂量递增阶段: 共纳入27名患者,其中1名患者在2.2 mg/kg剂量下出现剂量限制性毒性反应(3级胰腺炎),未达到最大耐受剂量。所有患者均报告了至少一次治疗相关不良事件,最常见的为呕吐(19名患者,70%)、食欲减退(16名患者,59%)、蛋白尿(16名患者,59%)和贫血(15名患者,56%),5名患者(19%)出现药物相关的3级或更严重的治疗相关不良事件。
表1 安全性(部分)
剂量扩展阶段: 共纳入107名胃癌或胃食管结合部癌患者,73名(68%)患者出现3级或更严重的治疗相关不良事件,54名(50%)患者出现严重不良事件。最常见的3-4级不良事件为中性粒细胞计数减少(22名患者,21%)、贫血(15名患者,14%)和呕吐(11名患者,10%)。报告了一例治疗相关的死亡(脑出血)。
抗肿瘤活性
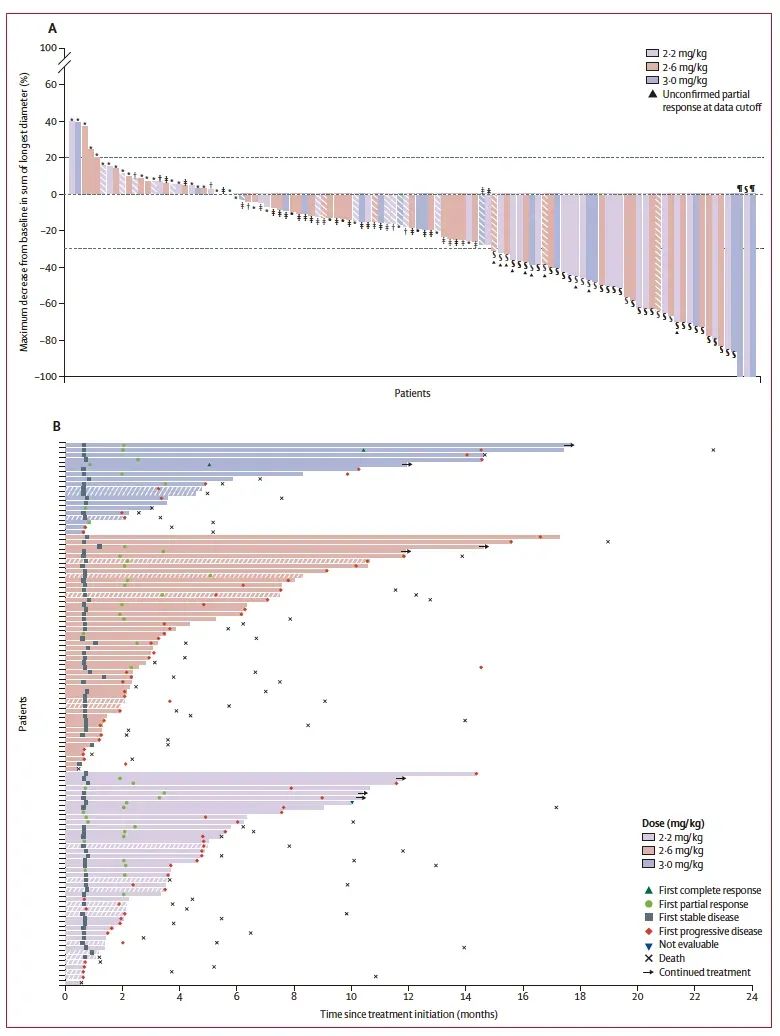
图1 胃癌/胃食管结合部腺癌(A)最佳总体疗效和(B)治疗缓解持续时间
客观缓解率: 在2.2-3.0 mg/kg剂量组的全分析集中,113名患者的确认客观缓解率为28%(95% CI 20-38;32名患者)。在疗效分析集中,109名患者的确认客观缓解率为29%(95% CI 21-39;32名患者)。
疾病控制率 :全分析集中的疾病控制率为63%(71名患者),疗效分析集中的疾病控制率为65%(71名患者)。
中位缓解持续时间: 为7.9个月(95% CI 5.3-10.0)。
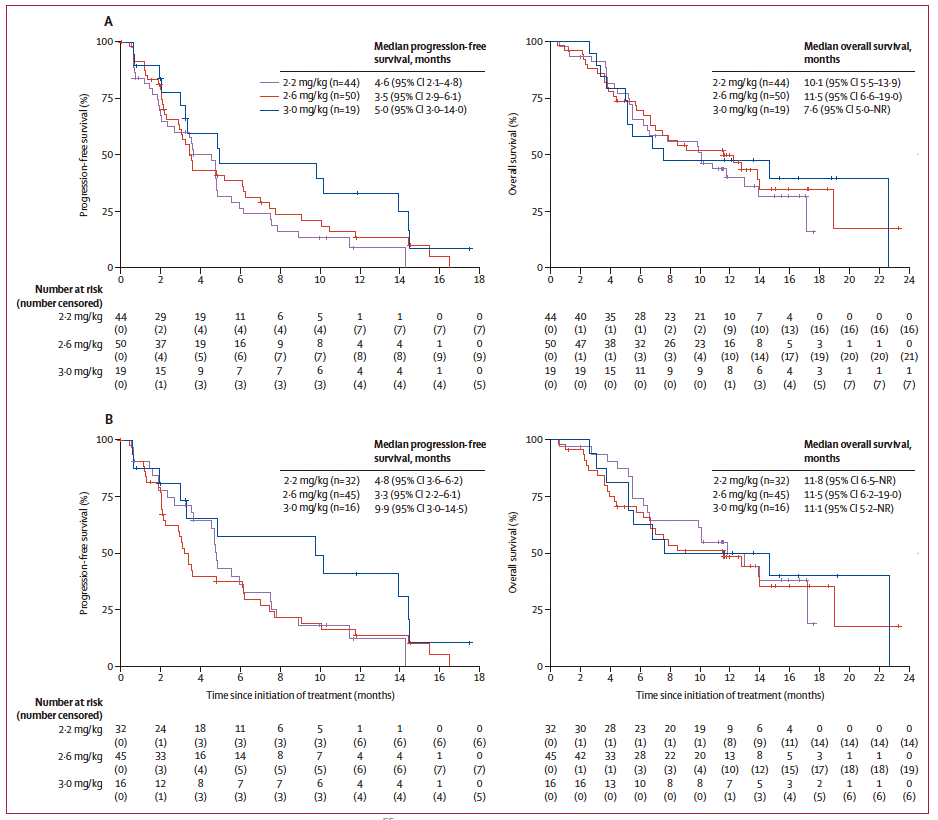
生存结果: 中位随访时间为9.0个月(四分位距4.4-12.9),中位无进展生存期为3.7个月(95% CI 3.3-4.9),中位总生存期为10.1个月(95% CI 6.8-13.9)。
(A)胃癌/胃食管结合部腺癌患者;(B) Claudin 18.2高表达胃癌/胃食管结合部腺癌患者。
CLDN18.2高表达患者亚组分析
客观缓解率: 在93名CLDN18.2高表达患者中,确认客观缓解率为33%(95% CI 24-44;31名患者)。
生存结果: 中位无进展生存期为4.8个月(95% CI 3.4-6.1),中位总生存期为11.8个月(95% CI 7.0-14.7)。
肿瘤缩小情况: 在2.2 mg/kg剂量组的31名患者中,25名(81%)患者出现肿瘤缩小;在2.6 mg/kg剂量组的42名患者中,30名(71%)患者出现肿瘤缩小;在3.0 mg/kg剂量组的16名患者中,14名(88%)患者出现肿瘤缩小。
03
▼
总结讨论
CMG901在晚期胃癌及胃食管结合部癌患者中显示出良好的抗肿瘤活性和可管理的安全性。特别是在CLDN18.2高表达患者中,CMG901的疗效更为显著,提示CLDN18.2表达水平可能是预测CMG901疗效的重要生物标志物。然而,研究也存在一定的局限性,如样本量较小、研究设计为单臂等,未来需要进一步的随机对照试验来验证CMG901的疗效和安全性。此外,CMG901的药代动力学特性表明其在体内的稳定性和生物利用度良好,为后续的临床应用提供了有力的支持。总体而言,CMG901作为一种新型的CLDN18.2靶向ADC,为晚期胃癌及胃食管结合部癌的治疗提供了新的选择,具有广阔的应用前景。
参考文献
RUAN D Y, LIU F R, WEI X L, et al. Claudin 18.2-targeting antibody–drug conjugate CMG901 in patients with advanced gastric or gastro-oesophageal junction cancer (KYM901): a multicentre, open-label, single-arm, phase 1 trial. Lancet Oncol. 2025;26(1):1-12. DOI:10.1016/S1470-2045(24)00636-3.
编辑:赤芍
二审:薄荷
三审:清扬
链接:http://www.lewenyixue.com/2025/01/09/Lancet%20%7C%20%E4%B8%AD%E5%B1%B1%E5%A4%A7%E5%AD%A6%E5%BE%90%E7%91%9E%E5%8D%8E%E6%95%99%E6%8E%88%E5%9B%A2%E9%98%9F/






赶快来坐沙发