华人学者最新Nature论文,揭示雌激素受体调控新机制,为乳腺癌治疗开辟新方向

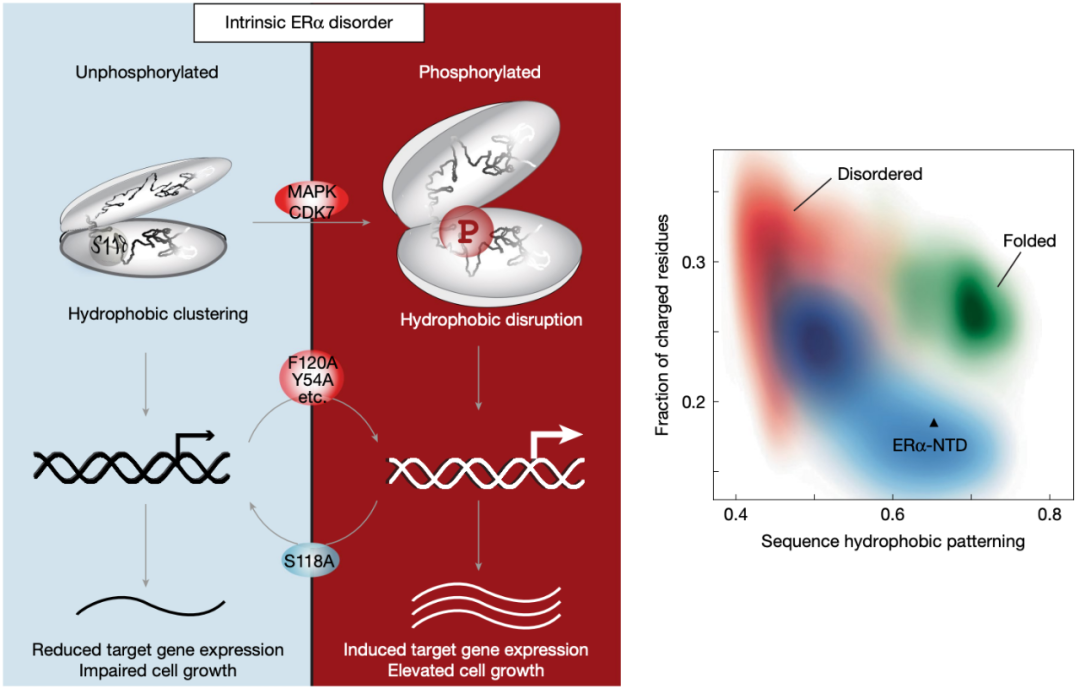
雌激素受体 (ER 或 ERα) 是一种核激素受体,驱动着大多数乳腺癌的发生,其内在无序的 N 端转录激活结构域 (NTD) 内的第 118 位丝氨酸通常会因磷酸化修饰 (pSer118) 而被激活。这种修饰会是雌激素 非依赖性雌激素受体功能得以实现,靶向该结构域的激酶抑制剂正在进行临床试验,然而,这种磷酸化修饰 驱动激活的机制,目前仍不清楚。

乳腺癌 是全球女性癌症相关死亡的主要原因,其主要类型为 雌激素受体阳性 (ER + ) 。
雌激素受体 (ER) 第 118 位丝氨酸的磷酸化修饰 (pSer118) 由 MAPK2 或 CDK7 引起,可使雌激素受体在无配体的情况下被激活。 尽管靶向这种磷酸化的 CDK7 抑制剂在临床试验中已显示出治疗前景,但磷酸化驱动激活的机制基础,目前仍不清楚。
在这项研究中, 研究团队发现,pSer118 通过破坏富含芳香族氨基酸簇之间的疏水相互作用来驱动构象变化,展示了疏水性突变如何恢复 雌激素受体 介导的转录 。
雌激素受体通过两个不同的结构域发挥作用:一个为内在无序的 N 端转录激活结构域 (NTD) ,另一个为结构折叠的 C 端配体结合结构域 (LBD) 。 虽然抗雌激素药物以 LBD 为靶点,但持续的 pSer118 可维持雌激素受体活性。 这种耐药机制促进了 CDK7 抑制剂的开发, 然而,与直接的雄激素受体 NTD 抑制剂不同,目前的 CDK7 抑制剂间接影响 ER-NTD 。
目前的结构生物学技术,例如冷冻电镜和 AlphaFold 等计算工具,都不能有效地表征这些紊乱的结构域,有限的生物物理数据限制了我们对磷酸化触发激活的理解 。
在这项最新 研究中 ,研究团队 通过将小角 X 射线散射和核磁共振光谱学与功能研究相结合,发现 pSer118 化会引发无序结构域的意外扩展,并破坏两个富含芳香族氨基酸区域之间的特定疏水簇集 。也就是说, pSer118 通 过破坏特异性疏水作用而不是静电作用,来调控雌激素受体 活性, 模拟这种破坏的突变可恢复因 S118A 磷酸化缺陷突变而受损的雌激素受体 转录活性、靶基因表 达和细胞生长。
总的来说, 这些由疏水相互作用驱动的发现, 超越了传统认为的 蛋 白质磷酸化主要通过静电作用的调控 模型, 为内在无序蛋白质提供了机制上的见解,并对其他核受体具有重要意义。 这种内在序列-结构-功能关系有助于我们理解雌激素受体的内在无序性,这对于开发有针对性的乳腺癌疗法至关重要。
论文链接 :
https://www.nature.com/articles/s41586-024-08400-1
链接:http://www.lewenyixue.com/2025/01/09/%E5%8D%8E%E4%BA%BA%E5%AD%A6%E8%80%85%E6%9C%80%E6%96%B0Nature%E8%AE%BA%E6%96%87%EF%BC%8C%E6%8F%AD%E7%A4%BA%E9%9B%8C%E6%BF%80%E7%B4%A0/





赶快来坐沙发