放疗患者的营养治疗指南(2024版)
摘 要
放射治疗(以下简称“放疗”)是恶性肿瘤治疗中的关键手段,其效果显著,不仅有效减轻肿瘤负担、缓解相关症状,还可能影响患者的营养状态。放疗可以干扰营养物质的摄入、消化、吸收及代谢,易导致或加剧营养不良,成为放疗患者的常见并发症。鉴于营养不良对预后和生活质量的负面影响,对放疗患者实施系统、规范的营养评估与干预至关重要。在此,营养风险筛查2002(NRS 2002)量表因其科学性与实用性,被推荐为首选筛查工具;而患者主观整体评估(PG-SGA)量表则以其全面性和敏感性,在营养评估中占据重要地位,为个性化营养干预提供依据。针对患者营养状况的动态变化,倡导灵活多变的策略,如适时调整治疗路径、优化肠内与肠外营养治疗、个性化能量与蛋白质需求设定、免疫营养素合理补充,并鼓励患者参与体力活动。这些综合措施旨在全面改善患者围放疗期的营养状况,减轻放疗不良反应,提升患者耐受性,增强肿瘤细胞对放疗的敏感性,从而优化治疗效果,有望提升疗效和改善患者生活质量。
关键词:肿瘤;放疗;营养筛查;营养评估;体重丢失;营养治疗;运动;专家共识
正 文
在恶性肿瘤的综合治疗体系中,放射治疗(以下简称“放疗”)以其高效性与成本效益比,占据着至关重要的地位。然而,放疗对患者营养状况的影响呈现出复杂的双向性。一方面,通过有效减少肿瘤负荷、缓解由肿瘤压迫及梗阻引起的不适,放疗能够显著改善患者的营养摄入状况,促进营养恢复。另一方面,放疗,特别是针对头颈部、胸部、腹部及盆腔区域的治疗,可能诱发一系列不良反应,如头颈部放疗导致的味觉减退、放射性口腔黏膜炎及口干,胸部放疗引发的放射性食管炎,以及腹部与盆腔放疗后出现的放射性肠炎乃至肠功能衰竭等,这些并发症均会对营养物质的摄取、消化、吸收及代谢过程造成干扰,进而诱发或加剧患者的营养不良状态。
营养不良作为恶性肿瘤放疗患者常见的并发症之一,其存在不仅削弱了肿瘤组织对放疗的敏感性,还可能对放疗过程中的精准定位造成不利影响,同时增加了放疗相关不良反应的发生率,降低了患者的治疗耐受性,并最终可能延长其住院治疗时间,对整体治疗效果与患者预后产生负面效应[1]。
鉴于此,对恶性肿瘤放疗患者实施规范且高效的营养治疗策略显得尤为重要。首先,通过系统评估与干预,及时识别并纠正放疗前、中、后各阶段的营养不良状态;其次,减轻放疗带来的不良反应,提升患者的治疗耐受性,减少因不良反应导致的治疗中断,从而确保放疗计划的顺利执行与完成;再者,通过优化营养状况,可能间接增强肿瘤细胞对放射线的敏感性,提升放疗的精准度与疗效,无论是短期还是长期预后均有望得到改善;最后,营养治疗对于提升患者的生活质量亦具有不可忽视的作用,有助于患者在抗癌过程中保持更好的身心状态。综上所述,针对恶性肿瘤放疗患者的营养治疗是综合治疗策略中不可或缺的一环,其重要性不言而喻。
1 证据
1.1 恶性肿瘤放疗患者的营养状况
在恶性肿瘤放疗过程中,患者营养状况的变化,尤其是体重的丢失,已成为评估其营养不良状态的关键指标之一。多项研究对此进行了详尽探讨,为我们提供了丰富的数据支持。Mallick I等[1]的研究揭示,接受根治性放疗的头颈部恶性肿瘤患者在治疗过程中,平均体重丢失达到3.8%,且其中超过1/3(37.9%)的患者体重丢失超过5.0%。这一发现强调了放疗对头颈部肿瘤患者营养状态的显著影响。Vangelov B等[2]通过回顾性分析,对134例接受放疗±同步化疗±手术的口咽癌患者的体重变化进行了深入研究。结果显示,严重体重丢失(1个月内下降≥5%)的发生率高达67%,其中更有26%的患者体重丢失超过10%。同步放化疗的患者相较于仅接受放疗的患者,体重丢失更为显著(P=0.001),这提示了同步治疗方案的潜在不良反应。Qiu C等[3]的研究聚焦于初诊鼻咽癌放疗患者,纳入159例样本进行分析。结果显示,在治疗前3个月,已有超过半数(56%)的患者体重丢失超过5%;而治疗结束后,患者平均体重丢失更是达到了6.9kg(范围2.1~12.6kg),进一步凸显了放疗对鼻咽癌患者营养状况的负面影响。Jiang N等[4]的研究则针对中晚期食管癌患者展开,发现40.3%的患者在放疗过程中体重丢失≥5%。同时,该研究还指出,膳食咨询、早期肿瘤分期及总能量摄入≥1441.3kcal/d是减少体重丢失的保护性因素,为临床干预提供了重要依据。Di FA等[5]的研究进一步扩展了对食管癌同步放化疗患者营养状况的认识。研究发现,在治疗期间,患者的体重、体质指数(body mass index,BMI)及血清白蛋白水平均呈现明显下降趋势,且体重丢失程度与肿瘤T分期密切相关,这为理解肿瘤分期与营养状况之间的关系提供了新的视角。Kiss N等[6]的研究则关注于小细胞和非小细胞肺癌患者,通过回顾性分析96例接受高姑息或根治性放疗的患者的体重变化,发现患者体重平均减轻8%(范围5%~19%),且体重丢失≥5%的患者占比达到31%。该研究还指出,同期化疗和疾病分期晚是体重丢失≥5%的危险因素,为临床决策提供了重要参考。Cacicedo J等[7]的研究则对129例不同部位肿瘤患者的体重变化进行了全面评估。发现其平均体重丢失分别为0.68kg和1.6kg。放疗过程中,头颈部肿瘤相对于其他部位肿瘤有更高的平均体重丢失(2.6kg比0.7kg,P=0.028)。放疗后的1个月中,头颈部肿瘤患者的平均体重丢失为3.7kg,其余患者为1.1kg(P=0.034)。这一发现强调了针对不同肿瘤部位制订个性化营养干预策略的重要性。综上所述,恶性肿瘤放疗患者的营养状况受到多种因素的影响,体重丢失作为其核心表现之一,其发生频率、程度及影响因素在不同肿瘤类型、治疗阶段及患者特征间差异有统计学意义。
在肿瘤学领域,主观整体评估(subjective global assessment,SGA)与患者主观整体评估(patient-generated subjective global assessment,PG-SGA)作为关键工具,对于评估肿瘤患者营养状况具有不可替代的价值。Unsal D等[8]的研究,通过使用SGA对207例不同部位恶性肿瘤的患者在放疗前后的营养状态进行了详尽评估。研究结果显示,放疗前营养不良的发生率为31%,而放疗后这一比例显著上升至43%,揭示了放疗对患者营养状况的不良影响。头颈部肿瘤患者群体在放疗后营养不良的发生率急剧增加,从放疗前的24%升至放疗后的88%,强调了该部位肿瘤患者在放疗期间面临的特殊营养挑战。此外,Hill A等[9]的研究聚焦于73例接受放疗的胃肠道肿瘤患者,采用PG-SGA进行评估,发现高达75.5%的患者经历了不同程度的体重减轻。这一发现进一步指出,放疗过程中出现的非计划性中断及未能完成预定化疗周期的患者,其体重丢失更为显著。尤为关键的是,研究证实了放疗不良反应与PG-SGA评分之间存在高度相关性(r=0.839,P<0.001),强调了营养评估在预测放疗不良反应中的重要性。
营养不良不仅削弱了肿瘤细胞的放射敏感性,还增加了放疗摆位误差的风险,降低了患者的治疗耐受性和近期疗效。脂代谢在放射抗拒现象中扮演着复杂而重要的角色,其机制尚待深入探究。同时,辐射对蛋白质的影响亦不容忽视,包括直接和间接两方面:直接影响涉及蛋白质结构与功能的改变,以及合成与降解过程的扰动,特别是蛋白质的翻译后修饰;间接影响则体现在对患者全身营养水平的广泛调控,涵盖了蛋白质的摄入、消化、吸收及代谢等多个环节[10-11]。营养不良已被确认为肿瘤局部复发及低生存率的独立危险因素。因此,对所有接受放疗的恶性肿瘤患者实施常规且动态的营养风险筛查与评估,以便及时启动并调整营养治疗策略,对于优化患者预后、提升生活质量具有至关重要的意义。这一举措不仅能够减轻放疗的不良反应,还可能通过改善营养状况来增强治疗效果,为患者带来更为积极的治疗结局。
1.2 恶性肿瘤放疗患者营养风险筛查和营养评估
在恶性肿瘤放疗管理的综合框架中,营养风险筛查与评估占据着举足轻重的地位。欧洲肠外肠内营养学会(European Society for Parenteral and Enteral Nutrition,ESPEN)所倡导的营养风险筛查2002(nutritional risk screening 2002,NRS 2002)已成为一般成年住院患者营养风险评估的标准工具[12]。该筛查体系明确指出,当NRS 2002总分≥3分时,即提示存在营养风险,需进一步实施详尽的营养评估。营养评估的核心目的在于明确患者是否存在营养不良及其具体程度,常用的评估量表包括SGA与PG-SGA等。SGA作为美国肠外与肠内营养学会(American Society for Parenteral and Enteral Nutrition,ASPEN)推荐的临床营养评估手段[13],其设计初衷在于识别并分级营养不良状况。而PG-SGA被美国糖尿病学会(American Diabetes Association,ADA)及中国抗癌协会肿瘤营养与支持治疗专业委员会共同推举为肿瘤患者营养状况评估的首选方法。
PG-SGA评分与放疗患者的临床结局紧密相关。Bahl A等[14]研究在局部晚期头颈部肿瘤患者中验证了这一点,发现放疗前PG-SGA评分<9分的患者,其3~4级放射性黏膜炎的发生率显著低于高分组(21.8%比55.5%,P=0.01),且完全缓解率更高(P=0.05),尽管在生存期上的延长未达到统计学显著性(P=0.49)。多变量分析进一步确认了PG-SGA<9分与更佳的局部控制率及较低的急性放射性不良反应之间的关联。此外,Barthelemy N等[15]对肺癌放疗患者采用NRS 2002和PG-SGA评估患者营养状况并进行对比分析,结果显示两种量表得出的结果具有一致性。Isenring E等[16]对60例恶性肿瘤放疗患者采用PG-SGA和SGA评估,发现两种量表评估的患者营养状况结果一致,且均表明放疗后患者的营养状况较治疗前显著恶化,并直接影响其生活质量。
Zhang LC等[17]的综述指出,头颈部肿瘤放疗患者常面临急性营养相关不良反应的挑战,强调建立预测模型以识别高危患者群体的重要性。尽管现有模型在预测性能方面展现出中等至良好的表现,但预测因子的不全面、结果间的不一致性以及潜在的偏倚风险仍是亟待解决的问题。
鉴于当前尚无专门针对肿瘤放疗患者的特异性营养风险筛查与评估工具,《恶性肿瘤放疗患者肠内营养治疗专家共识》[18]与《肿瘤放疗患者口服营养补充专家共识》[19]均一致推荐采用NRS 2002作为营养风险筛查的首选量表,而PG-SGA则作为营养评估的标准工具,以期为患者提供更加精准、有效的营养治疗与干预策略。
1.3 恶性肿瘤放疗患者的营养治疗路径
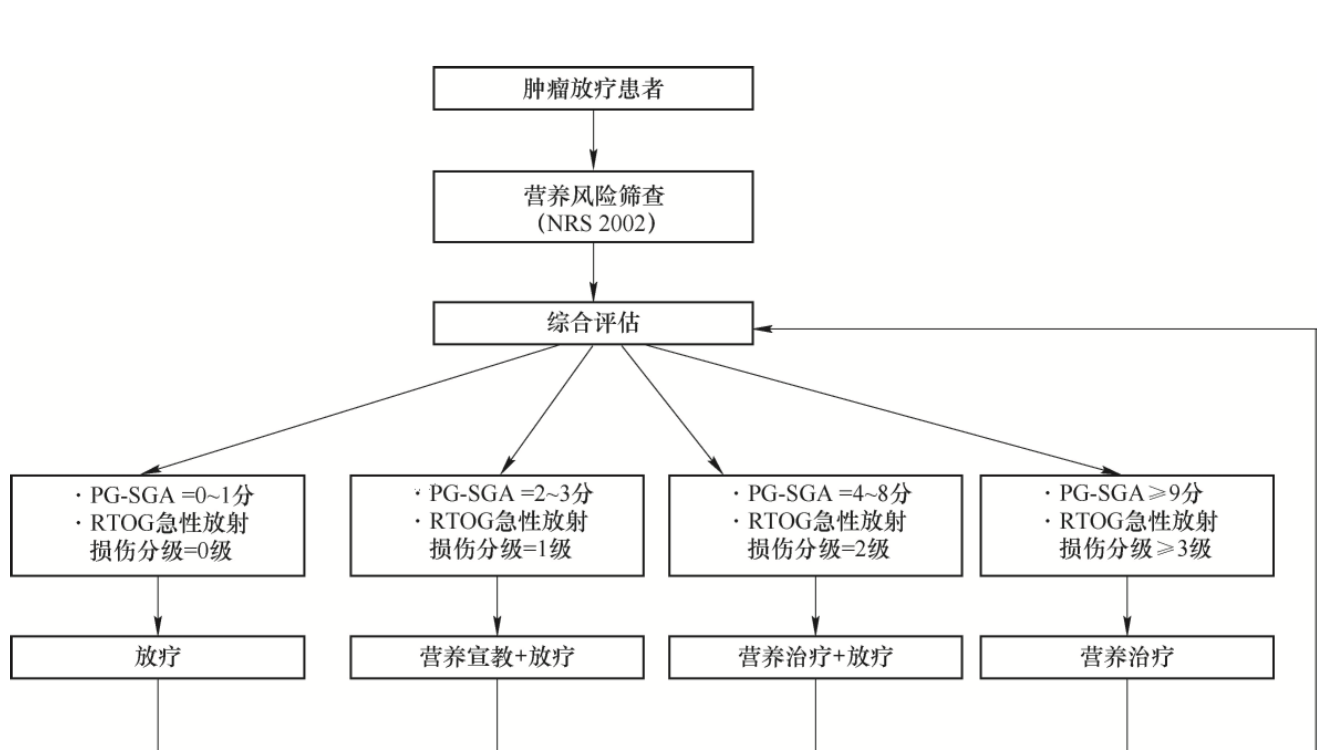
PG-SGA评分作为评估肿瘤患者营养不良存在与否及其严重程度的核心工具,其重要性不言而喻。同时,美国肿瘤放射治疗协作组(Radiation Therapy Oncology Group,RTOG)所制订的急性放射损伤分级标准,不仅是衡量放疗患者所受放射损伤严重程度的权威标尺,也是评估患者营养状态不可或缺的参考维度,它深刻影响着患者对营养物质的摄入能力、消化效率及代谢状态。鉴于此,针对恶性肿瘤接受放疗的患者,在实施营养干预措施之前,全面而细致地评估其个体化的营养状况(依据PG-SGA评分)及放疗过程中伴随的急性放射损伤程度(依据RTOG分级)显得尤为关键。
值得注意的是,放疗期间,患者的营养状况与放射性损伤分级均处于动态变化之中,这就要求采取持续监测与再评价的策略,以确保能够精准捕捉这些变化,并据此灵活调整治疗方案与路径(图1),从而最大化地优化患者的治疗效果与生活质量。这一过程不仅体现了个性化医疗的精髓,也是实现精准放疗与营养治疗协同作用的重要保障。
1.4 恶性肿瘤放疗患者肠内营养的途径
国内外权威营养指南一致推荐口服营养补充(oral nutritional supplements,ONS)作为放疗患者的首选营养干预手段。当ONS无法充分满足患者的营养需求时,应考虑管饲营养作为补充。然而,关于管饲的最佳启动时机及放疗前预防性置管的有效性,当前证据尚不充分。针对多数恶性肿瘤患者而言,放疗前的常规预防性营养管置入并未在提升营养状况、增强治疗效果或降低放疗中断率方面展现出显著优势,反而可能增加患者负担。Vangelov B等[20]回顾性研究深入分析了131例接受放疗±化疗的晚期口咽癌患者,对比了预防性管饲与反应性管饲(根据治疗反应适时置管)的效果。结果显示,接受双侧颈部淋巴结照射(P=0.001)及同步放化疗(P=0.038)的患者更倾向于采用反应性管饲。尽管预防性管饲组患者的体重丢失(5.2%±4.7%)显著低于反应性管饲组(9.5%±3.4%,P<0.001),但两者在5年生存率上并无显著差异。因此,对于接受双侧颈部淋巴结照射及同步放化疗的患者,预防性管饲可作为一种考虑选项。Jiang W等[21]的前瞻性RCT进一步证实了ONS在局部晚期鼻咽癌放化疗患者中的积极作用,显示ONS组在减少体重丢失、减缓BMI下降及增加蛋白质摄入量方面均显著优于对照组。此外,Yokota T等[22]的研究揭示了西妥昔单抗联合放疗治疗下,局部晚期头颈部鳞状细胞癌患者面临的高口腔黏膜炎风险(≥3级占比85.7%),其中多数患者需接受营养治疗,提示了预防性营养管理的重要性。综合考虑,对于存在显著体重下降(1个月内>5%或6个月内>10%)、BMI<18.5kg/m2、严重吞咽障碍或疼痛、严重厌食,以及预期将发生严重放射性口腔或食管黏膜炎的头颈部肿瘤患者,放疗前预防性置入营养管应作为可选方案。
在管饲方式的选择上,经皮胃/空肠置管术(percutaneous gastric / jejunal catheterization was performed,PEG/J)与鼻胃管(nasogastric tube,NGT)各有优劣。两者在维持体重方面效果相当,但NGT对吞咽功能影响较小,成本更低,然而其使用期限受限(通常不超过1个月),且可能影响患者的社交与生活质量,导致依从性降低。相比之下,PEG/J使用期限更长,移位风险低,可能提升患者生活质量,但成本较高[23],并伴随造瘘口感染、疼痛及皮肤损伤等风险,还可能延迟放疗后饮食恢复。因此,对于恶性肿瘤放疗患者,初始倾向于选择NGT;若NGT无法满足需求或需长期营养支持,则转而考虑PEG/J[24]。对于头颈部肿瘤放疗患者及需长期(>30d)肠内营养的患者,PEG/J应作为优先选项。
1.5 恶性肿瘤放疗患者部分或全肠外营养的时机
在患者胃肠道功能健全的情况下,肠内营养应作为首选的营养治疗方式。ESPEN与ASPEN均明确指出,对于放疗患者而言,并不推荐常规性地采用肠外营养作为营养干预手段[12,25]。然而,当肠内营养无法充分提供或无法实施时,联合部分或完全肠外营养成为必要选择,旨在提升能量与蛋白质的摄入量,有效减少或规避负氮平衡及喂养不足等不良状况的发生。《恶性肿瘤患者的营养治疗专家共识》则进一步细化了肠外营养的适用场景,明确指出其应针对那些确实需要营养治疗但无法耐受肠内营养的患者群体,如放疗后罹患严重黏膜炎或放射性肠炎的患者[26]。至于肠外营养的具体启动时机,目前学术界尚存一定争议。《成人补充性肠外营养中国专家共识》则为此提供了明确的指导原则[27]:对于通过NRS 2002评分≥5分或危重症营养风险(nutrition risk in the critically ill,NUTRIC)评分≥6分判定为高风险的患者,若肠内营养在启动后的48~72h内未能达到目标能量与蛋白质需求量的60%,则建议尽早启动肠外营养治疗。相反,对于NRS 2002评分≤5分或NUTRIC评分≤6分的低风险患者,肠外营养的补充性治疗应更为审慎,仅在肠内营养持续超过7d仍无法满足目标能量与蛋白质需求量的60%时,方考虑启动。
1.6 恶性肿瘤放疗患者能量和蛋白质需求
在恶性肿瘤住院患者的能量管理中,推荐以间接能量测定法所得基础代谢率为基础,并综合考量患者的活动水平及疾病应激状态来精确设定目标能量。依据《中国肿瘤营养治疗指南2015版》[28]、中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)肿瘤营养治疗专家委员会发布的《恶性肿瘤患者的营养治疗专家共识》[26]及ESPEN指南[12]的共识,对于无法进行个体化经食管超声心动图(transesophageal echocardiography,TEE)测量的放疗患者,建议能量摄入目标设定为25~30kcal/(kg·d)。
放疗过程中,患者的能量需求呈现出动态变化的特点,这一变化紧密关联于放疗进程及不良反应的显现与消退[29-31]。具体而言,头颈部肿瘤患者在放疗初期(前3周),由于肿瘤负荷的减少及高代谢状态的初步遏制,能量需求趋于下降;而进入放疗中期(第4至9周),随着放疗不良反应的逐渐显现,能量需求相应增加;至放疗结束,若肿瘤得到有效控制且不良反应逐步缓解,患者的能量需求则逐渐回归至正常水平。因此,放疗患者的能量摄入目标需依据肿瘤负荷、应激状态及急性放射损伤程度进行个体化设定,并实施动态调整策略。
鉴于肿瘤患者普遍存在蛋白质合成与分解代谢失衡,特别是对于进展期患者,蛋白质分解常超过合成,部分患者甚至进入恶液质状态,蛋白质需求量的确定需充分考虑代谢应激因素及蛋白质消耗程度。ESPEN指南推荐,肿瘤患者的蛋白质最低摄入量应不低于1.0g/(kg·d),目标摄入量则建议设定在1.2~2.0g/(kg·d)之间,而关于更高蛋白质摄入对临床转归的直接影响,目前尚不明确[12]。对于并发恶液质的放疗患者,其骨骼肌量持续下降,处于蛋白质及能量负平衡状态,因此应进一步提升蛋白质摄入量至2.0g/(kg·d)[32]。此外,放射线对机体蛋白质代谢具有显著影响,受照射肌肉可出现急性萎缩反应,表现为肌球蛋白含量减少及肌球蛋白重链比例变化,且这些变化与放射剂量密切相关。放疗后肌肉含量的减少已被证实与患者预后密切相关[33]。然而,关于放疗患者是否需要超过2.0g/(kg·d)的更高蛋白质摄入量,目前尚缺乏确凿证据支持。
1.7 免疫营养素
“肿瘤免疫营养”疗法改善了患者的营养状况和免疫功能。免疫营养治疗作为一种创新的肿瘤辅助疗法,旨在通过特定营养素的补充来改善肿瘤患者的营养状况,并精细调控机体的免疫与炎症反应。中国专家基于严谨的循证医学实践,制订了肿瘤免疫营养治疗的临床实践指南,旨在为医疗工作者提供一套全面且详尽的操作规范,不仅拓宽了免疫营养治疗在肿瘤管理中的应用范畴,还促进了其在临床实践中的标准化实施。
Eda K等[34]通过一项针对40例乳腺癌放疗患者的RCT指出,与安慰剂组相比,谷氨酰胺治疗组在降低2级(11.1%比80.0%,P<0.001)及预防3级(0%比20%,P<0.001)放射性皮肤损伤方面展现出显著优势。类似地,Imai T等[35]的研究聚焦于头颈部肿瘤放疗患者,发现补充β-羟基甲基丁酸、精氨酸和谷氨酰胺的干预组相较于对照组,在≥3级放射性皮炎发生率上无显著差异,但显著降低了2级皮炎的发生率(62.6%比94.4%,P<0.05),并缩短了≥1级及≥2级皮炎的持续时间(P<0.05)。然而,Lopez-Vaquero D等[36]的双盲RCT则表明,谷氨酰胺未能减少头颈部肿瘤患者口腔黏膜炎的发生,但显著降低了放射性皮炎的发生率(84%比100%,P=0.038)。
进一步地,Leung HW等[37]的荟萃分析综合了5项研究,涉及234例头颈部肿瘤放疗患者,结果显示谷氨酰胺在减轻放射性口腔黏膜炎的严重程度及风险上优于安慰剂或空白对照。Pattanayak L等[38]的研究也支持了这一点,发现谷氨酰胺组头颈部鳞癌放疗患者的3级口腔黏膜炎发生率及多种不良反应的发生率均显著降低,且镇痛药及管喂需求减少。Sayles C等[39]的系统评价则进一步扩展了谷氨酰胺的应用范围,指出在化疗和/或放疗患者中,口服7.5~30.0g/d谷氨酰胺能显著降低口腔黏膜炎的严重程度、持续时间和发作频率,而对恶心、呕吐等不良反应的影响则与对照组相当。
在肺癌放疗领域,一项针对46例患者的RCT[40]及Topkan E等[41]的回顾性研究均强调了预防性口服谷氨酰胺对降低放射性食管炎严重程度的积极作用,并延迟了其发生时间。De Urbina J等[42]的研究显示谷氨酰胺能减轻腹部放疗引起的炎症反应和自噬反应,但对肠道黏膜的直接保护作用尚不确定。Vidal-Casariego A等[43]的研究则意外发现,谷氨酰胺组放射性肠炎的发生率高于对照组(55.9%比22.0%,P=0.002)。Cao DD等[44]的系统评价也未能确认谷氨酰胺对放射性肠炎治疗的显著优势。
口服谷氨酰胺可降低放射性皮炎的发生率,对直肠癌患者放疗相关胃肠道毒性的发生具有保护作用。但RCT发现口服谷氨酰胺并未改善晚期胸部恶性肿瘤患者接受食管放疗的放射性食管炎严重程度、体重减轻、头颈部特异性症状[45-47]。
此外,ω-3多不饱和脂肪酸(ω-3 polyunsaturated fatty acids,ω-3 PUFA)作为另一种重要的营养干预手段,在放疗期间的应用亦受到广泛关注。ω-3 PUFA包括亚麻酸(alpha linolenic acis,ALA)、二十碳五烯酸(eicosapentenoic acid,EPA)和二十二碳六烯酸(docosahexoenoic acid,DHA),其补充有助于维持或增加体重、增强免疫力、减轻炎症反应,从而提升患者生活质量[48-49]。Fietkau R等[50]的研究表明,富含ω-3 PUFA的肠内营养配方在改善食管癌和头颈部肿瘤患者的营养状况及生活质量方面优于标准配方。然而,ω-3 PUFA在缩小肿瘤体积和延长生存期方面的优势尚未得到充分证实[48]。
1.8 维生素C
大剂量维生素C联合治疗在安全性及抗肿瘤疗效方面也展现出初步潜力,特别是在缓解重度放射性黏膜炎症状方面表现突出[51-52]。
1.9 运动
在传统肿瘤治疗体系中,手术、放疗及化疗虽为基石,却常伴随患者生活质量的显著下降、身体功能受损,以及严重的心理困扰,如焦虑与抑郁。在此背景下,运动疗法作为一种辅助治疗手段,展现出了在优化肿瘤患者预后、提升生活质量方面的巨大潜力,其适用范围广泛,涵盖了从围手术期康复至临终关怀的全过程。尽管个体生活方式差异及其他混杂因素的存在使得单独评估运动效果面临挑战,但现有数据一致表明,持续且规律的运动实践能够显著改善肿瘤患者的临床预后。
具体而言,运动通过强化心肺功能、促进蛋白质合成、优化生理功能及增强生理储备,为肿瘤患者带来多方面的生理益处。同时,运动还能有效调节新陈代谢,增强免疫功能,从而在机体内营造一个更加有利于抗癌的微环境。此外,制订并实施合理的运动计划,能够针对性地减轻肿瘤治疗带来的多种不良反应,如生理功能的减退、疲劳感的加剧等,进而全面提升患者的生活质量[53]。
八段锦作为源自中国的传统健身技艺,以其独特的身心并调优势,成为了肿瘤患者运动干预中的一项重要选择。作为一种中低强度的有氧运动,八段锦不仅能够有效促进患者身体健康,还能在心理层面发挥积极的调节作用。研究表明,对于接受放疗的鼻咽癌患者而言,八段锦的练习有助于改善其营养状况,并显著降低治疗过程中的不良反应发生率[54],从而进一步证明了其在肿瘤综合治疗中的应用价值。
2 推荐意见
(1)恶性肿瘤放疗患者营养不良发生率高,对治疗的疗效和不良反应影响大,应常规进行营养风险筛查和营养评估。(A)
(2)恶性肿瘤放疗患者营养风险筛查推荐采用NRS 2002量表,营养评估推荐采用PG-SGA量表。(A)
(3)不需要对所有恶性肿瘤放疗患者常规进行营养治疗,而是应该在综合评估患者的营养状况(PG-SGA评分)和放射损伤(RTOG分级)的基础之上,进行及时和合理的营养治疗。(A)
(4)ONS是恶性肿瘤放疗患者首选营养治疗方式。不推荐放疗前常规预防性置入营养管。如果头颈部及胸部肿瘤放疗患者存在以下一种或多种情况时可以考虑预防性置入营养管:明显体重丢失(1个月内>5%或者6个月内>10%)、BMI<18.5kg/m2、严重吞咽梗阻或疼痛、严重厌食、头颈部肿瘤预期将发生严重放射性口腔或食管黏膜炎者。(B)
(5)对于管饲营养患者,首选NGT。当NGT无法满足营养需求或患者需要长期人工喂养(>30d)或头颈部肿瘤放疗患者,可优先选择PEG/PEJ。(B)
(6)对于肠内营养可达到正常营养需要量的恶性肿瘤放疗患者,不推荐常规进行肠外营养治疗。当患者无法通过肠内营养(如严重放射性黏膜炎、放射性肠炎或肠衰竭)获得足够的营养需要时,则需联合部分肠外或全肠外营养。(A)
(7)恶性肿瘤放疗患者能量摄入目标量推荐为25~30kcal/(kg·d)。在放疗过程中,需要个体化给予能量摄入目标量并进行动态调整。(B)
(8)肿瘤放疗患者推荐的蛋白质摄入量应为1.0~2.0g/(kg·d)。(B)
(9)谷氨酰胺对降低恶性肿瘤放疗患者放射性皮肤损伤、放射性口腔黏膜炎、放射性食管黏膜炎的发生率和严重程度有益,但对于放射性肠炎的预防和治疗作用缺乏足够的临床证据。(A)
(10)恶性肿瘤放疗患者补充富含ω-3 PUFA的肠内营养制剂可能对减少患者炎症反应、保持患者体重有益,但对肿瘤消退和患者生存时间的影响证据不足。(B)
(11)大剂量维生素C治疗放射性黏膜炎可减轻症状,促进黏膜炎恢复。(C)
(12)运动对于放疗患者可以是安全的,并且具有高度的依从性,导致身体成分、代谢参数、力量增加和生活质量的明显改善。(B)
执笔人
周福祥(武汉大学中南医院)
李 涛(四川省肿瘤医院)
廖正凯(武汉大学中南医院)
吕家华(四川省肿瘤医院)
共识专家组成员(以姓氏笔画为序)
于世英(华中科技大学同济医学院附属同济医院)
王 宇(电子科技大学附属医院·四川省人民医院)
石汉平(首都医科大学附属北京世纪坛医院)
丛明华(中国医学科学院北京协和医学院肿瘤医院)
吕家华(四川省肿瘤医院)
庄则豪(福建医科大学附属第一医院)
刘 明(哈尔滨医科大学附属第二医院)
刘凌翔(南京医科大学第一附属医院)
江 华(电子科技大学附属医院·四川省人民医院)
许红霞(陆军军医大学大坪医院)
李 铎(青岛大学营养与健康研究院)
李 涛(四川省肿瘤医院)
李 薇(吉林大学第一医院)
张小田(北京大学肿瘤医院)
陈 伟(中国医学科学院北京协和医院)
周福祥(武汉大学中南医院)
陶晔璇(上海交通大学附属新华医院)
康军仁(中国医学科学院北京协和医院)
廖正凯(武汉大学中南医院)
链接:http://www.lewenyixue.com/2025/01/07/%E6%94%BE%E7%96%97%E6%82%A3%E8%80%85%E7%9A%84%E8%90%A5%E5%85%BB%E6%B2%BB%E7%96%97%E6%8C%87%E5%8D%97%EF%BC%882024%E7%89%88%EF%BC%89/












赶快来坐沙发