当多组学遇上NSCLC耐药:一场改写肺癌治疗格局的革命!
在肺癌治疗的艰难征程中,非小细胞肺癌(NSCLC)的免疫化疗耐药问题犹如一座难以逾越的高山,阻挡着患者迈向康复的道路。然而,近期一项发表于 《Nature Genetics》 的重磅研究 Multi-omic profiling highlights factors associated with resistance to immuno-chemotherapy in non-small-cell lung cancer(10.1038/s41588-024-01998-y) ,宛如一道曙光,为我们照亮了探索这一复杂难题的新路径。今天,就让我们一同深入解读这项研究,探寻其中蕴含的奥秘与希望。在此我们先以 思维导图 为您展示研究的全貌。

一、研究背景与核心问题
肺癌,作为全球癌症死亡的首要元凶,NSCLC 占据了其中的大半壁江山。免疫检查点阻断(ICB)疗法的出现曾给无数患者带来希望的曙光,部分晚期患者甚至因此获得了治愈的可能。但残酷的现实是,仍有大量患者在接受新辅助免疫化疗后未能取得理想的治疗效果,耐药问题成为了横亘在肺癌治疗道路上的关键绊脚石。究竟是什么因素在背后作祟,导致肿瘤细胞对免疫化疗产生抵抗?肿瘤微环境(TME)中复杂的细胞组成和分子机制又在其中扮演着怎样的角色?这些亟待解决的问题成为了本次研究的核心驱动力。
二、研究设计与方法:构建全面解析肿瘤的蓝图
研究团队精心设计了一项前瞻性研究,将目光聚焦于 19 位可切除且不存在 EGFR/ALK 突变的 NSCLC 患者。在新辅助 ICB - 化疗(PD - 1 抑制剂联合铂类化疗)的关键时间节点前后,研究人员如同敏锐的猎手,精准地获取患者的肿瘤组织样本。这一过程严格遵循伦理规范,在获得上海肺科医院伦理委员会批准(K21 - 294)的坚实基础上,确保每位患者都在充分知情并自愿签署同意书后参与研究。
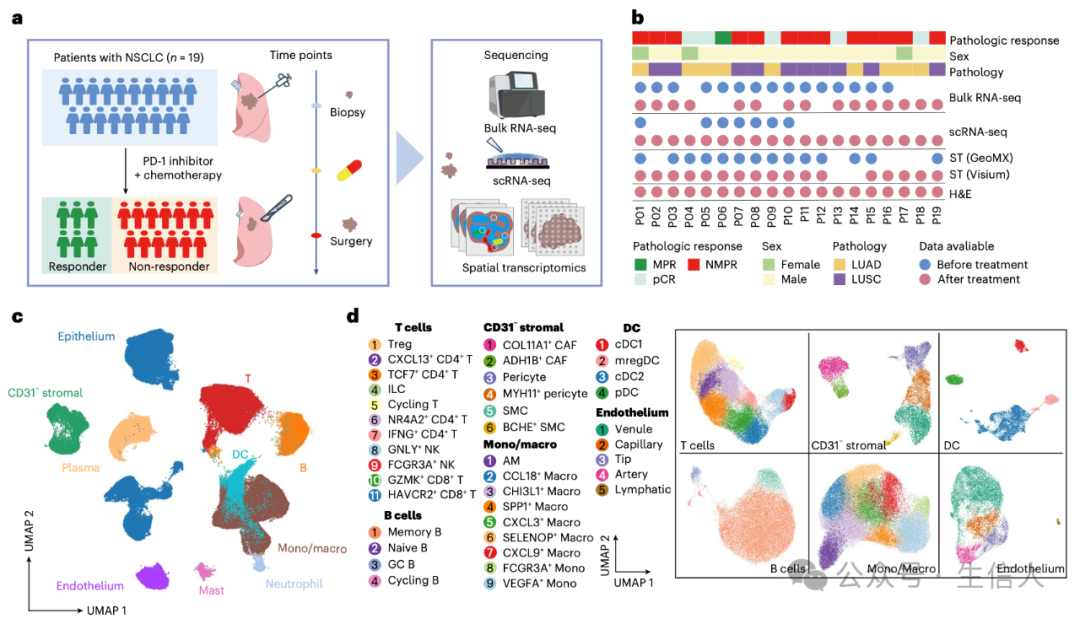 图1
图1 在技术层面,研究采用了单细胞转录组(scRNA - seq)和空间转录组学这两大前沿技术,如同为我们打开了观察肿瘤细胞微观世界的两扇窗户。对于 scRNA - seq,研究人员对数以万计的 26 个肿瘤样本展开深度测序,经过层层严格的质量筛选,成功获取了 232,080 个单细胞转录组数据。而在空间转录组学方面,针对治疗前的 14 个样本,研究团队运用 DSP 平台进行细致分析;对于治疗后的 17 个样本,则采用 10x Genomics Visium 平台深入挖掘。在整个数据处理过程中,从测序数据的初步处理到最终的质量把控,每一个环节都遵循着科学严谨的流程,确保所获得的数据真实可靠,为后续的研究分析奠定坚实基础。
三、肿瘤细胞状态:开启癌细胞异质性的密码锁
通过对 scRNA - seq 数据的深度挖掘和精细分析,研究人员如同技艺精湛的工匠,将癌细胞巧妙地分为 14 个独特的子集,并运用基因集富集分析这一有力工具进行精准注释。研究发现,肿瘤细胞状态呈现出令人惊叹的异质性,宛如一个复杂多变的生态系统。这些状态可清晰地分为两大阵营:其中一组紧密关联着干扰素(IFN)、肺泡、雌激素、细胞外基质和凝血细胞状态;另一组则与鳞状、核因子红细胞 2 相关因子 2(NRF2)靶标和细胞周期相关细胞状态紧密相连。这两组细胞状态分数之间存在着强烈的负相关关系,如同天平两端的砝码,相互制衡。
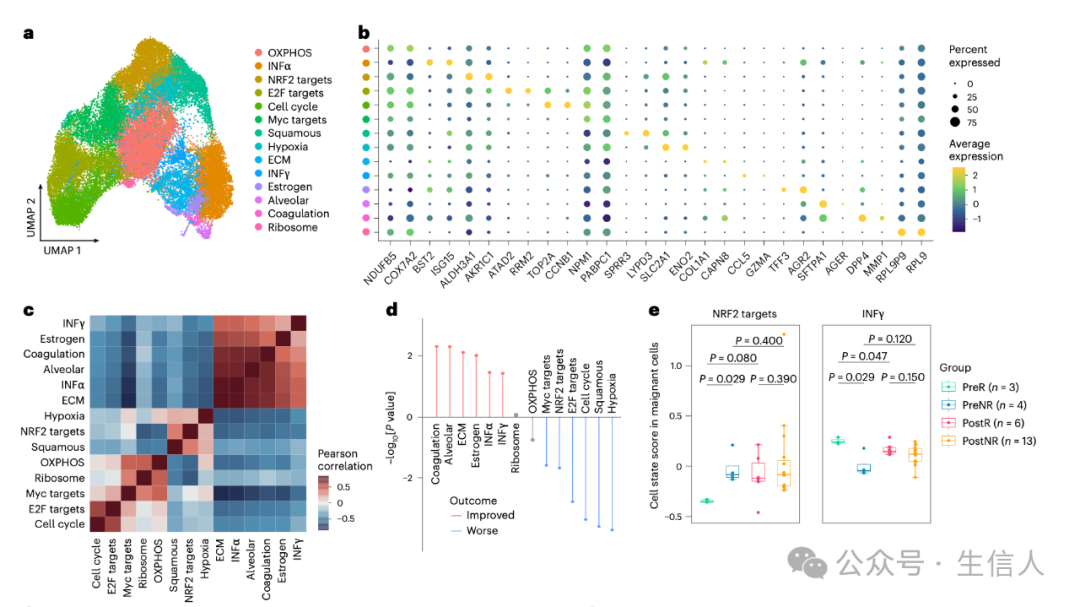 图2
图2 更为重要的是,这些细胞状态与患者的生存预后有着千丝万缕的联系。在对 TCGA - LUAD 队列的深入研究中发现,缺氧、鳞状、细胞周期等细胞状态如同不祥的阴霾,笼罩着患者的生命,与预后不良紧密相关;而凝血、肺泡、细胞外基质等状态则似希望之光,与较长的生存期息息相关(图 2d)。进一步对比免疫治疗过程中癌细胞的细胞状态分数,研究人员发现了一个关键线索:治疗前 NRF2 靶标分数在无应答者中显著高于应答者,而 IFNγ 分数则恰恰相反,在应答者中呈现出更高的水平。这一发现宛如一把钥匙,开启了理解癌细胞生物学特征对免疫治疗临床结果影响的大门。通过 DSP 数据的验证,这一结论得到了进一步的巩固,研究人员还发现 IFNγ 和 NRF2 靶标相关基因在应答者和无应答者中分别呈现出显著富集的现象。空间关系分析更是为我们揭示了癌细胞状态与肿瘤微环境之间的微妙联系,IFNγ 分数与相邻免疫细胞比例呈正相关,仿佛在召唤免疫细胞的聚集;NRF2 靶标分数与相邻免疫细胞比例呈负相关,似乎在排斥免疫细胞的靠近,这充分表明癌细胞状态在塑造肿瘤微环境中发挥着潜在且关键的作用。
四、肿瘤微环境的空间细胞组成:绘制肿瘤内部的细胞地图
利用 Visium 数据这一强大的工具,研究团队对治疗后的 TME 进行了细致入微的分类。依据苏木精 - 伊红(H&E)染色所呈现的特征以及以往研究积累的经验,TME 被精准地划分为四个截然不同的区域:肿瘤核心、浸润边缘、孤立肿瘤和肿瘤间质区域。这就如同在肿瘤内部绘制了一幅详细的地图,每个区域都有着独特的细胞构成和功能特点。通过细胞类型解卷积分析这一先进技术,研究人员发现肿瘤核心区域宛如癌细胞的 “大本营”,主要被恶性细胞所占据;浸润边缘和孤立肿瘤区域则像是敌我双方激烈交锋的 “战场”,包含着恶性和非恶性细胞的混合群体;而肿瘤间质区域则相对平静,几乎看不到恶性细胞的踪迹。
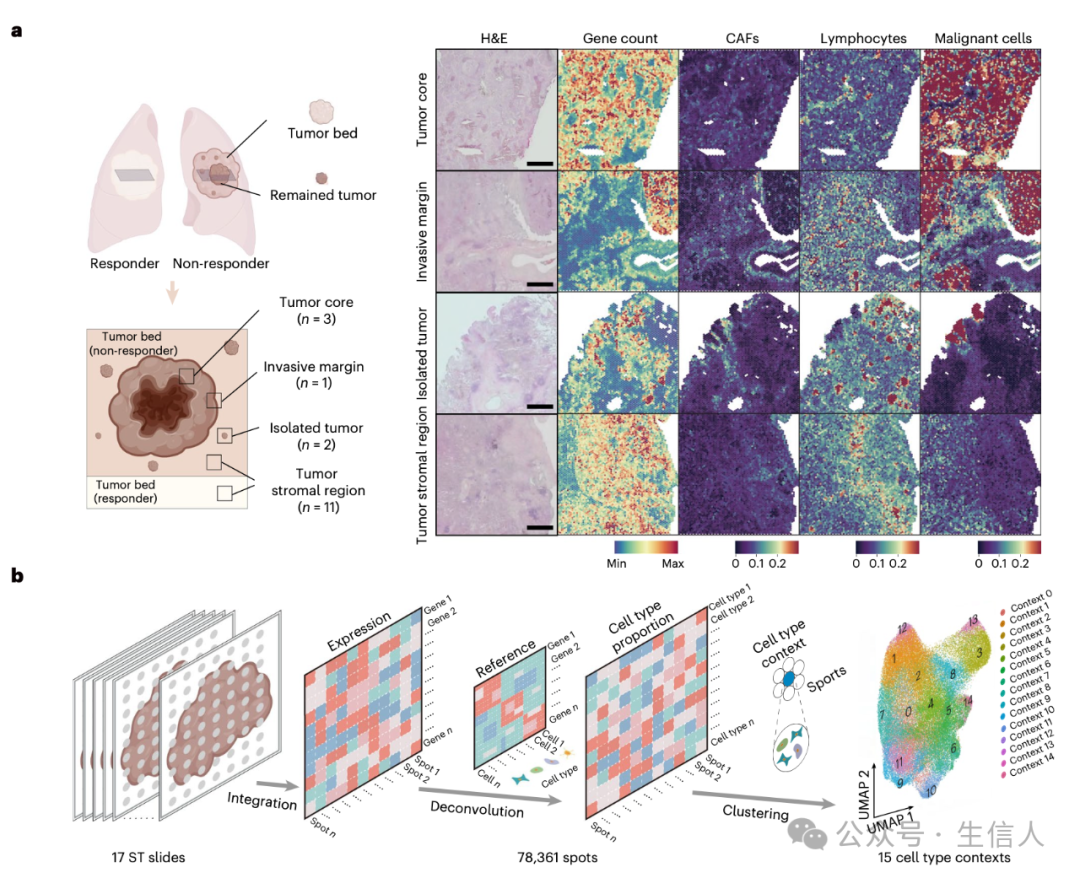 图3
图3 对所有空间转录组学点进行无监督聚类分析后,研究人员成功识别出 15 种不同的细胞类型背景,它们就像是肿瘤微环境中的不同 “部落”,各自有着独特的特征和功能。其中包括三种与恶性相关的细胞类型背景,它们如同癌细胞的 “盟友” 或 “帮凶”,在肿瘤的发展过程中发挥着重要作用;两种成纤维细胞类型背景,它们是肿瘤微环境中的重要 “建筑工人”,参与构建肿瘤的细胞外基质;以及四种免疫细胞类型背景,它们是肿瘤免疫防御和逃逸的关键 “参与者”。通过空间可视化这些背景,研究人员为我们清晰地展示了它们之间的位置关系和与空间结构的相关性。例如,恶性相关背景 3 和 13 被成纤维细胞背景 8 包围,这一现象暗示着肿瘤细胞在肿瘤边界与成纤维细胞之间存在着密切的相互作用,可能在共同构建肿瘤的防御屏障;而富含生发中心 B 细胞和 CD4 + CXCL13 + T 细胞的细胞类型背景 9 的位置与淋巴细胞聚集相对应,这就像在地图上找到了免疫细胞的 “集结点”,为研究肿瘤边界细胞组成和免疫细胞空间结构提供了重要的线索和依据(图 3)。
五、COL11A1 + 癌相关成纤维细胞:肿瘤免疫逃逸的幕后推手
在 NSCLC 的复杂细胞生态中,研究人员敏锐地发现了两种不同的癌相关成纤维细胞(CAFs)亚型:COL11A1 + CAFs 和 ADH1B + CAFs。其中,COL11A1 + CAFs 在无应答者中表现出异常活跃的态势,其比例显著高于应答者,且主要集中在肿瘤边界区域,宛如一群潜伏在肿瘤边缘的 “卫士”,守护着肿瘤细胞免受免疫细胞的攻击。基因集富集分析为我们揭示了 COL11A1 + CAFs 的神秘面纱,它富含缺氧、转化生长因子 β(TGFβ)信号、上皮 - 间质转化和血管生成等一系列基因特征,这些特征就像是它的 “武器库”,赋予了它强大的功能。此外,它还表达 LRRC15,与由 TGFβ 信号诱导的 LRRC15 + CAFs 有着惊人的相似之处,进一步表明了它在肿瘤微环境中的特殊地位。
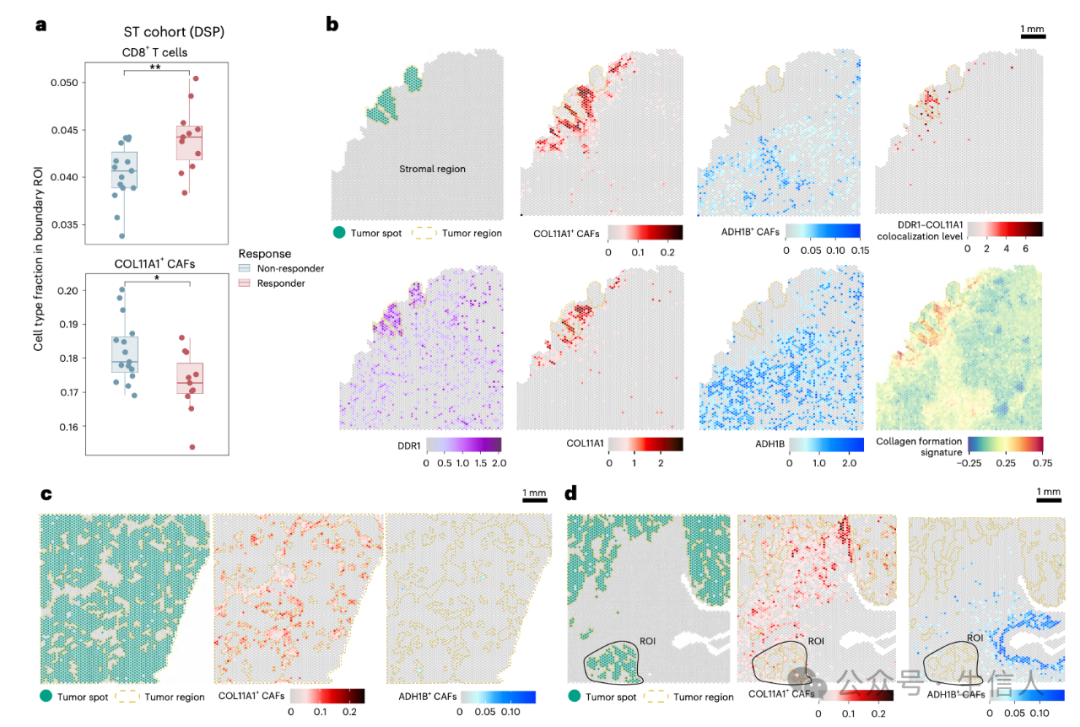 图4
图4 深入研究发现,COL11A1 + CAFs 可能通过与肿瘤细胞表面受体 DDR1 的相互作用,在肿瘤免疫逃逸过程中扮演着关键角色。在肿瘤边界,COL11A1 + CAFs 与 DDR1 的共定位水平以及胶原蛋白形成特征高度富集,仿佛在构建一道坚固的 “城墙”,阻碍免疫细胞的浸润。大量研究数据表明,COL11A1 + CAFs 的丰度与 T 细胞浸润呈显著负相关,这就像一把精准的标尺,衡量着肿瘤的免疫抑制程度。在多个独立队列中的验证结果更是如同一颗颗定海神针,进一步证实了 COL11A1 + CAFs 可作为预测 NSCLC 预后和 ICB 治疗反应的有效生物标志物,为临床医生判断患者病情和制定治疗方案提供了重要的参考依据(图 4)。
六、分泌磷蛋白 1 阳性巨噬细胞:协同作恶的免疫抑制帮凶
在 NSCLC 的肿瘤微环境中,分泌磷蛋白 1 阳性(SPP1 +)巨噬细胞与 COL11A1 + CAFs 之间存在着一种紧密的正相关关系,它们就像一对狼狈为奸的 “搭档”,共同为肿瘤细胞的免疫逃逸保驾护航。scRNA - seq 数据清晰地显示,两者的丰度呈显著正相关,且在无应答者中,SPP1 + 巨噬细胞在治疗前后的比例均显著高于应答者,仿佛在肿瘤微环境中不断壮大自己的势力。
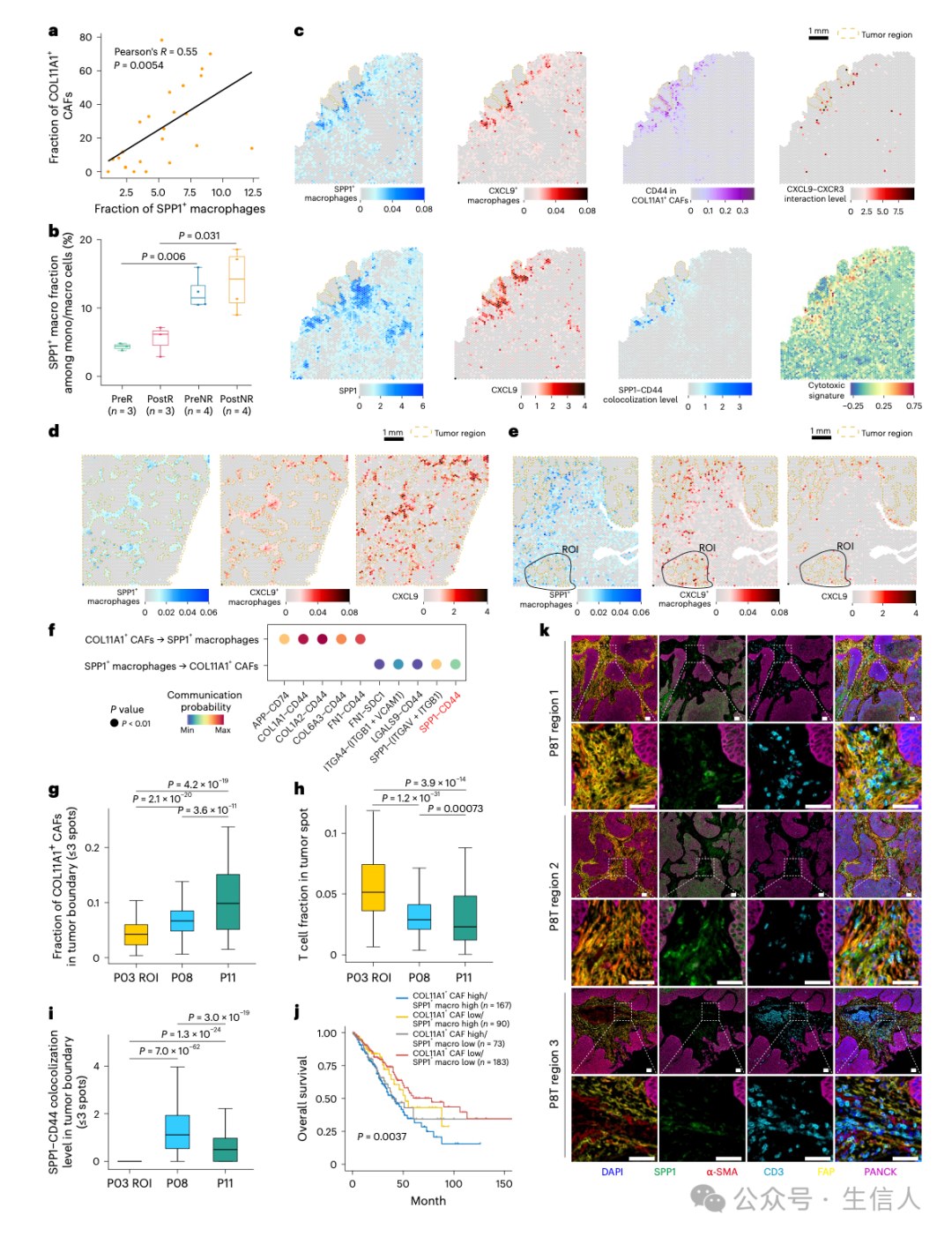 图5
图5 与 COL11A1 + CAFs 类似,SPP1 + 巨噬细胞也喜欢在肿瘤边界聚集,在间质区域则相对低调,丰度较低且分布分散。细胞 - 细胞相互作用分析为我们揭示了它们之间的 “邪恶联盟” 机制,研究人员发现 SPP1 + 巨噬细胞与 COL11A1 + CAFs 之间存在 SPP1 - CD44 配体 - 受体对的富集,这就像一条紧密的纽带,将它们连接在一起。SPP1 作为巨噬细胞分泌的关键蛋白,可促进 CAFs 的增殖和激活,并增加胶原蛋白分泌,进一步加剧肿瘤的免疫抑制环境。在 COL11A1 + CAF 低区域,T 细胞浸润水平较高,SPP1 - CD44 共定位水平显著低于 COL11A1 + CAF 高区域,这一现象充分表明 SPP1 + 巨噬细胞可能与 COL11A1 + CAFs 协同作用,共同阻止 T 细胞浸润肿瘤,如同在肿瘤周围设置了一道无形的 “屏障”。在 TCGA - LUAD 队列中的研究结果更是令人警醒,同时具有高水平 COL11A1 + CAFs 和 SPP1 + 巨噬细胞的患者预后最差,这进一步证实了它们在肿瘤免疫抑制微环境形成中的关键作用,也为未来的治疗靶点选择提供了重要的方向(图 5)。
七、三级淋巴结构:肿瘤免疫中的双刃剑
研究人员在 NSCLC 肿瘤微环境中惊喜地发现了三级淋巴结构(TLSs)的广泛存在,它们就像肿瘤免疫战场上的 “秘密武器库”,在 ICB - 化疗后呈现出不同的成熟阶段。通过综合运用多种先进的分析方法,研究团队将 TLSs 分为早期淋巴聚集、活化 TLSs、衰退 TLSs 和晚期 TLSs 四个阶段,每个阶段都有着独特的分子特征和细胞组成。早期淋巴聚集阶段以高表达淋巴组织诱导细胞(LTi)标记物和低细胞因子表达为特征,仿佛是一支刚刚组建的军队,正在积蓄力量;活化 TLSs 则具有高细胞因子表达,如同军队进入了战斗状态,充满活力;衰退 TLSs 细胞因子表达下降,好似军队在战斗后略显疲惫;晚期 TLSs 细胞因子表达极低,仿佛是一支已经解散的军队,处于休眠状态。
不同阶段的 TLSs 在肿瘤免疫中发挥着截然不同的作用。生发中心 B 细胞、效应记忆 CD4 T 细胞和滤泡辅助 T 细胞是活化 TLSs 的核心力量,对 TLSs 的激活和功能至关重要,它们就像战场上的勇士,冲锋陷阵,积极参与肿瘤免疫反应;而记忆 B 细胞则与 TLSs 的长期效应更为相关,如同军队中的后勤保障部队,为肿瘤免疫提供持续的支持。在无应答者中,随着免疫治疗后残余肿瘤负荷的降低,检测到更多的 TLSs,这一现象暗示着 TLSs 可能具有潜在的抗肿瘤作用,如同在黑暗中闪烁的希望之光;而在病理完全缓解(pCR)患者中,TLSs 较少且几乎都处于晚期阶段,呈现出免疫反应衰退的状态,这又像是一个未解之谜,引发了研究人员的深入思考。
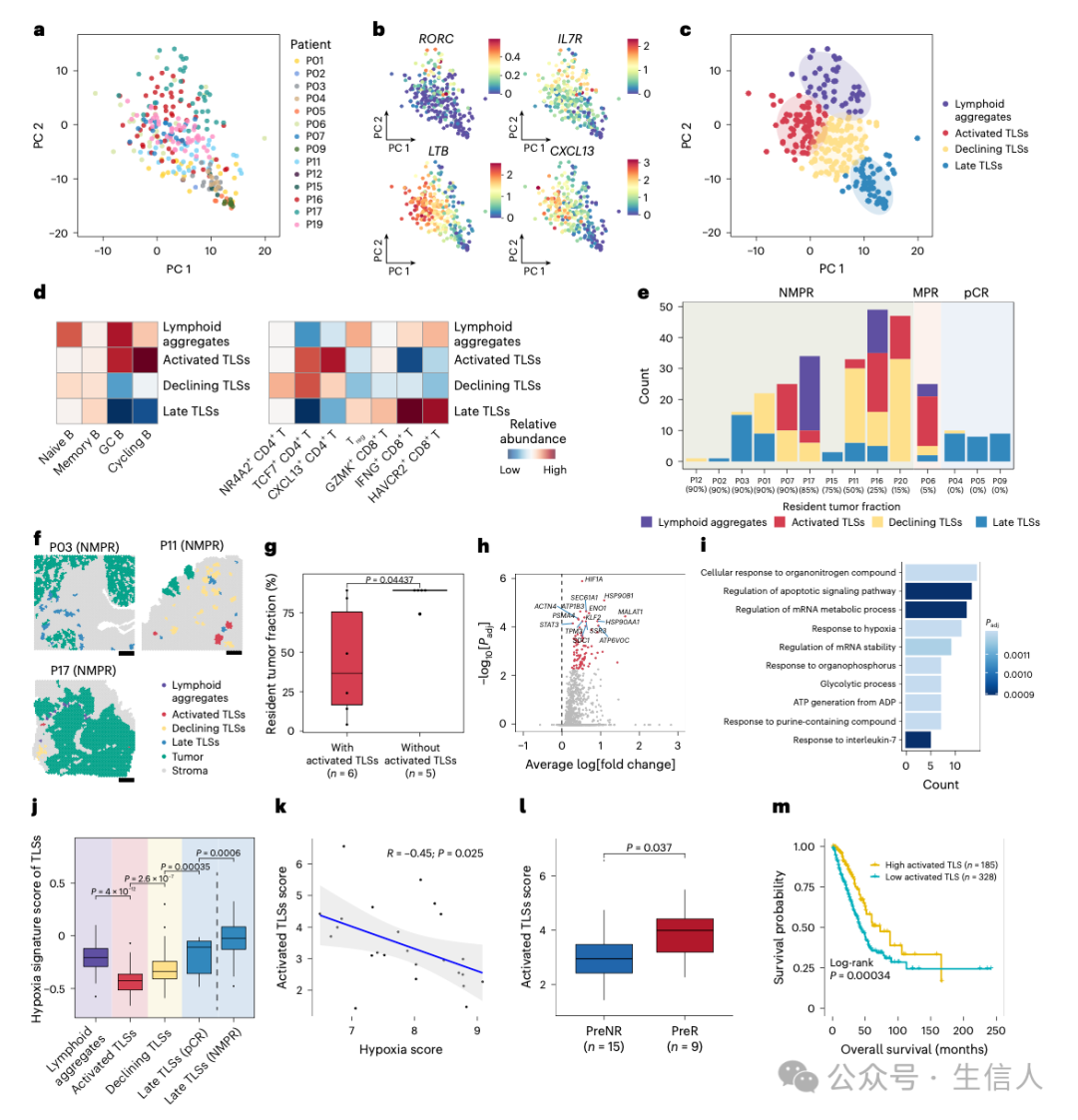 图6
图6 进一步分析发现,无应答者的晚期 TLSs 处于缺氧微环境中,这就像陷入了一片 “沼泽地”,严重影响了其功能。这些晚期 TLSs 表达更高水平的 HIF1A 和 ENO1 等与缺氧和糖酵解相关的基因,以及热休克蛋白基因,仿佛在发出求救信号。功能分析显示,晚期 TLSs 在无应答者中富集糖酵解和缺氧反应途径,而在 pCR 患者中未发现高度表达的基因,表明其处于衰退和静止状态。此外,缺氧微环境可能通过促进调节性 T 细胞浸润和抑制 CD4 效应记忆 T 细胞,抑制 TLS 的形成和维持,如同在肿瘤免疫的天平上增加了一块沉重的砝码,偏向了肿瘤细胞一方。在多个独立队列中的验证结果表明,活化 TLS 特征可作为患者生存和 ICB - 化疗反应的潜在生物标志物和治疗靶点,为临床治疗提供了新的思路和方向(图 6)。
八、研究意义与展望:照亮肺癌治疗的前行之路
本研究宛如一座灯塔,通过整合单细胞和空间转录组分析这两种强大的技术手段,为 NSCLC 肿瘤微环境在新辅助 ICB - 化疗前后绘制了一幅高分辨率的空间细胞和分子图谱。这一图谱清晰地揭示了与免疫化疗耐药相关的肿瘤细胞特征和微环境成分,如 COL11A1 + CAFs、SPP1 + 巨噬细胞和 TLSs 的不同状态等,它们就像地图上的关键地标,为我们理解肿瘤免疫耐药机制提供了重要的线索。这些发现为开发针对肿瘤微环境多个成分的联合治疗策略提供了坚实的理论基础和潜在的靶点,如同在黑暗中为肺癌治疗指明了新的方向。
 图7
图7 未来的研究之路充满希望与挑战。研究人员可进一步深入探究这些关键因素之间的复杂相互作用机制,如同解开一团错综复杂的丝线,揭示肿瘤免疫耐药的深层奥秘。同时,如何更好地将这些研究发现转化为临床实践,指导临床治疗决策,优化 NSCLC 患者的个性化治疗方案,提高免疫化疗的疗效,是摆在我们面前的重要任务。我们期待着在这条充满希望的道路上不断前行,为最终攻克 NSCLC 这一顽疾带来新的曙光,让更多患者重获健康与希望。
添加微信
参考文献
【1】Xu, Y., Wang, X., Li, Y. et al. Multimodal single cell-resolved spatial proteomics reveal pancreatic tumor heterogeneity. Nat Commun 15, 10100 (2024). https://doi.org/10.1038/s41467-024-54438-0
链接:http://www.lewenyixue.com/2025/01/07/%E5%BD%93%E5%A4%9A%E7%BB%84%E5%AD%A6%E9%81%87%E4%B8%8ANSCLC%E8%80%90%E8%8D%AF%EF%BC%9A%E4%B8%80%E5%9C%BA%E6%94%B9%E5%86%99%E8%82%BA%E7%99%8C/