介入性水凝胶微球疫苗作为免疫放大器,激活胰腺癌消融治疗后抗肿瘤免疫
胰腺导管腺癌(PDAC)是一种致命的消化道癌症,5年生存率低于7%。超过70%的患者在被诊断出患有胰腺癌时错过了手术机会。目前的胰腺癌化疗方案有限,具有全身毒性作用。
因此,微创介入治疗是无法切除的胰腺癌的可行选择。不可逆电穿孔(IRE)是一种新兴的非热消融疗法。它利用高频电场在细胞膜中诱导纳米级穿孔,扰乱细胞稳态并导致强免疫原性细胞死亡(ICD)和抗原释放。IRE消融术可以在不损伤周围血管和神经的情况下摧毁肿瘤,并有效降低胰腺瘘管形成和出血的风险,在治疗局部实体肿瘤方面显示出优势。然而,由于免疫抑制性肿瘤微环境的存在,接受IRE治疗的患者仍然面临胰腺癌的快速复发和转移。因此,加强内源性适应性抗肿瘤免疫对于改善消融治疗和消融后免疫治疗的结果至关重要。
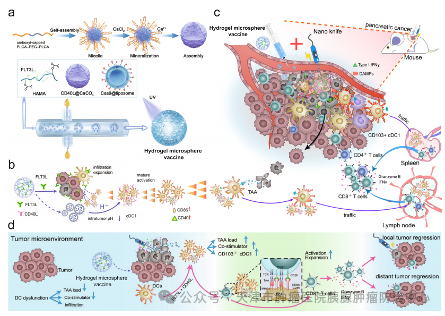
近期,Nature Communications杂志报道了一种水凝胶微球疫苗[1],它通过在肿瘤床相对较低的pH下释放FLT 3L和CD 40L来增强消融后的抗癌免疫反应。此外,该疫苗还可促进肿瘤驻留1型常规树突状细胞(cDC 1)迁移至肿瘤引流淋巴结(tdLN),从而启动cDC 1介导的抗原呈递级联反应,并激活内源性CD8+T细胞,最终增强对肿瘤细胞的杀伤作用。
这种水凝胶微球疫苗是如何设计的呢?作者将Cas9载体和CD 40L分别加载到脂质体和CaCO3纳米颗粒中,然后将它们与FLT 3L细胞因子和透明质酸(HA)混合,从而在微流体控制下创建水凝胶微球疫苗(图1)。这种水凝胶微球疫苗通过快速释放FLT 3L来促进招募肿瘤驻留型cDC 1,随后在酸性的肿瘤微环境中释放CD 40L,从而进一步促进cDC 1成熟并迁移到tdLN中。作为免疫放大器,这种水凝胶微球疫苗可放大CD 103+CD 11b-cDC 1介导的抗原交叉递呈级联反应,从而在消融治疗后,增强内源性CD 8+T细胞的抗肿瘤免疫反应,并诱导全身抗肿瘤免疫,抑制肿瘤远处转移。简而言之,这种水凝胶微球疫苗能作为一种安全有效的方式,来促进胰腺癌从“冷”肿瘤转变为“热”肿瘤。
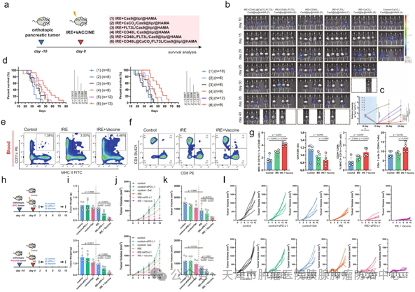
这种水凝胶微球疫苗在体内疗效如何呢?作者在雄性小鼠的原位胰腺癌模型中,评估了水凝胶微球疫苗联合IRE消融治疗胰腺癌的治疗效果(图2)。结果发现,接受水凝胶微球疫苗治疗的荷瘤小鼠的局部肿瘤复发和进展明显延迟。并且,接受水凝胶微球疫苗和IRE组合治疗的荷瘤小鼠的中位总生存期(OS)比接受IRE单药治疗的小鼠长约30%,比未治疗的对照小鼠长近2.5倍。随后,作者评估了水凝胶微球疫苗引发的全身性抗肿瘤免疫反应和对肿瘤转移的影响。结果显示,接受水凝胶微球疫苗和IRE组合治疗的荷瘤小鼠循环中MHC II+ CD 11 c+细胞和CD 8+T细胞的密度显着高于接受IRE单药治疗的小鼠。并且,接受联合治疗的荷瘤小鼠循环中CD 24+ MHC-II+ CD 11 c+细胞丰度分别是对照组或接受IRE单一治疗的小鼠的2.0倍和1.4倍。作者观察到使用该疫苗增加了循环中CD 8+T细胞与CD 4+T细胞的比例,从而增强了荷瘤鼠的全身免疫力。并且,接受水凝胶微球疫苗和IRE组合治疗的小鼠中远处皮下转移的重量仅为接受IRE单药治疗的小鼠的1/5。这说明,这种水凝胶微球疫苗具有强大的免疫放大作用以及远端效应。
因此,这些数据表明,水凝胶微球疫苗诱导的免疫放大作用极大地抑制了肿瘤消融治疗后的局部复发和远处转移,有望为胰腺癌患者提供益处。同时,这也解决了抗肿瘤纳米疫苗领域中两个长期存在的问题,包括与潜在的脱靶和泛免疫再调节相关的安全性问题,以及与系统性药物输送相关的高成本和副作用。水凝胶微球疫苗与消融治疗展现出有效的协同作用,为实体肿瘤提供了更适用的局部免疫治疗策略。鉴于目前“冷”实体瘤免疫治疗的困境,这种局部免疫放大策略有望转化为临床应用。
参考文献:
1. Liu, X., et al., Interventional hydrogel microsphere vaccine as an immune amplifier for activated antitumour immunity after ablation therapy. Nat Commun, 2023. 14(1): p. 4106.
图文材料:陈默冉
编辑:王轶菲
审核:余俊
链接:http://www.lewenyixue.com/2025/01/07/%E4%BB%8B%E5%85%A5%E6%80%A7%E6%B0%B4%E5%87%9D%E8%83%B6%E5%BE%AE%E7%90%83%E7%96%AB%E8%8B%97%E4%BD%9C%E4%B8%BA%E5%85%8D%E7%96%AB%E6%94%BE%E5%A4%A7%E5%99%A8%EF%BC%8C%E6%BF%80%E6%B4%BB/







赶快来坐沙发