张艳桥教授团队连发三文,揭示结直肠癌三种亚型免疫治疗的增效机制
【CMT&CHTV 医学前沿·临床经典】
结直肠癌(Colorectal Cancer, CRC)是全球范围内常见的恶性肿瘤之一,其发病率和死亡率均居高不下。免疫治疗作为一种新兴的治疗手段,正逐渐展现出其巨大的潜力。然而,由于结直肠癌的异质性,不同亚型的患者对免疫治疗的反应存在显著差异。张艳桥教授团队的三项突破性研究,分别针对ARID1A缺失型、髓样癌以及MSI-H型结直肠癌,深入探讨了这些特定亚型的免疫治疗应答机制和潜在的增效策略。
ARID1A缺失型肠癌的免疫治疗增敏方案
内容概括
在结直肠癌中,微卫星稳定型(MSS型)占大多数,这类肿瘤对现有的免疫检查点抑制剂反应较差。ARID1A是一种在多种肿瘤中频繁发生突变的基因,其缺失与肿瘤的免疫微环境和治疗反应性密切相关,但针对ARID1A缺失型结直肠癌的免疫治疗策略尚未明确。
该研究探索了ARID1A缺失如何影响结直肠癌的免疫治疗反应,并寻找可能的代谢靶点以增强免疫治疗的效果。研究团队首先通过基因表达谱和临床样本分析,确认了ARID1A缺失与结直肠癌免疫微环境的关联。接着,利用体外细胞实验和动物模型,研究了ARID1A缺失对肿瘤细胞代谢的影响,特别是花生四烯酸(Arachidonic Acid, AA)代谢途径。此外,研究还评估了针对AA代谢途径的干预措施对免疫检查点抑制剂疗效的影响。
研究结果
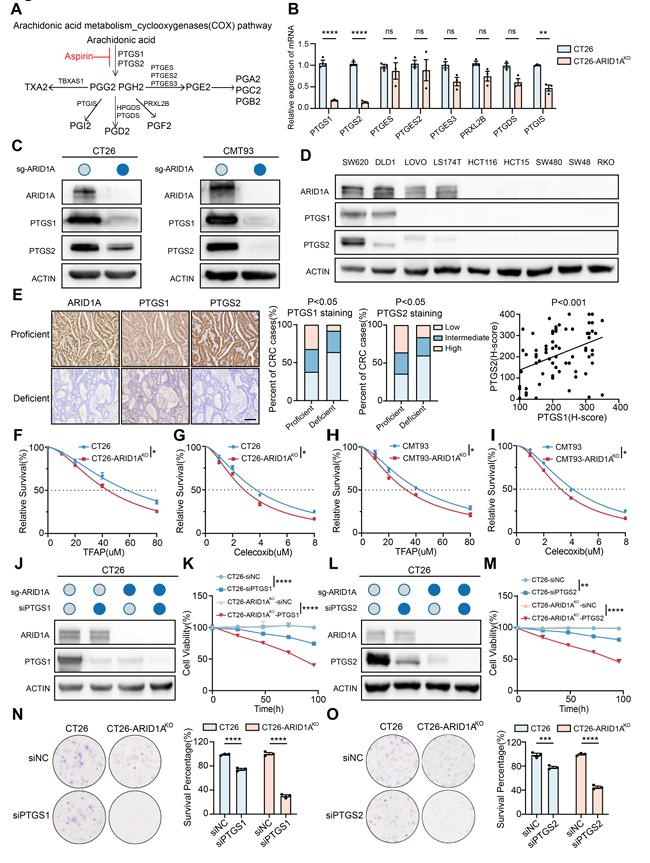
研究发现,ARID1A缺失的结直肠癌细胞表现出花生四烯酸代谢途径的异常激活,这与肿瘤免疫逃逸有关。通过抑制AA代谢关键酶PTGS1和PTGS2,可以显著降低ARID1A缺失型结直肠癌的生长和血管拟态形成。更重要的是,这种代谢干预能够恢复CD8 + T细胞的活性,从而增强免疫检查点抑制剂的疗效。在动物模型中,联合使用免疫检查点抑制剂和AA代谢抑制剂显示出显著的肿瘤生长抑制效果。
图1 ARID1A缺乏导致CRC对PTGS1和PTGS2基因的依赖
此外,研究还发现,ARID1A缺失的结直肠癌患者对免疫治疗的反应性与AA代谢途径的活性密切相关。这为临床实践中筛选免疫治疗优势人群提供了新的生物标志物。研究结果为开发针对ARID1A缺失型结直肠癌的新型免疫治疗策略提供了理论依据和潜在的治疗靶点。
该研究于2024年12月9日发表于《Cancer Research》。
结直肠髓样癌的免疫治疗适用性
内容概括
结直肠癌中髓样癌(Medullary Carcinoma, MC)是一种罕见的组织学亚型,占所有结直肠癌的1-2%。髓样癌具有独特的病理特征,包括肿瘤细胞密集、淋巴细胞浸润明显等。尽管髓样癌的免疫原性较高,但其对免疫检查点抑制剂的反应性尚未充分研究。
这项研究利用多组学(Multi-omics)方法,包括基因组学、转录组学、蛋白质组学和代谢组学,对结直肠髓样癌的免疫学特征进行了全面分析。通过大规模的样本收集,对髓样癌的基因表达谱、免疫细胞浸润、肿瘤微环境等进行了详细描绘。接着,利用生物信息学工具,研究了髓样癌中免疫检查点分子的表达模式,以及与患者临床特征和预后的相关性。此外,还探讨了髓样癌对免疫检查点抑制剂的潜在反应性,并通过体外实验和动物模型进行了验证。
研究结果
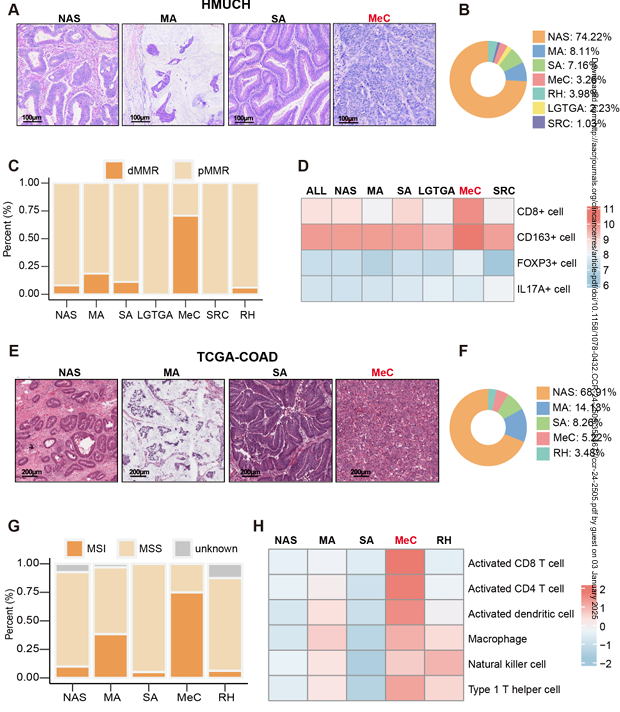
研究结果显示,结直肠髓样癌具有显著的免疫细胞浸润,尤其是CD8 + T细胞和调节性T细胞(Tregs)。多组学分析揭示了髓样癌中免疫检查点分子(如PD-1、PD-L1、CTLA-4等)的高表达,这与肿瘤细胞的免疫逃逸机制有关。通过对患者生存数据的分析,研究团队发现免疫检查点分子的表达水平与患者的生存率显著相关,提示这些分子可能作为预测免疫治疗反应的生物标志物。
图2 多种病理类型的基因突变和表达分析
在体外实验和动物模型中,研究团队进一步验证了髓样癌对免疫检查点抑制剂的敏感性。结果显示,免疫检查点抑制剂能够显著抑制髓样癌的生长,并提高肿瘤对免疫细胞的敏感性。这些发现表明,髓样癌可能对免疫治疗具有较高的反应性,为临床治疗提供了新的策略。
该研究于2024年12月9日发表于《Clinical Cancer Research》
MSI-H型肠癌患者免疫治疗耐药机制及逆转方案
内容概况
该研究探讨了甲羟戊酸激酶(Mevalonate Kinase, MVK)在MSI-H结直肠癌中的作用,以及其对肿瘤细胞内源性干扰素(Interferon, IFN)反应的影响。研究团队首先通过基因表达谱和临床样本分析,确认了MVK在MSI-H结直肠癌中的表达模式。接着,利用体外细胞实验和动物模型,研究了MVK对肿瘤细胞IFN反应的影响,以及其在肿瘤免疫逃逸中的作用。此外,研究还评估了MVK抑制剂对免疫检查点抑制剂疗效的影响。
研 究结果
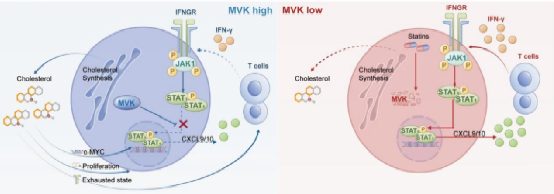
研究发现,MVK在MSI-H结直肠癌中的高表达与肿瘤细胞IFN反应性的降低有关。MVK通过与STAT1的转录激活域相互作用,阻碍STAT1的磷酸化和核转位,从而降低干扰素反应性。这一过程导致肿瘤细胞对免疫细胞的杀伤作用减弱,促进了肿瘤的免疫逃逸。在动物模型中,MVK抑制剂的使用能够恢复肿瘤细胞的IFN反应,增强免疫细胞的抗肿瘤活性,并提高免疫检查点抑制剂的疗效。
图3 MVK高表达与 STAT1转录激活的相互作用
此外,研究还发现,MVK的表达水平与MSI-H结直肠癌患者的临床预后相关。高MVK表达的患者对免疫检查点抑制剂的反应性较差,提示MVK可能作为预测免疫治疗反应的生物标志物。
该研究于2024年12月26日发表于《Oncogene》。
参考文献
[1] CUI L, LIU R, HAN S, et al. Targeting Arachidonic Acid Metabolism Enhances Immunotherapy Efficacy in ARID1A-Deficient Colorectal Cancer[J]. Cancer Res. Published online December 9, 2024. DOI:10.1158/0008-5472.CAN-24-1611.
[2] LIU C, ZOU H, RUAN Y, et al. Multi-omics reveals the immunological features and the immune checkpoint blockade potential of colorectal medullary carcinoma[J]. Clin Cancer Res. Published online December 9, 2024. DOI:10.1158/1078-0432.CCR-24-2505.
[3] LIAO Y, YANG R, WANG B, et al. Mevalonate kinase inhibits anti-tumor immunity by impairing the tumor cell-intrinsic interferon response in microsatellite instability colorectal cancer[J]. Oncogene. Published online December 26, 2024. DOI:10.1038/s41388-024-03255-2.
链接:http://www.lewenyixue.com/2025/01/06/%E5%BC%A0%E8%89%B3%E6%A1%A5%E6%95%99%E6%8E%88%E5%9B%A2%E9%98%9F%E8%BF%9E%E5%8F%91%E4%B8%89%E6%96%87%EF%BC%8C%E6%8F%AD%E7%A4%BA%E7%BB%93%E7%9B%B4%E8%82%A0%E7%99%8C%E4%B8%89%E7%A7%8D/








赶快来坐沙发