Nature揭示肺腺癌上皮细胞状态和可塑性图谱
了解早期肺腺癌 (lung adenocarcinoma , LUAD) 发生 发展的 病理生理 过程 对于早期 制定干预策略 至关重要,今天给各位介绍这一篇近期发表在 Nature 上的文章,该团队 研究了来自16 例早期 LUAD 和47 例匹配的正常肺样本的单个上皮细胞。上皮细胞包括多种正常和癌细胞状态, 通过对癌细胞特异的转录特征分析,从而发现预防和干预的潜在靶点 。 究竟怎么样,我们一起看看吧!

标题: An atlas of epithelial cell states and plasticity in lung adenocarcinoma
期刊: Nature (中科院 1 区 IF : 64.8 )
PMID: 38418883 DOI: 10.1038/s41586-024-07113-9
由于早期筛查的普及, LUAD 越来越多地在早期病理阶段被发现。然而,患者预后仍然是中等到较差的,因此需要改进早期治疗策略。解码驱动 LUAD 的 早期事件 可以确定理想 八靶点 。先前的研究表明,吸烟导致普遍的分子( 例如 KRAS 突变 ) 和免疫变化,这些变化在 LUAD 及其相邻的正常系统之间共享,并且与肺恶性病变和LUAD 的发展密切相关。 然而 ,特异性上皮 细胞 亚群或它们如何促进损伤领域,触发正常肺(NL) 向癌前病变的进展以及促进 LUAD 发病机制尚不清楚。 因此, 了解LUAD 起始的细胞类型特异性变化将有助于确定预防这种病态疾病的可行靶点和策略 。
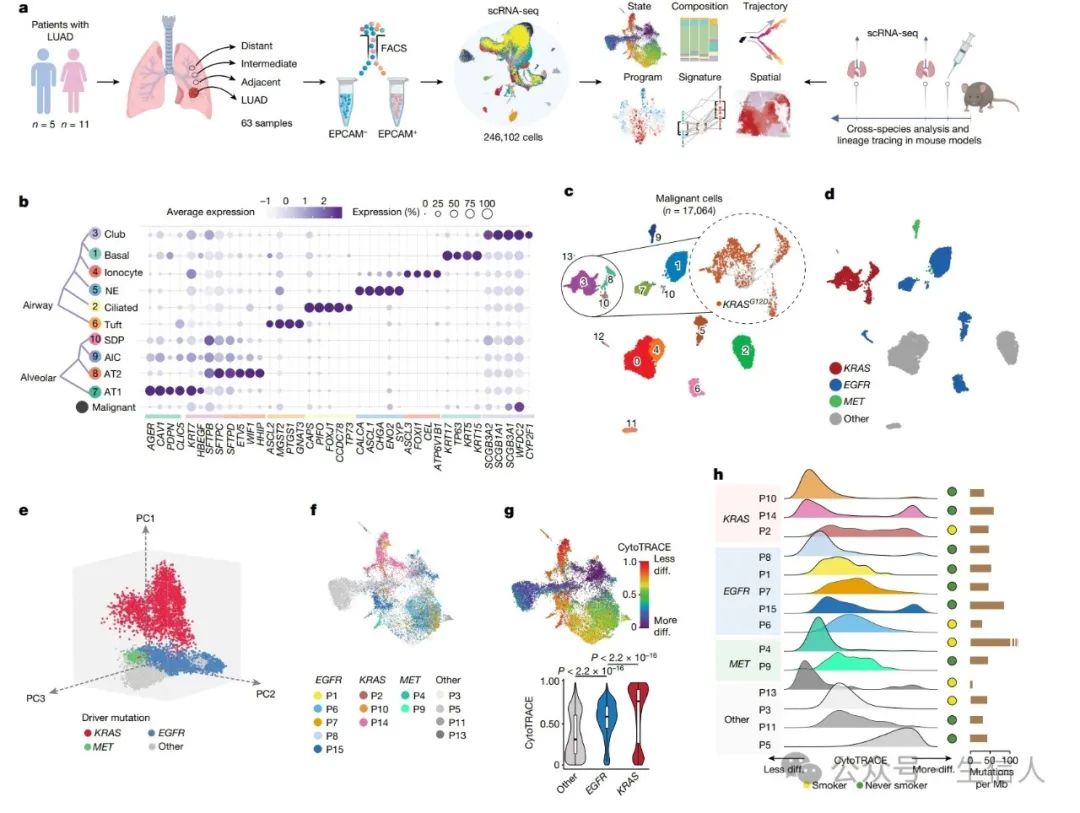
该团队结合了对早期 LUAD 临床标本的深入 sc RNA 测序,以及对暴露于烟草致癌物后LUAD 发展的人类相关模型的跨物种分析和谱系追踪 ( 图 1 a) 。使用 scRNA-seq 研究了来自富含 EPCAM 的 16 例 早期LUAD 患者样本和 47 例 NL 样本的上皮细胞亚群,这些样本跨越了 LUAD 的地形连续体,即肿瘤邻近、肿瘤中间和肿瘤远端位置 15( 图 1 a) 。 此外 还收集了来自同一区域的肿瘤和正常组织集,用于全外泌子组测序(WES) 分析和高分辨率空间转录组学 (ST) 和蛋白质分析 ( 图 1 a) 。 质控后保留 246102 个上皮细胞进行分析。通过整合来自推断拷贝数变异(推断 CN V )、聚类分布、谱系特异性基因表达和携带KRAS G12 体细胞突变的读数的存在信息,将恶性细胞(n=17064 )与其他非恶性正常细胞( n=229038 )区分开来(图 2 b )。 恶性细胞形成了 14 个簇(图 1 c ),这些簇主要是患者特异性的,这意味着强烈的患者间异质性。
与EGFR 突变 LUADs (EM-LUADs) 或 MET 突变 LUADs (MM-LUADs) 的恶性细胞明显不同 ( 图 1e) , KM - LUAD( KRAS wild-type - LUAD) 在样本和细胞水平上表现出更多的转录组相似性( 即更短的 Bhattacharyya 距离 ) 。总体而言,携带 KRAS G12D 突变的恶性细胞显示出分化减少,这与KM - LUAD 中肺泡分化( MP31 )的丧失一致。 其中, 来自患者P14 的恶性细胞簇表现出不同水平的 CNVs 15 ,其中富含 KRAS G12D 细胞簇携带相对较晚的CNV 事件(例如,染色体 1p 缺失、染色体 8 和染色体 12 增加)和肺泡特征评分降低,这与减弱的分化一致(扩展数据图 2g , h )。 KRAS 特征是基于队列中 KRAS 突变恶性细胞的不同表达特征得出的,其与 MP30 特征强 烈且 显 著相关。
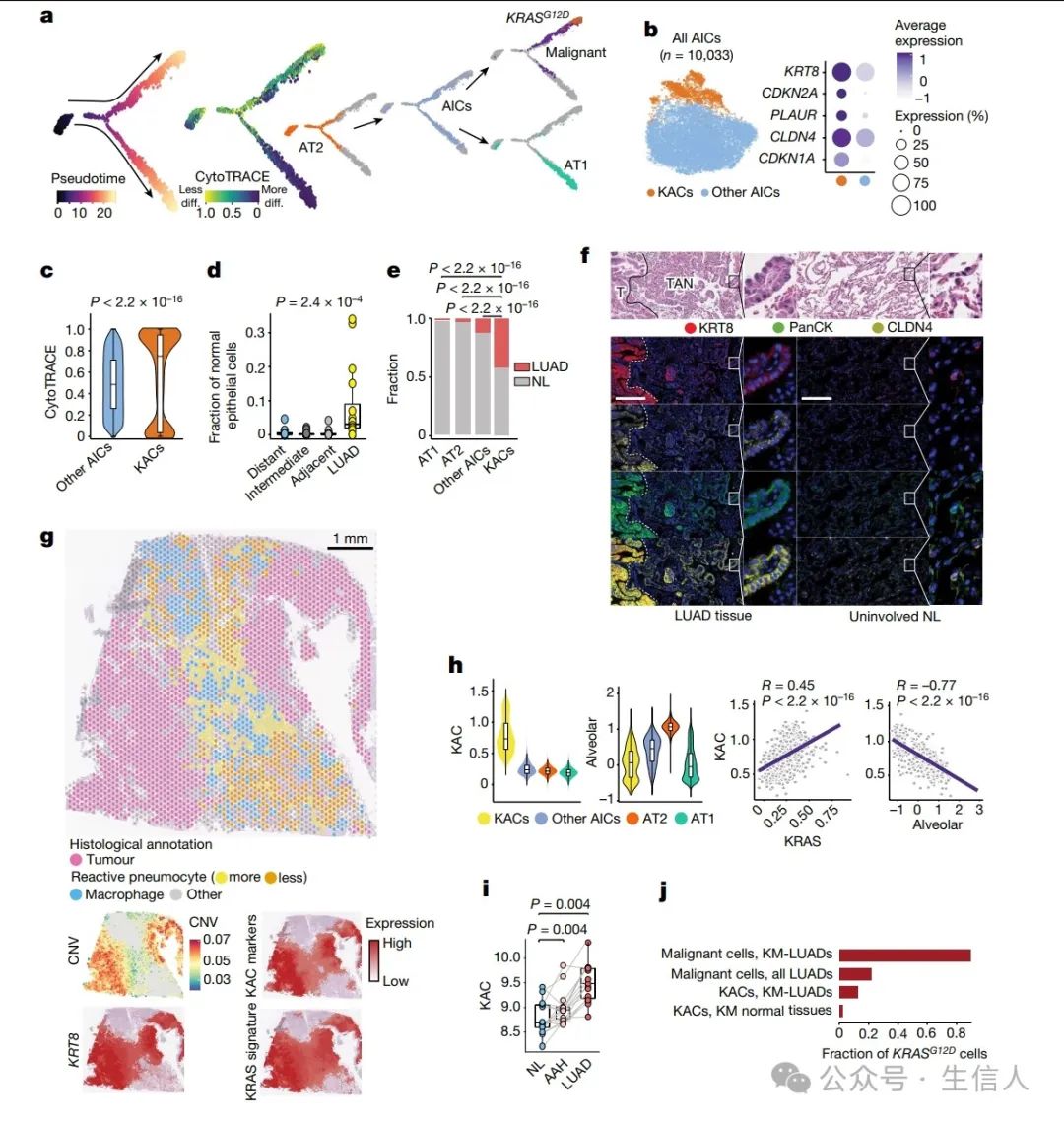
与多区域NL 样本相比, LUAD 中的 AT2 细胞总体减少( P=0.002 ), 而 AICs 显示出相反的模式( P=0.02 ;扩展数据图第 3a 、 b 段)。 AT2 细胞在 7 名患者的多区域 NL 样本中,随着肿瘤接近度的增加 而 逐渐减少(P=0.004 )。 AICs 是 AT2-AT1 细胞的发育和分化轨迹 中的中介 (图2a )。 LUAD 组织中分化程度最低的 AICs 的比例高于分化程度较高的 AICs (分别为 29% 和 11% )。值得注意的是, AICs 被推断为向恶性细胞过渡,包括 KRAS 突变细胞,其相对于 EGFR 突变恶性细胞发育更晚( P < 2.2×10 −16 ;图2a )。对 AICs 的进一步分析确定了具有明显高表达 KRT8 的亚群(图 2b )。这些 KACs 具有增加的 CDKN1A 、 CDKN2A 、 PLAUR 和肿瘤标记物 CLDN4 的表达(图 2b )。 KACs 分化程度也明显较低( P < 2.2×10 −16 ;图2c ),发育较晚( P = 1.2×10 −11 )。值得注意的是,KACs 转变为 KRAS 突变的恶性细胞,而其他 AICs 与向 AT1 细胞的分化更密切相关。相对于多区域 NL 组织, LUAD 中非恶性上皮细胞中 KACs 的比例显著增加( P=2.4×10 −4 ;图2d ),且 LUAD 中 KACs 显著高于 AT1 、 AT2 或其他 AIC 组分( P<2.2×10 −16 ;图2e )。 来自患者 P14 的肿瘤组织的 ST 分析显示, KRT8 在肿瘤区域(具有高 CNV 评分)和组织学上包括高反应性肺细胞并表现出中到低 CNV 评分的 TAN 区域中的表达增加(图 2g )。 且 相对于肺泡细胞,KACs 更接近肿瘤区域。 KAC 富集区的 ST 分析表明, KAC 在肺泡实质向肿瘤细胞的转变中起中介作用。肿瘤区域 NKX2-1 的表达和肺泡特征显著减少(扩展数据图 4b ),这与 KM - LUAD 中肺泡分化减少一致。 KAC 标记物(图 2b )在肿瘤区域和具有反应性肺细胞的 TAN 中较高,并且它们在空间上与 KRAS 特征重叠(图 2g )。相反,其他 AIC 与 KRAS ( R=0.045 ; P=3.2×10−5 )或肺泡( R=−0.11 ; P<2.2×10−16 )特征之间没有相关性。 总而言之,该团队研究结果表明 KACs 是 一种与人类LUAD ,特别是 KM-LUAD 的发病机制高度相关的中间肺泡细胞亚群。
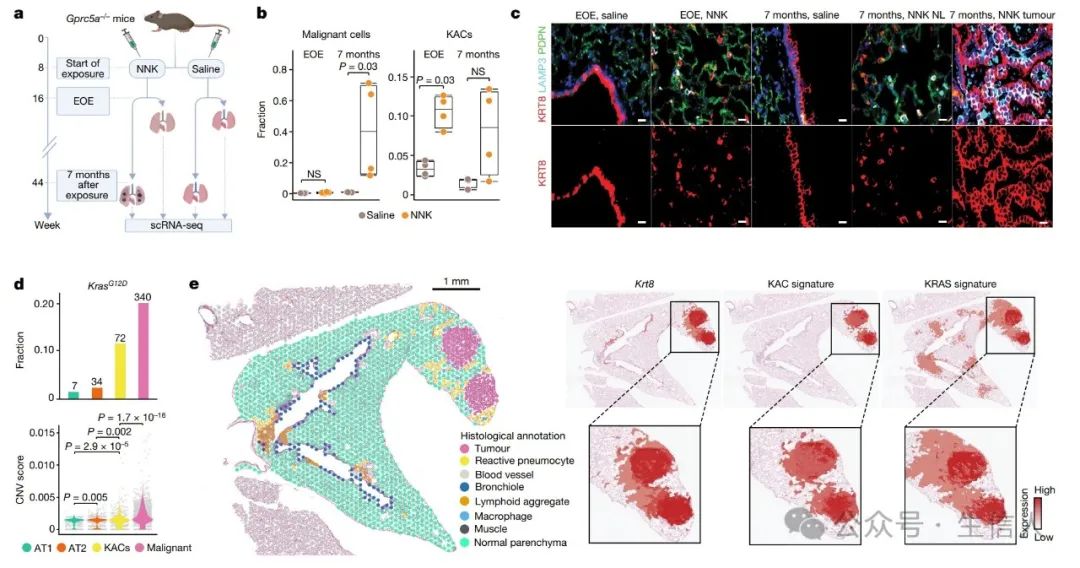
图3. KAC 在烟草相关 KM-LUAD 发病机制中早期和肿瘤发病前的演变
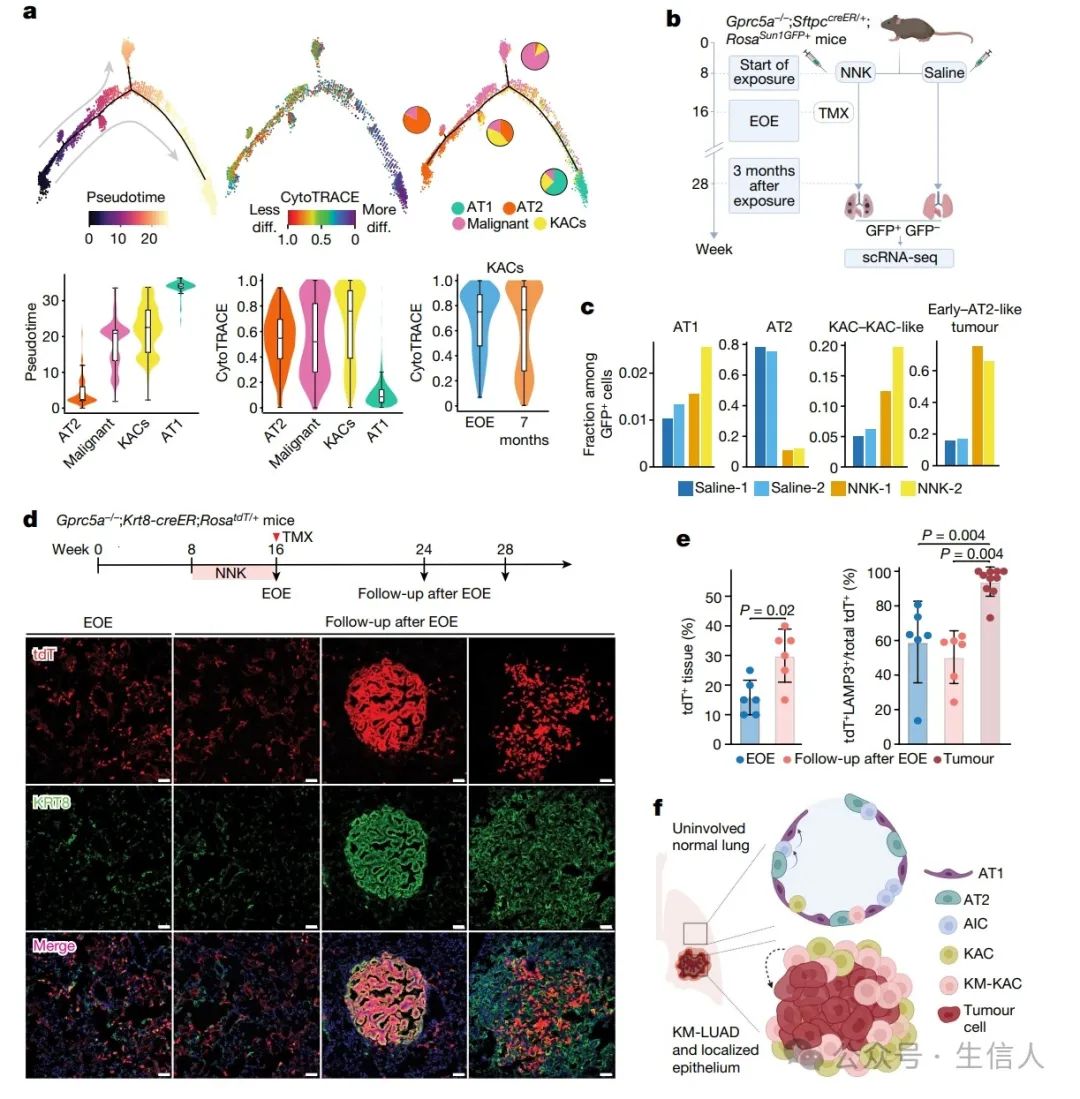
接着对来自小鼠的肺上皮细胞进行了 scRNA-seq 分析,其中肺谱系特异性G蛋白偶联受体a基因Gprc5a被敲除(Gprc5a - / - )后 ,在烟草致癌物暴露后产生KM LUAD。在暴露结束时(EOE)和暴露后7个月,即KM-LUAD发作的时间点用尼古丁衍生的亚硝胺酮(NNK)或生理盐水(作为对照)处理的Gprc5a - / - 小鼠的肺。聚类分析揭示了不同的谱系,包括聚集在AT1和AT2细胞亚群之间并靠近肿瘤细胞的KACs。与人类细胞相似,恶性细胞表现出谱系特异性基因的低表达。同样, 来自恶性集群的细胞具有高CNV评分,表达KRAS G12D 突变,并显示出与肺泡分化丧失(Kng2和Meg3)和免疫抑制(Cd24a)相关的标记物表达增加。
获得的小鼠KAC特征在小鼠KACs和恶性细胞(P < 2.2 × 10 -16 )和人LUAD (P = 1.2 × 10 -8 )中显著丰富,在癌前AAHs (P = 4.3 × 10 -4 )中也显著增加,相对于匹配的NL组织,侵袭性LUAD (P = 1.5 × 10 - 3 )进一步增加。
于是该团队对队列中的细胞与来自两项独立研究的KRAS G12D 驱动的细胞进行了整合的scRNA-seq分析。簇C5包括来自所有三项研究的细胞,具有明显高表达的KAC标记物和KAC特征本身。与正常AT2细胞相比,来自KRAS G12D 驱动的小鼠的C5细胞仍然表达更高水平的KAC特征。与这些发现一致,小鼠KAC特征与其人类对应物一样,相对于EM - LUAD,KM -LUAD的KAC和恶性细胞中显著富集(分别为P=0.04和P<2.2×10 - 16 )。
接着为了进一步揭示KACs的生物学特征,该团队发现GFP + 类器官在KACs中富集。GFP + 细胞(n=3089)几乎完全由AT2、早期肿瘤和AT2样肿瘤细胞、KACs和KAC样细胞以及少数AT1细胞组成,所有这些细胞在GFP - 组分中几乎不存在。与早期AT2样肿瘤细胞相比,从这个时间点开始的GFP + KACs,与癌前的形成相吻合,在相似的部分携带驱动因子KRAS G12D 突变。最后,该团队利用KRAS(G12D)抑制剂 联合Cre工具鼠,最终确定KACs是KM-LUAD早期发展和烟草致癌物暴露后的中间细胞状态。
图 4 KACs 与AT2 向K RAS 突变肿瘤细胞的转变有关
该团队通过对早期 LUAD 肺的上皮细胞进行了多模式分析,发现了与KM-LUAD 发病机制有关的多种恶性状态、ITH 模式和细胞可塑性程序。其中,鉴定了肺泡分化程序激活后产生的肺泡中间细胞( KACs ),它可以作为 KM-LUAD 的祖细胞。 KACs 在小鼠和患者样本中病变附近的正常出现区域都很明显,这表明这些细胞的早期出现可能代表 “ 损伤场 ” 。一个与人类癌症的发展和正常肺组织中存在的复杂突变谱有关 的“损伤场”。这揭示了 KACs 和 KRAS 突变的肺肿瘤细胞之间的紧密联系和密切共享的特性,包括 KRAS 突变、分化减少和途径。 结合对早期人类 LUAD 和 K RAS 突变肺癌模型的深入研究,提供了一个具有大量上皮细胞的图谱。这张人类和小鼠肺中上皮和恶性细胞状态的图谱强调了LUAD 开始的新的细胞特异性亚群 ,这 可能会启发目标的推导(例如,早期KRAS 程序 等KAC 信号),以防止 LUAD 的启动和发展。
这篇 Nature 文章通过对来自 16 例早期 LUAD 的肺上皮细胞进行 转录组学 分析,确定了 KM-LUAD 密切 相关的细胞状态,最终确定了KACs是KM-LUAD早期发展和烟草致癌物暴露后的中间细胞状态,为未来早期预防和介入提供了潜在靶点。更多详情还请大家移步原文,仔细品鉴。
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2025/01/03/Nature%E6%8F%AD%E7%A4%BA%E8%82%BA%E8%85%BA%E7%99%8C%E4%B8%8A%E7%9A%AE%E7%BB%86%E8%83%9E%E7%8A%B6%E6%80%81%E5%92%8C%E5%8F%AF%E5%A1%91/
THE END







赶快来坐沙发