实力与争议并存:六千字长文起底宋尔卫院士科研版图,高分乳腺癌研究最全盘点
在学术界,权威往往不容挑战,但近日,一起由00后学生引发的事件,不仅挑战了学术权威,更引发了公众对学术圈现状的广泛讨论。
12月19日, 清华大学 邀请中山大学附属孙逸仙纪念医院 宋尔卫院士 来校开展医学讲座,提问环节风波不断,会后 海报也被撕毁 ,成为了近期医疗圈、学术圈和公众热议的焦点。顶着学术权威光环的宋院士,却因学生集体患癌事件和清华讲座风波被推上风口浪尖,这位实力与争议并存的中科院院士学术能力到底如何?就让我们一起来回顾一下他近五年的学术成果吧。

广州仔,逸仙情
1988年至2000年,宋尔卫就读于中山医科大学临床医学系,先后获得学士、硕士、博士学位。1999年至2002年先后担任德国埃森大学医学院、美国哈佛大学医学院博士后研究员,2004年晋升为美国哈佛大学讲师,同年全职回到中山大学工作,一直到2019年当选为中国科学院院士。
“他是在中山大学孙逸仙纪念医院培养和成长起来的 首位中科院院士 ,是个接地气的广州仔,有着深深的逸仙情。”——宋尔卫评选中科院院士后,南方日报如此评价。
宋尔卫在博后期间,其在英国《自然・医学》杂志上发表的论文就已被《科学》杂志评为2003年度全球10大科技进展之四。自2019年评选院士后,宋尔卫团队研究成果一路高歌猛进,同年进入中国高被引学者榜单。至今总引用数高达30585,仅仅是2024年,就在Nature,PNAS及Cell子刊等发表数10篇文章。
可以说,人类历史上四次对癌症认识和治疗的革命,都是从乳腺癌开始,前三次我们国家只是跟跑者,尤其是前两次革命,我们比西方先进国家滞后数十年之久。今天,在第四次革命中,宋尔卫院士带领团队成为领跑者。
1、调控乳腺癌干细胞转移的“生力军”:microRNA。
MicroRNAs最初因其不能编码蛋白质而被人们认为是“垃圾RNA”,宋尔卫团队在实验的过程中,他们惊喜地发现了一个名为“let-7”的microRNA可直接对乳腺肿瘤干细胞的更新、分化和转移进行调控!随后,宋教授的团队乘胜追击,发现了一批可以在肿瘤检测和靶向干预中作为标记物和节点分子的microRNA,为乳腺癌治疗新机制奠定了基础。
2、肿瘤微环境:解答百年难题的“种子土壤学说”
肿瘤细胞“种子”的生长,需要合适的肿瘤微环境的“土壤”。而恶性肿瘤的“种子”是否会反过来影响其生长的“土壤”,形成促进肿瘤转移的恶性循环呢? 宋尔卫团队通过分离鉴定,证实CCL18是治疗乳腺癌的潜在靶点,拮抗其作用可以显著抑制乳腺癌转移。同时,除了土壤中的物质会增强种子的力量,种子也会反过来“污染”土壤,而这个反向的过程同样需要CCL18来连接,因此将它作为标记物,可应用于临床预测乳腺癌患者的早期转移和预后。
3、RNA干扰的治疗潜能:“魔法般的子弹”
自2001年RNA干扰现象发现后,科学界认为RNAi干扰技术只能应用于植物等体外细胞或者低级昆虫上。2003年,宋尔卫教授与哈佛大学合作,首次成功地将siRNA应用在保护小鼠爆发性肝炎的模型中,这使各国科学家看到了该技术应用于人类疾病的曙光, 也因此被《科学》杂志评为2003年度“全球十大科技进展”之四。 随后,宋尔卫教授花费了两年时间组装起“巡航导弹”,首次在动物体内靶向肿瘤细胞导入siRNA并获得成功, 《自然生物科技》杂志更将这项技术誉为“魔法般的子弹”并选为封面故事,为siRNA的临床应用奠定了基础。
在这需要说明的一点是,由于宋尔卫院士挂名的研究论文实在是太多了,其中很多都是合作课题的研究成果。为了方便大家学习宋院士近五年科研最精华的部分,本次小编只对宋院士作为末尾通讯的研究进行盘点,并且分为六大板块进行解读。
 文献引用与趋势(来源:Scopus)
文献引用与趋势(来源:Scopus)
1、LncRNA在乳腺癌中的耐药性作用
宋尔卫团队发现了三个关键的长链非编码RNA:DILA1、DIO3OS和ACIL,这些lncRNA在乳腺癌的耐药性中扮演着重要角色。 DILA1 通过直接与Cyclin D1蛋白的Thr286位点相互作用, 阻止其磷酸化和随后的降解,导致Cyclin D1蛋白在乳腺癌细胞中的过表达, 从而与他莫昔芬耐药性相关[1]。 DIO3OS在芳香化酶抑制剂(AI)耐药的乳腺癌肿瘤中上调,与增强的有氧糖酵解特征相关, 并与乳腺癌患者接受AI治疗的不良预后相关[2]。 ACIL与ATR和Chk1相互作用,促进ATR对Chk1的磷酸化 ,与DNA损伤剂的化疗耐药性和乳腺癌患者的不良预后相关[3]。这些发现揭示了lncRNA在调节乳腺癌耐药性中的新机制,并为开发针对这些lncRNA的潜在治疗策略提供了科学依据。
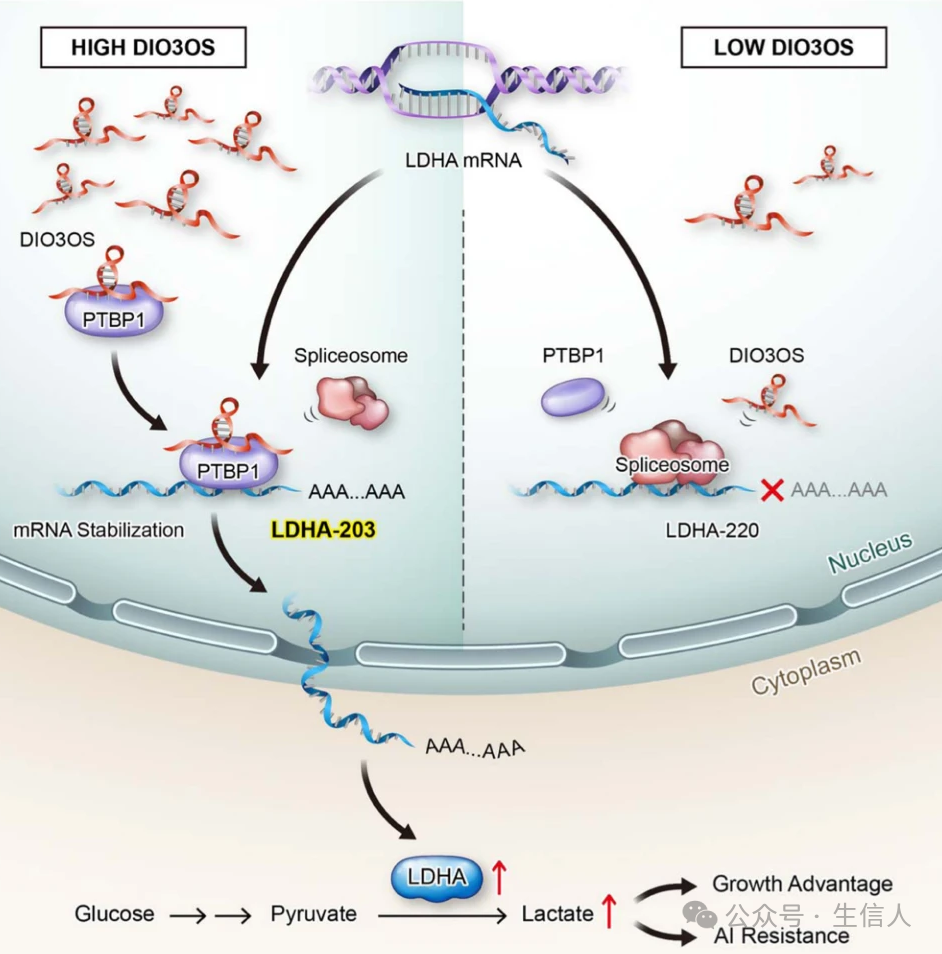 图 1 DIO3OS/PTBP1/LDHA糖酵解途径调控乳腺癌适应雌激素剥夺 ( Chen, 2022)
图 1 DIO3OS/PTBP1/LDHA糖酵解途径调控乳腺癌适应雌激素剥夺 ( Chen, 2022)
2、LncRNA在乳腺癌细胞增殖与转移中的作用
宋尔卫团队首先发现了 lncRNA THOR在乳腺癌的发生和发展中起着关键作用,通过与hnRNPD蛋白相互作用,THOR能够增加hnRNPD蛋白水平,进而稳定其靶mRNAs ,包括PDK1,激活下游的PI3K-AKT和MAPK信号通路,从而调节乳腺癌细胞的增殖和转移[4]。此外,他们还发现了另一个lncRNA FAISL, 在三阴性乳腺癌(TNBC)中,FAISL通过阻断Calpain 2介导的FAK蛋白降解,正向调节FAK蛋白水平,促进TNBC细胞的粘附、细胞骨架扩散、增殖和锚定独立生存 [5]。这些研究不仅揭示了lncRNA在乳腺癌细胞增殖和转移中的分子机制,而且为乳腺癌的预后预测和治疗提供了新的靶点,为乳腺癌的治疗提供了潜在的新策略。
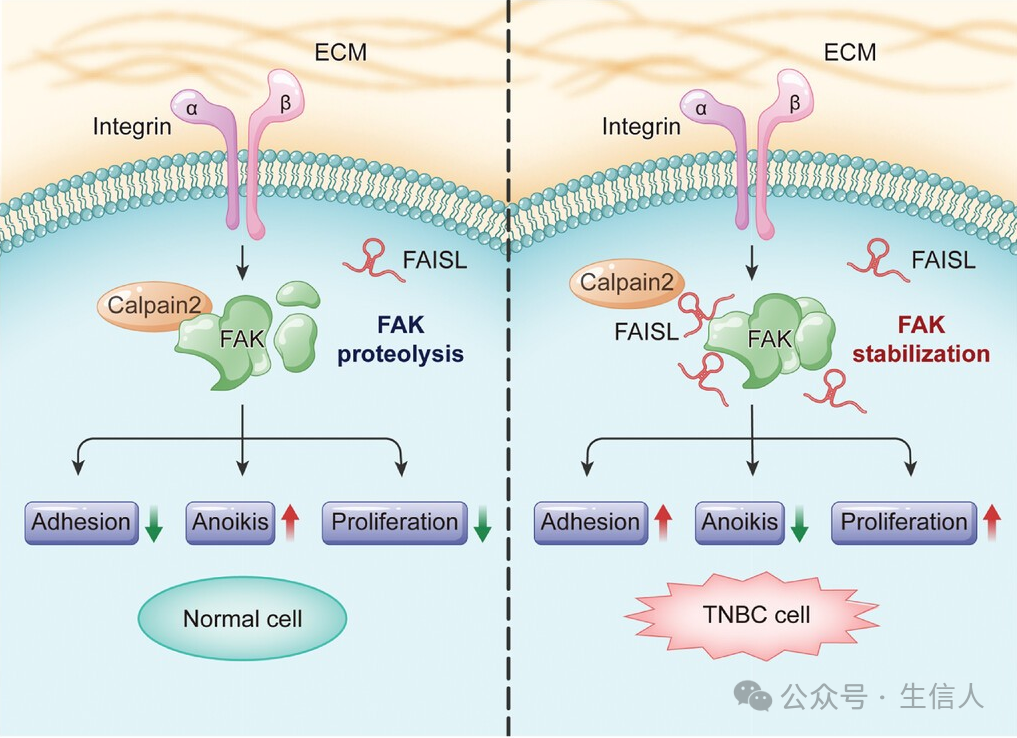 图 2 FAISL的表达与乳腺癌患者的FAK蛋白水平和不良预后相关(Zhang, 2024)
图 2 FAISL的表达与乳腺癌患者的FAK蛋白水平和不良预后相关(Zhang, 2024)
3、LncRNA在肿瘤细胞代谢与自噬调节中的作用
宋尔卫团队首先发现了 circCDYL,这是一种与自噬相关的circRNA,在乳腺癌组织中的表达量是相邻非癌组织的3.2倍,并通过miR-1275-ATG7/ULK1轴促进乳腺癌细胞的自噬水平 ,增强了乳腺癌细胞的恶性进展[6]。此外,他们还揭示了 HIFAL,一种HIF-1α反义lncRNA,在维持和增强HIF-1α介导的转录激活和糖酵解中的关键作用 [7]。抑制HIFAL可以干扰HIF-1介导的反式激活和糖酵解代谢过程,使缺氧癌细胞失去主要的能量来源, 而这意味着HIFAL有望成为癌症“饥饿疗法”的崭新靶点。
这些研究不仅阐明了lncRNA在肿瘤细胞代谢和自噬中的调节作用,还为乳腺癌的预后和治疗提供了新的分子靶点。
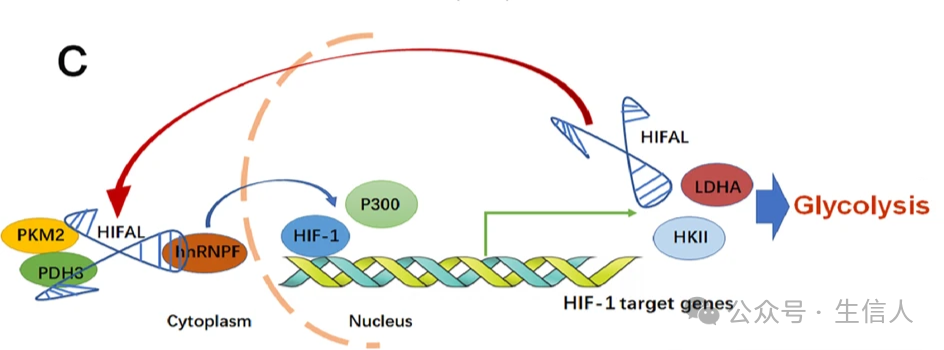 图 3 HIFAL 在组装 HIF-1反式激活复合物中的作用,并驱动 HIF-1靶基因的转录(Zheng, 2021)
图 3 HIFAL 在组装 HIF-1反式激活复合物中的作用,并驱动 HIF-1靶基因的转录(Zheng, 2021)
4、LncRNA在肿瘤抑制因子调控中的作用
宋尔卫团队在“LncRNA在肿瘤抑制因子调控中的作用”这一研究主题上进行了深入研究。他们发现了两个关键的lncRNA:NRON和APAL。 NRON通过与MDM2和MDMX(MDM4)结合,促进它们的异源二聚体形成,增强MDM2的E3泛素连接酶活性,导致包括P53、RB1和NFAT1在内的多个肿瘤抑制因子的降解,从而促进肿瘤形成 [8]。另一方面, APAL通过连接PLK1和Aurora A,增强Aurora A介导的PLK1磷酸化,促进癌细胞周期进展和增殖,并抑制化疗诱导的凋亡 [9]。APAL的敲低在多种人类癌细胞中引起有丝分裂灾难和大量凋亡,而过表达APAL则加速癌细胞周期进展。这些研究揭示了lncRNA在肿瘤抑制因子调控中的重要作用,并指出NRON和APAL作为癌症治疗的潜在靶点。
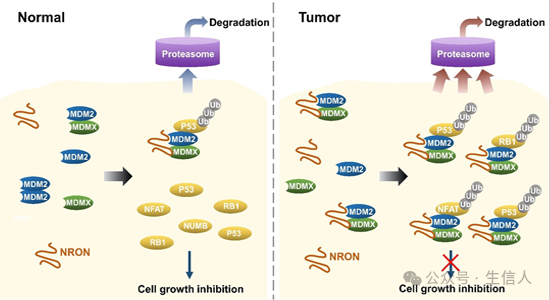 图 4 E3连接酶MDM2诱导p53降解并促进肿瘤发生(Guo, 2023)
图 4 E3连接酶MDM2诱导p53降解并促进肿瘤发生(Guo, 2023)
肿瘤免疫治疗获得18年诺贝尔医学奖,是目前发展最快的肿瘤治疗之一。但目前只有大约20-30%患者获益,因此寻找新的免疫治疗靶点有重要意义。 2021年6月17日 , 宋尔卫/苏士成 课题组在 Nature Immunology 上在线发表了研究论文他们首先发现RGS1在辅助TH1细胞和细胞毒性T淋巴细胞(CTLs)中的上调减少了这些细胞向肿瘤的迁移和在肿瘤中的生存,与乳腺癌和肺癌患者较短的生存期相关,RGS1的敲低可以显著增加肿瘤特异性CTLs在乳腺和肺癌肿瘤移植物中的浸润和生存,并有效抑制肿瘤生长[10]。
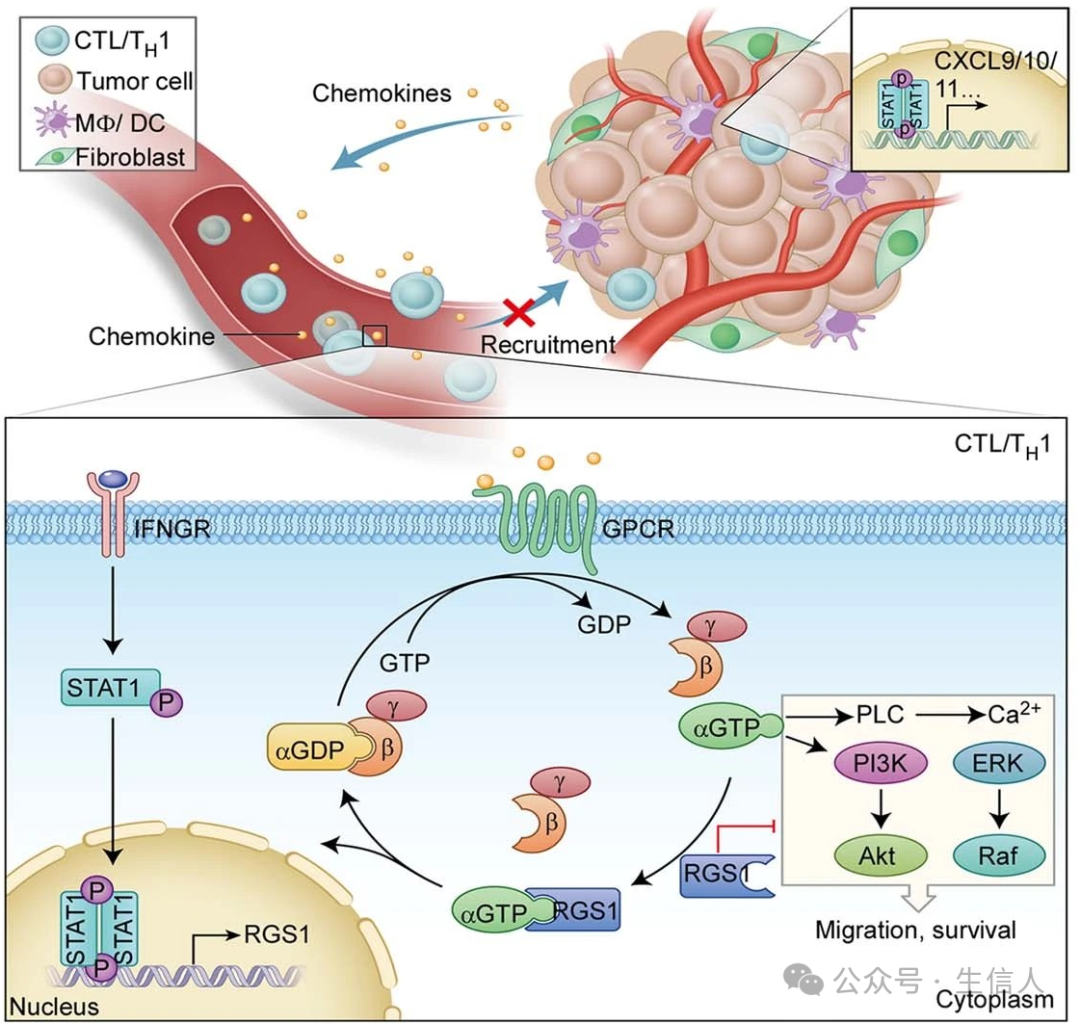 图 5 RGS1表达机制的设计及其对CTL和TH1细胞运输的作用(Huang, 2021)
图 5 RGS1表达机制的设计及其对CTL和TH1细胞运输的作用(Huang, 2021)
2021 年 4 月 12 日 ,中山大学孙逸仙纪念医院 宋尔卫/苏士成 合作课题组在 Nature Cancer 杂志上发表论文[11]。团队通过比较化疗前和化疗后肿瘤微环境中肿瘤相关巨噬细胞的 mRNA 的表达以及蛋白组学的差异,发现化疗后的巨噬细胞同时具有促进肿瘤进展及抗肿瘤免疫两种作用。 该研究首次构建了巨噬细胞条件敲除 IRENA 的小鼠,鉴定出 lncRNA IRENA 在促进肿瘤进展中具有重要作用,对开发化疗新型靶点提供了新思路!
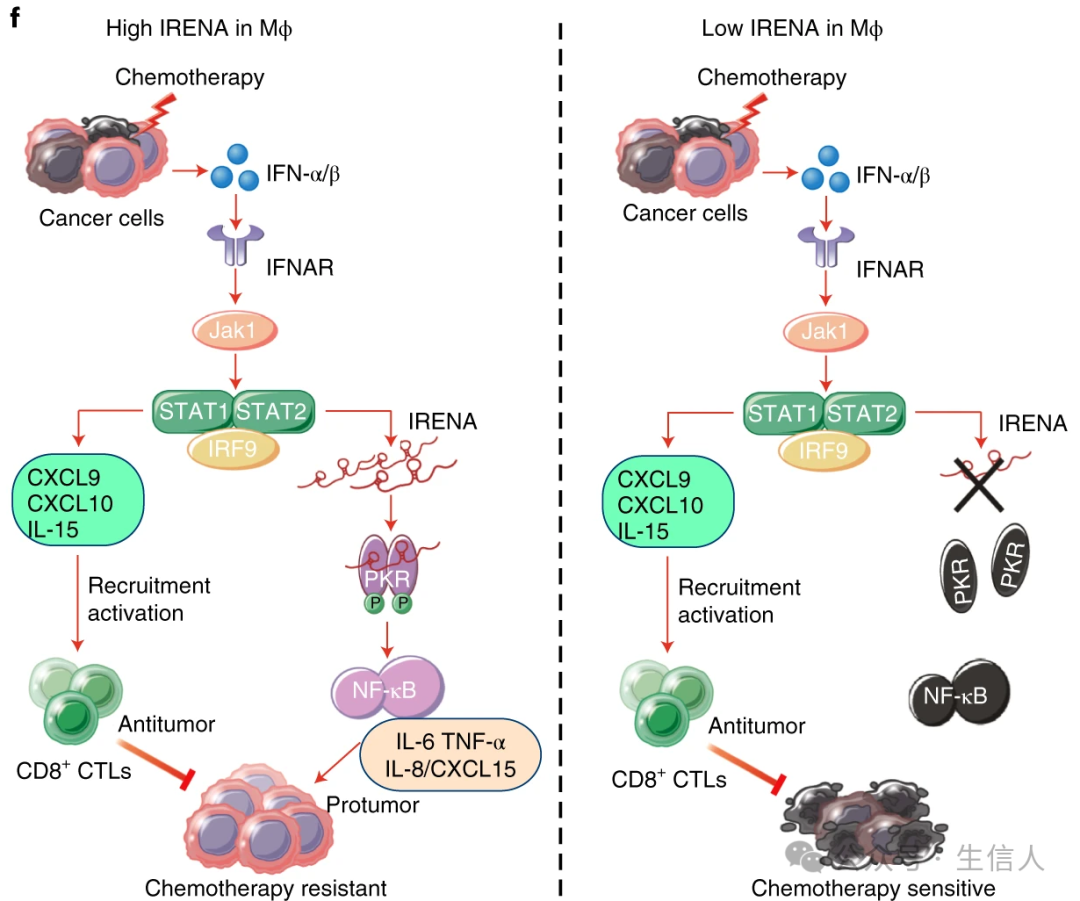 图 6 TAMs调控肿瘤化疗疗效的分子机制示意图(Jiang, 2021)
图 6 TAMs调控肿瘤化疗疗效的分子机制示意图(Jiang, 2021)
2023年12月13日 , 宋尔卫 团队在 环状RNA 研究领域再获新进展,在国际顶尖学术期刊 Nature 上在线发表论文[12]。该研究发现了一种 肿瘤细胞特异性环状RNA——circFAM53B ,其通过非经典翻译产生的 隐性抗原肽 ,能够有效驱动抗肿瘤免疫,这项研究表明利用肿瘤特异性环状RNA进行疫苗接种,可能是一种针对恶性肿瘤的免疫治疗策略。
 图 7 临床乳腺癌标本中TSA筛查的示意图(Huang, 2023)
图 7 临床乳腺癌标本中TSA筛查的示意图(Huang, 2023)
如果把肿瘤比作种子,肿瘤微环境就是让种子生根发芽的土壤。除了肿瘤局部微环境,人体全身都属于肿瘤的生态系统的一部分,远处的器官组织也会与肿瘤发生相互作用,导致肿瘤的远处转移。 宋尔卫团队 多年磨一剑,打通整个环路。2020年6月11日在国际顶尖期刊 Natur e杂志在线发表了研究论文[13]。该研究显示 NETs在乳腺癌和结肠癌患者的肝转移中富集,而血清NETs可以预测早期乳腺癌患者肝转移的发生。 文章同时指出该研究发现代表了遏制癌症扩散的一项重要进展,并可能导致制定一项特定策略以终止NET促进癌症转移。此外, 所提供的数据指出了通过监测血液中的NET DNA来预测肝转移的可能方法。
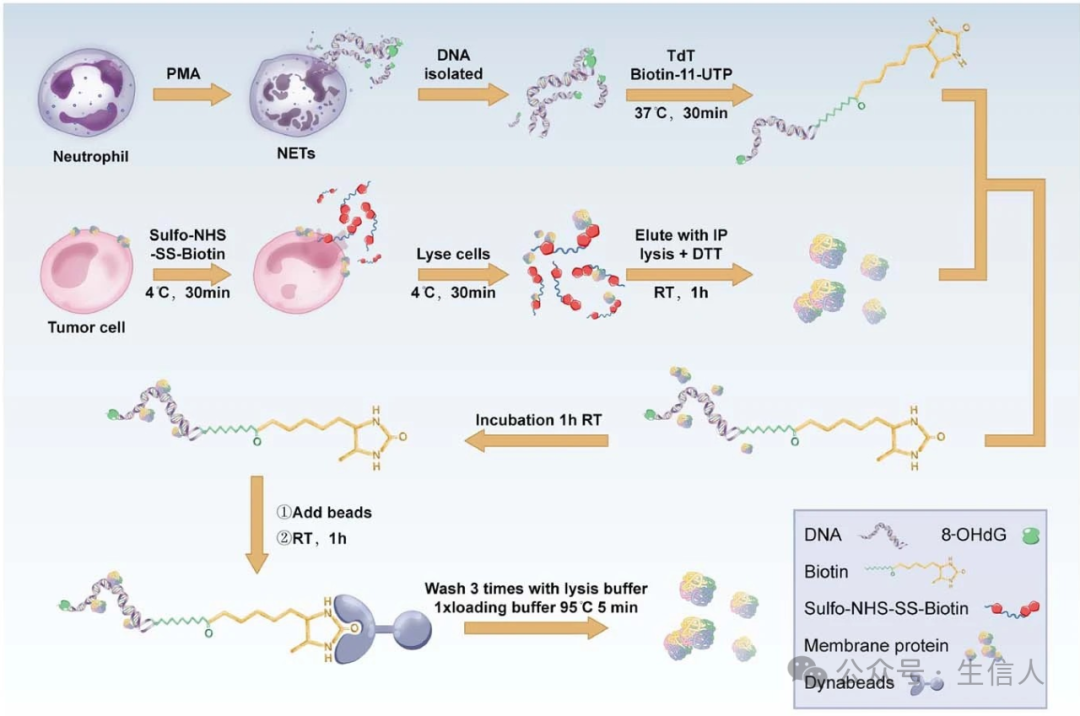 图 8 机制示意图(Yang, 2020)
图 8 机制示意图(Yang, 2020)
除了肿瘤转移,宋院士团队的研究也涉及肿瘤耐药方向。细胞周期蛋白D1是最重要的肿瘤蛋白之一,可促进癌细胞增殖和他莫昔芬耐药,不过其关键机制尚不明确。 2020年11月2日 宋尔卫 团队在 Nature Communications 杂志在线发表了研究论文[14]。 该研究发现长链非编码核糖核酸DILA1可与细胞周期蛋白D1相互作用,并且过表达于他莫昔芬耐药乳腺癌细胞。 细胞周期蛋白D1编码基因翻译后失调,对于乳腺癌他莫昔芬耐药具有重要意义。此外,DILA1可调节细胞周期蛋白D1稳定性,有望成为逆转他莫昔芬耐药的新靶点。
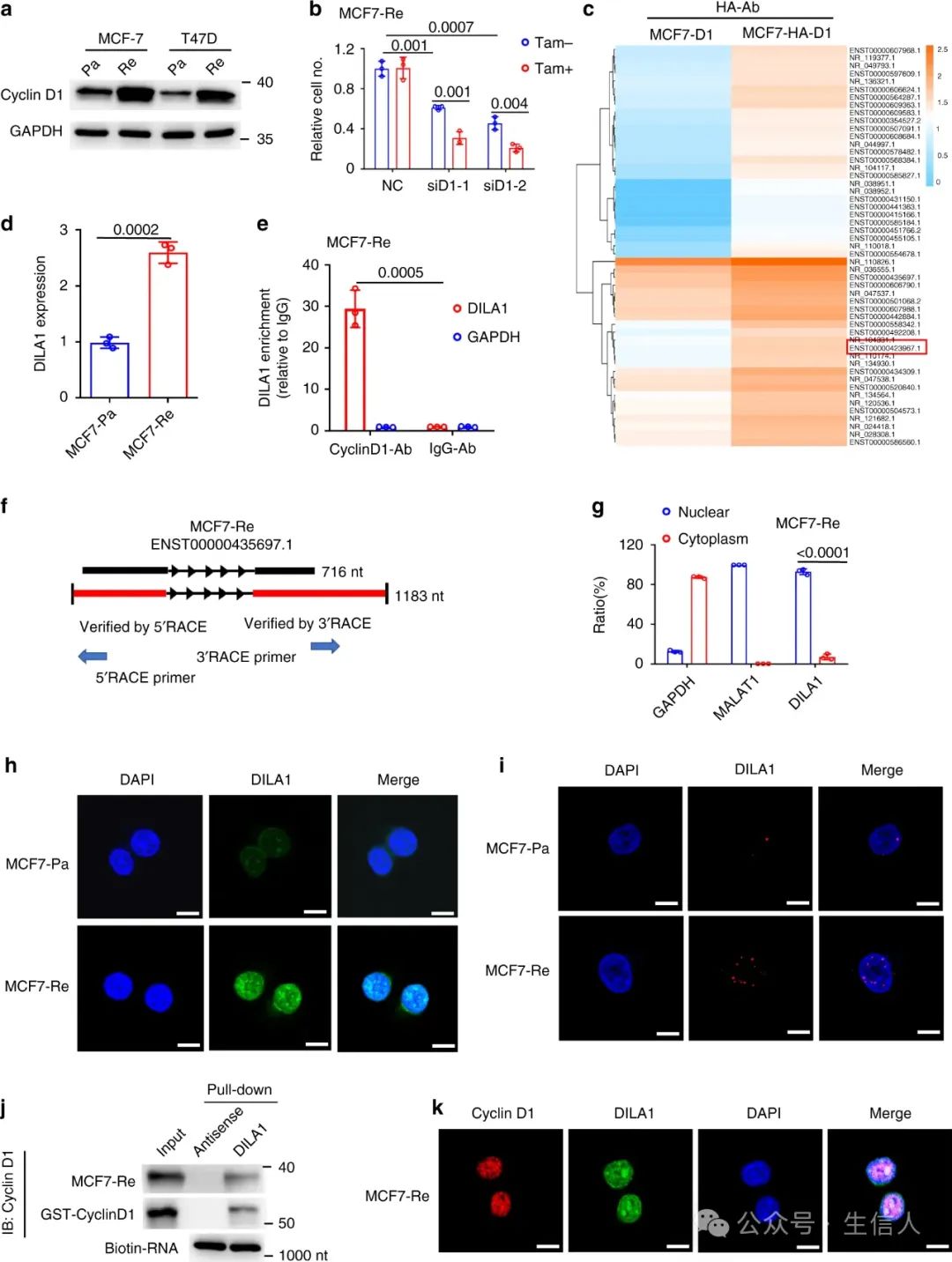 图 9 细胞周期蛋白D1相互作用的 lncRNA DILA1在他莫昔芬耐药乳腺癌细胞中过表达,细胞周期蛋白 D1 蛋白上调(Shi, 2020)
图 9 细胞周期蛋白D1相互作用的 lncRNA DILA1在他莫昔芬耐药乳腺癌细胞中过表达,细胞周期蛋白 D1 蛋白上调(Shi, 2020)
作为一位肿瘤学出身的医学专家,宋尔卫院士领衔开展了多项临床试验以提高肿瘤患者的预后。接下来我们简要关注一下他的团队这些年发表的以临床试验为核心的研究成果。
2020年5月24日 ,宋尔卫团队在 Journal for ImmunoTherapy of Cancer 杂志发表了研究论文[15],该研究证实,中国原研PD-1抑制剂卡瑞利珠单抗联合血管内皮细胞生长因子受体2(VEGFR-2)抑制剂阿帕替尼,治疗晚期三阴性乳腺癌(TNBC)具有有效性和安全性, 这意味着全球首个免疫联合抗血管靶向治疗晚期TNBC II期临床研究取得阳性结果,中国学者TNBC免疫联合治疗临床研究进展领先全球。
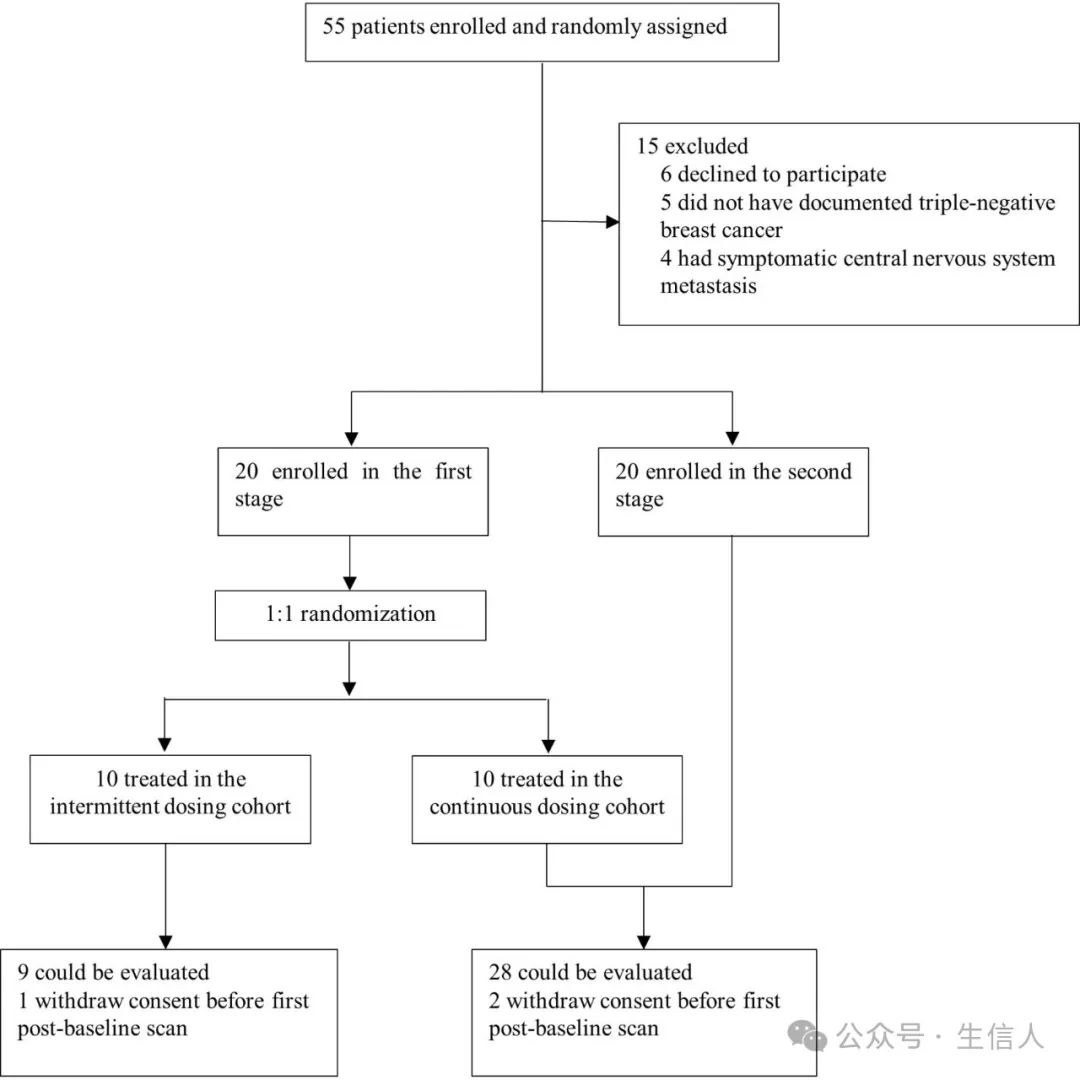 图 10 试验流程图(Liu, 2020)
图 10 试验流程图(Liu, 2020)
2022年5月31日 , 宋尔卫院士 团队主导的一项II期临床研究 (NCT04303741),发现 卡瑞利珠单抗 (Camrelizumab) 联合阿帕替尼 (Apatinib) 与艾瑞布林 (Eribulin) 的三联合疗法 对晚期后线治疗TNBC患者有良好的临床疗效,且毒副作用可控,为晚期TNBC患者的治疗提供了新方案。研究成果发表在 Nature Communication s[16]。 该前瞻性研究证实了卡瑞利珠单抗联合阿帕替尼和艾瑞布林在既往接受过治疗的aTNBC患者中表现出良好的安全性和有效性。
 图 11 试验流程图(Liu, 2022)
图 11 试验流程图(Liu, 2022)
2024年宋尔卫团队发表了两篇临床试验的研究,发表在 Cell Reports Medicine 的论文[17]旨在 探索吡咯替尼(一种泛HER酪氨酸激酶抑制剂)联合化疗在luminal/HER2-low早期乳腺癌患者中的疗效和安全性的临床前研究和2期临床试验。 另一篇发表在 JOURNAL OF CLINICAL ONCOLOGY 的论文[18]是一项全球I期临床试验, 研究了SHR-A1811——一种针对人表皮生长因子受体2(HER2)的抗体-药物偶联物(ADC),在HER2表达或突变的晚期实体瘤患者中的安全性、耐受性、抗肿瘤活性和药代动力学特性。
早在2020年,宋尔卫院士团队就开始结合人工智能应用于医学领域。 医学领域基于人工智能的影像组学的发展使得早期乳腺癌患者的低危和高危患者的识别成为可能,并为临床决策提供了有用的指导。 团队之前一项招募了 294 名浸润性乳腺癌患者的研究发现,MRI影像组学与 DFS 之间存在关联。
2020年12月8日 , 宋尔卫 团队在 JAMA Network Open 杂志[19]在线发表中山大学孙逸仙纪念医院等多中心的研究报告, 开发并验证了用于术前确定腋窝淋巴结转移并预测早期乳腺癌患者无病生存的动态对比增强磁共振影像特征人工智能分析方法。 这项多中心研究的招募增加了 321.1%,证实了 MRI影像组学对 DFS 的预测能力。
 图 12 放射学特征提取的工作流程(Yu, 2020)
图 12 放射学特征提取的工作流程(Yu, 2020)
DNA双链断裂(DSBs)若未正确修复会导致基因组不稳定和疾病。ATM蛋白激酶在DSBs应答中既负责修复信号传递,又通过调控组蛋白H2A泛素化抑制转录,维持基因组稳定性,但其具体机制尚不明确。
2020年9月 , 宋尔卫 团队在 Advanced Science 杂志[20]在线发表研究论文, 该研究发现激酶ATM通过直接结合并磷酸化PBAF复合物亚基BRD7,促进 DSBs处转录活性的停滞以及进一步增强DNA修复效应蛋白的募集,从而维持基因组-表观组的完整性。
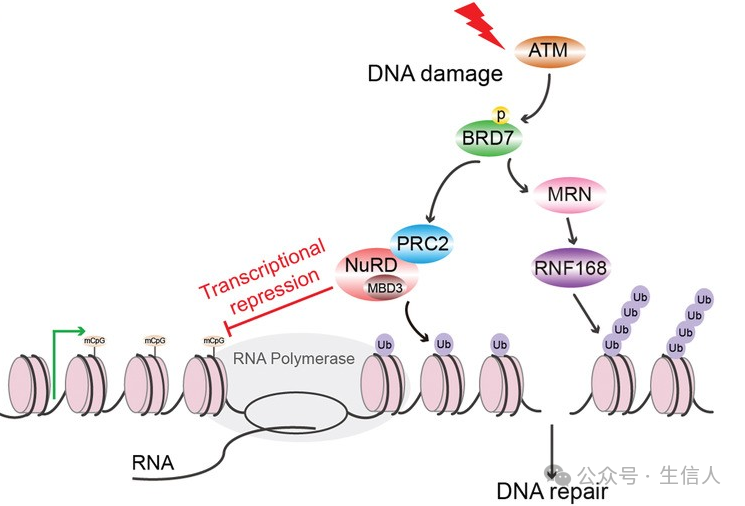 图 13 PBAF亚基BRD7在协调DSB诱导的转录抑制和HR修复中的作用模型(Hu, 2020)
图 13 PBAF亚基BRD7在协调DSB诱导的转录抑制和HR修复中的作用模型(Hu, 2020)
看到这,我们已经把宋尔卫院士近五年重要研究成果都学习完了。尽管早已迈入天命之年,宋院士依然积极投身于临床、科研一线,每天行程满满。两周去一次深汕院区(中山大学孙逸仙纪念医院深汕院区)出门诊、做手术。2022年更是在全球范围内首次提出“肿瘤生态学”这一学科概念,关于“肿瘤生态学”的著作也正在国内外出版中, 业界认为该学说将推动癌症治疗的新一轮革命。
让我们坚信,我国的乳腺癌研究将一路披荆斩棘,为人类最终战胜癌症杀出一条血路,吹响肿瘤攻坚战的嘹亮号角!
十大肿瘤研究热点,二十大未来一年肿瘤研究的路线
精装白皮书,免费包邮到家

ps: 肿瘤研究的热点文章合集(10个热点+10个高浏览文章)






参考文献:
[1] Shi, Q., Li, Y., Li, S. et al. LncRNA DILA1 inhibits Cyclin D1 degradation and contributes to tamoxifen resistance in breast cancer. Nat Commun 11, 5513 (2020). https://doi.org/10.1038/s41467-020-19349-w.
[2] Chen X, Luo R, Zhang Y, Ye S, Zeng X, Liu J, Huang D, Liu Y, Liu Q, Luo ML, Song E. Long noncoding RNA DIO3OS induces glycolytic-dominant metabolic reprogramming to promote aromatase inhibitor resistance in breast cancer. Nat Commun. 2022 Nov 22;13(1):7160. doi: 10.1038/s41467-022-34702-x. PMID: 36418319; PMCID: PMC9684133.
[3] Luo R, Wu J, Chen X, Liu Y, Liu D, Song E, Luo ML. ATR/Chk1 interacting lncRNA modulates DNA damage response to induce breast cancer chemoresistance. Cell Insight. 2024 Jul 14;3(5):100183. doi: 10.1016/j.cellin.2024.100183. PMID: 39148723; PMCID: PMC11325286.
[4] Hu H, Zhang H, Xing Y, Zhou Y, Chen J, Li C, Xu J, Guo Y, Wang J, He Q, Liu X, Sheng J, Song E, Wu Y, Huang H. The lncRNA THOR interacts with and stabilizes hnRNPD to promote cell proliferation and metastasis in breast cancer. Oncogene. 2022 Dec;41(49):5298-5314. doi: 10.1038/s41388-022-02495-4. Epub 2022 Nov 3. PMID: 36329124.
[5] Zhang Y, Wei S, Chen Z, Xu R, Li SR, You L, Wu R, Zhang Y, Liao JY, Xu X, Song E, Luo ML. LncRNA FAISL Inhibits Calpain 2-Mediated Proteolysis of FAK to Promote Progression and Metastasis of Triple Negative Breast Cancer. Adv Sci (Weinh). 2024 Nov;11(42):e2407493. doi: 10.1002/advs.202407493. Epub 2024 Sep 17. PMID: 39287113; PMCID: PMC11558121.
[6] Liang G, Ling Y, Mehrpour M, Saw PE, Liu Z, Tan W, Tian Z, Zhong W, Lin W, Luo Q, Lin Q, Li Q, Zhou Y, Hamai A, Codogno P, Li J, Song E, Gong C. Autophagy-associated circRNA circCDYL augments autophagy and promotes breast cancer progression. Mol Cancer. 2020 Mar 25;19(1):65. doi: 10.1186/s12943-020-01152-2IF: 27.7 Q1 . PMID: 32213200; PMCID: PMC7093993.
[7] Zheng, F., Chen, J., Zhang, X. et al. The HIF-1α antisense long non-coding RNA drives a positive feedback loop of HIF-1α mediated transactivation and glycolysis. Nat Commun 12, 1341 (2021). https://doi.org/10.1038/s41467-021-21535-3.
[8] Guo Q, Li Y, Zhang Y, Shen L, Lin H, Chen J, Song E, Luo ML. LncRNA NRON promotes tumorigenesis by enhancing MDM2 activity toward tumor suppressor substrates. EMBO J. 2023 Aug 15;42(16):e112414. doi: 10.15252/embj.2022112414. Epub 2023 Jun 29. PMID: 37382239; PMCID: PMC10425849.
[9] Man-Li Luo, Jingjing Li, Liping Shen, Junjun Chu, Qiannan Guo, Guorun Liang, Wei Wu, Jianing Chen, Rufu Chen, Erwei Song, The Role of APAL/ST8SIA6-AS1 lncRNA in PLK1 Activation and Mitotic Catastrophe of Tumor Cells, JNCI: Journal of the National Cancer Institute, Volume 112, Issue 4, April 2020, Pages 356–368, https://doi.org/10.1093/jnci/djz134.
[10] Huang, D., Chen, X., Zeng, X. et al. Targeting regulator of G protein signaling 1 in tumor-specific T cells enhances their trafficking to breast cancer. Nat Immunol 22, 865–879 (2021). https://doi.org/10.1038/s41590-021-00939-9.
[11] Liu, J., Lao, L., Chen, J. et al. The IRENA lncRNA converts chemotherapy-polarized tumor-suppressing macrophages to tumor-promoting phenotypes in breast cancer. Nat Cancer 2, 457–473 (2021). https://doi.org/10.1038/s43018-021-00196-7.
[12] Huang, D., Zhu, X., Ye, S. et al. Tumour circular RNAs elicit anti-tumour immunity by encoding cryptic peptides. Nature 625, 593–602 (2024). https://doi.org/10.1038/s41586-023-06834-7.
[12] Yang, L., Liu, Q., Zhang, X. et al. DNA of neutrophil extracellular traps promotes cancer metastasis via CCDC25. Nature 583, 133–138 (2020). https://doi.org/10.1038/s41586-020-2394-6.
[13] Shi, Q., Li, Y., Li, S. et al. LncRNA DILA1 inhibits Cyclin D1 degradation and contributes to tamoxifen resistance in breast cancer. Nat Commun 11, 5513 (2020). https://doi.org/10.1038/s41467-020-19349-w.
[14] Shi, Q., Li, Y., Li, S. et al. LncRNA DILA1 inhibits Cyclin D1 degradation and contributes to tamoxifen resistance in breast cancer. Nat Commun 11, 5513 (2020). https://doi.org/10.1038/s41467-020-19349-w.
[15] Liu J, Liu Q, Li Y, Li Q, Su F, Yao H, Su S, Wang Q, Jin L, Wang Y, Lau WY, Jiang Z, Song E. Efficacy and safety of camrelizumab combined with apatinib in advanced triple-negative breast cancer: an open-label phase II trial. J Immunother Cancer. 2020 May;8(1):e000696. doi: 10.1136/jitc-2020-000696. PMID: 32448804; PMCID: PMC7252975.
[16] Liu J, Wang Y, Tian Z, Lin Y, Li H, Zhu Z, Liu Q, Su S, Zeng Y, Jia W, Yang Y, Xu S, Yao H, Jiang W, Song E. Multicenter phase II trial of Camrelizumab combined with Apatinib and Eribulin in heavily pretreated patients with advanced triple-negative breast cancer. Nat Commun. 2022 May 31;13(1):3011. doi: 10.1038/s41467-022-30569-0. PMID: 35641481; PMCID: PMC9156739.
[17] Gong C, Xia Y, Zhu Y, Yang Y, Lin Q, Liu Q, Yang W, Ling L, Zhong J, Duan Z, Zeng Y, Cheng Z, Shen J, Zeng Y, Chow LWC, Song E. Preclinical study and phase 2 trial of neoadjuvant pyrotinib combined with chemotherapy in luminal/HER2-low breast cancer: PILHLE-001 study. Cell Rep Med. 2024 Nov 19;5(11):101807. doi: 10.1016/j.xcrm.2024.101807. Epub 2024 Nov 6. PMID: 39510070; PMCID: PMC11604489.
[18] Yao H, Yan M, Tong Z, Wu X, Ryu MH, Park JJ, Kim JH, Zhong Y, Zhao Y, Voskoboynik M, Yin Y, Liu K, Kaubisch A, Liu C, Zhang J, Wang S, Im SA, Ganju V, Barve M, Li H, Ye C, Roy AC, Bai LY, Yen CJ, Gu S, Lin YC, Wu L, Bao L, Zhao K, Shen Y, Rong S, Zhu X, Song E. Safety, Efficacy, and Pharmacokinetics of SHR-A1811, a Human Epidermal Growth Factor Receptor 2-Directed Antibody-Drug Conjugate, in Human Epidermal Growth Factor Receptor 2-Expressing or Mutated Advanced Solid Tumors: A Global Phase I Trial. J Clin Oncol. 2024 Oct 10;42(29):3453-3465. doi: 10.1200/JCO.23.02044. Epub 2024 Jun 20. PMID: 38900984.
[19] Yu Y, Tan Y, Xie C, Hu Q, Ouyang J, Chen Y, Gu Y, Li A, Lu N, He Z, Yang Y, Chen K, Ma J, Li C, Ma M, Li X, Zhang R, Zhong H, Ou Q, Zhang Y, He Y, Li G, Wu Z, Su F, Song E, Yao H. Development and Validation of a Preoperative Magnetic Resonance Imaging Radiomics-Based Signature to Predict Axillary Lymph Node Metastasis and Disease-Free Survival in Patients With Early-Stage Breast Cancer. JAMA Netw Open. 2020 Dec 1;3(12):e2028086. doi: 10.1001/jamanetworkopen.2020.28086IF: 10.5 Q1 . PMID: 33289845; PMCID: PMC7724560.
[20] Hu K, Li Y, Wu W, Xie L, Yan H, Cai Y, Chen D, Jiang Q, Lin L, Chen Z, Liao JY, Zhang Y, Koeffler HP, Yin D, Song E. ATM-Dependent Recruitment of BRD7 is required for Transcriptional Repression and DNA Repair at DNA Breaks Flanking Transcriptional Active Regions. Adv Sci (Weinh). 2020 Sep 3;7(20):2000157. doi: 10.1002/advs.202000157. PMID: 33101843; PMCID: PMC7578904.
链接:http://www.lewenyixue.com/2025/01/03/%E5%AE%9E%E5%8A%9B%E4%B8%8E%E4%BA%89%E8%AE%AE%E5%B9%B6%E5%AD%98%EF%BC%9A%E5%85%AD%E5%8D%83%E5%AD%97%E9%95%BF%E6%96%87%E8%B5%B7%E5%BA%95%E5%AE%8B%E5%B0%94%E5%8D%AB%E9%99%A2%E5%A3%AB/