中国博后一作Cell论文:发现帮助癌细胞逃逸CAR-T细胞治疗的关键蛋白,并找到“解药”

撰文丨nagashi
编辑丨王多鱼
排版丨水成文
癌症 是世界上最难治愈的疾病之一。 CAR-T 细胞疗法等一系列癌症免疫疗法的兴起,为癌症治疗带来的新希望。然而,CAR-T 细胞疗法难以持久缓解 B细胞恶性肿瘤,这一现象通常可归因于抗原逃逸。例如,CD19 靶向的 CAR-T 细胞疗法中,有28%-68% 的患者在治疗过程中癌细胞会降低或失去 CD19 表达,从而导致治疗效果降低甚至丧失。
值得注意的是,恶性B细胞转化和致癌生长依赖于有效的 ATP合成 ,但其潜在机制尚不清楚。
2024年12月17日,希望之城国家医疗中心 陈建军 教授、 邓晓岚 研究副教授及博士后 陈振华 等在国际顶尖学术期刊 Cell上发表了题为: YTHDF2 promotes ATP synthesis and immune evasion in B-cell malignancies的研究论文。
该研究首次发现, YTHDF2 促进 B细胞恶性肿瘤 的能量供应和抗原逃逸,仅其过表达就足以引起B细胞转化和肿瘤发生。更重要的是,研究团队还证实,一种名为 CCI-38 的小分子能够靶向和抑制 YTHDF2,从而抑制侵袭性B细胞恶性肿瘤并提高 CAR-T 细胞疗法的效果,由此揭示了“ 小分子抑制剂+CAR-T ”可能是一种治疗B细胞恶性肿瘤的有效疗法。


陈振华 ,2011年本科毕业于黑龙江大学,2016年博士毕业于中山大学,2016-2018年在中山大学进行博士后研究工作,2018年至今在美国希望之城国家癌症中心贝克曼研究所进行博士后研究工作。
B 细胞恶性肿瘤 ,包括B细胞急性淋巴细胞白血病和 B 细胞淋巴瘤,已经被基于 T 细胞的免疫疗法 (例如CAR-T细胞疗法)彻底改变。在多中心临床试验中,B细胞恶性肿瘤患者在接受 CD19-CAR-T 细胞治疗后,完全缓解率为 40%-81%。
然而,大约 50% 的缓解患者在治疗的第一年内复发,而约 20% 的患者在接受 CAR-T 细胞治疗后未能进入缓解期。此外,即使是双靶点疗法,抗原逃逸仍然发生在约 50% 的复发或难治性 B 细胞恶性肿瘤患者中。因此,为了改善长期缓解结果,深入探究恶性 B 细胞中潜在的抗原逃逸机制是十分必要的。
在这项最新研究中,研究团队首先注意到,B 细胞群在所有造血细胞系中具有最高的 m6A 修饰丰度。RNA 修饰控制着 mRNA 的命运,并影响广泛的细胞生理过程,。m6A 是mRNA中最丰富的内部修饰 (约0.2%-0.7%) ,其被 YTHDF家族成员等“RNA读取器” (Reader)识别。
值得一提的是, YTHDF2 通过诱导 mRNA 降解来识别/破坏 m6A 修饰的 mRNA,在癌症中发挥关键作用。此外,一些研究也证明了 YTHDF2 介导的 m6A 机制促进了急性髓性白血病 (AML) 和肝脏恶性肿瘤的发生发展,但其在正常和恶性 B 细胞发育中的作用尚未被研究。
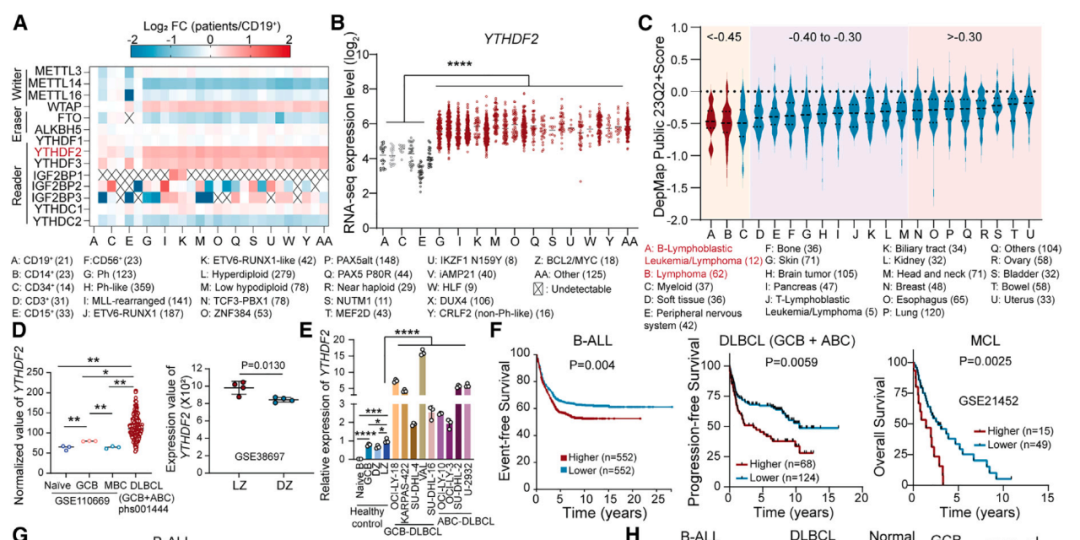
在上述发现的基础上,研究团队分析了 2000 多名 B 细胞急性淋巴细胞白血病 (B-ALL) 患者的RNA-seq数据集, 发现 YTHDF2 在 B-ALL 中始终且最显著过表达 。进一步研究表明,致癌转录因子 MYC、STAT3 和 POU2AF1 等促进了 YTHDF2 的表达。
此外,CRISPR-Cas9敲除筛选和体外过表达实验均表明,YTHDF2 对 B 细胞恶性肿瘤的存活十分重要,并深刻地影响其生长和增殖以及患者的预后。
YTHDF2在B细胞恶性肿瘤中过表达并发挥致癌作用
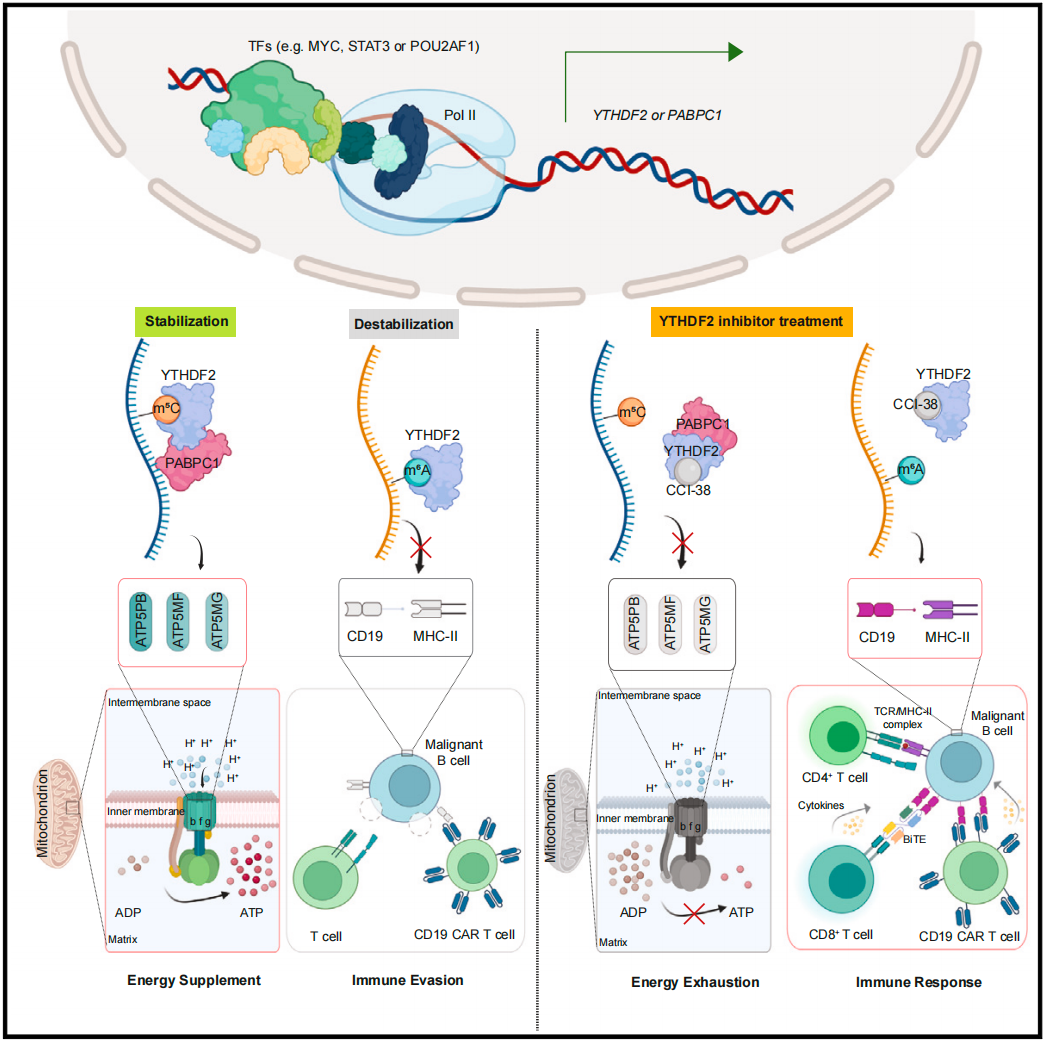
值得注意的是,与髓系白血病细胞相比,恶性 B 细胞分裂速度更快,但携带的线粒体数量只有前者一半,这意味着恶性 B 细胞需要额外的 ATP 补充。研究团队发现, YTHDF2 促进 B 细胞恶性肿瘤的能量供应和抗原逃逸,仅其过表达就足以引起B细胞转化和肿瘤发生。
从机制上说,YTHDF2 具有双重读取器 (Reader) 的功能:在一方面,它可以作 m5C 读取器,通过招募 PABPC1 来稳定 mRNA,从而增强 ATP5PB/ATP5MF/ATP5MG 的 mRNA 稳定性来促进线粒体氧化磷酸化 (OXPHOS) 和 ATP 合成。另一方面,YTHDF2 还可以作为 m6A 读取器,通过破坏其他 mRNA 的稳定性来促进免疫逃避,例如抑制 CD19 和 HLA-DMA/B (MHC II类分子) 的表达。
YTHDF2促进恶性B细胞中ATP的合成,而不依赖于m6A修饰
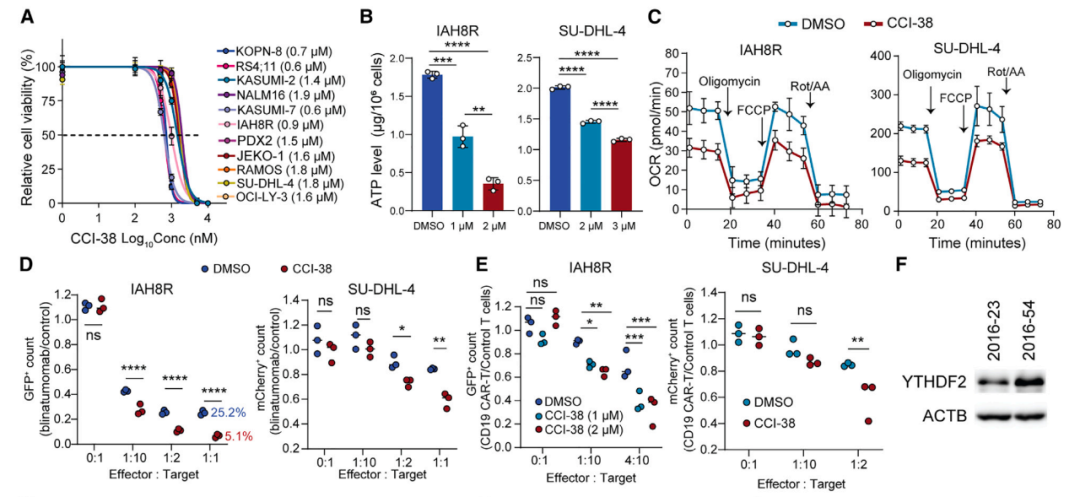
与此相印证,通过 CRISPR-Cas9 基因敲除 YTHDF2,或是通过小分子抑制剂 CCI-38 靶向抑制 YTHDF2,显著增加了复发或难治性 B 细胞恶性肿瘤对 CD19-CAR-T 细胞疗法或 Blinatumumab (一种CD3-CD19双特异性抗体) 的敏感性。
更重要的是,研究团队还证明了 YTHDF2 对于正常的 B 细胞发育是可有可无的 。因此,靶向抑制 YTHDF2 是治疗 B 细胞恶性肿瘤的十分有前景的新靶点。
小分子CCI-38具有强大的抗肿瘤效果,并与基于T细胞的免疫疗法协同治疗B细胞恶性肿瘤
总的来说,这项发表于 Cell 的研究表明,YTHDF2 在 B 细胞恶性肿瘤的起始、进展和免疫逃避中发挥着关键的致癌作用。YTHDF2 的小分子抑制剂 CCI-38 与 CD19-CAR-T 细胞疗法或 CD3-CD19 双特异性抗体的联合应用,是治疗 B 细胞恶性肿瘤的一种有希望的潜在策略,可以实现高疗效、低成本和最小化治疗相关毒性。这可能会改变我们未来治疗B细胞恶性肿瘤的方式。
据悉,针对这项研究,希望之城团队已提交专利申请,这对于改善 CAR-T 细胞疗法对癌症及严重自身免疫病患者的治疗具有重要意义。研究团队接下来将重点关注提高 CCI-38 的安全性和有效性、探索从癌细胞中抑制或清除 YTHDF2 的新方法,以及开展人体临床试验。
希望之城国家医疗中心博士后研究员 陈振华 、暨南大学血液学研究所/广州医科大学附属第五医院血液内科 曾成武 教授、希望之城国家医疗中心 杨露 研究副教授及 车远 博士为论文共同第一作者;希望之城国家医疗中心 陈建军 教授、 邓晓岚 研究副教授及 陈振华 为论文共同通讯作者。
https://www.cell.com/cell/abstract/S0092-8674(24)01324-2
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2025/01/03/%E4%B8%AD%E5%9B%BD%E5%8D%9A%E5%90%8E%E4%B8%80%E4%BD%9CCell%E8%AE%BA%E6%96%87%EF%BC%9A%E5%8F%91%E7%8E%B0%E5%B8%AE%E5%8A%A9%E7%99%8C%E7%BB%86%E8%83%9E/
THE END