Cancer Cell | AI识别尿路上皮癌的分子亚型,谁是免疫治疗的真命天子?
撰文: six
IF : 48.8
推荐度: 
亮点:
1. 首次通过机器学习揭示尿路上皮癌的四大分子亚型,并阐明其独特的肿瘤微环境特征。
2. 精准预测:数字病理学实现了通过 H&E 切片直接预测分子亚型的可能性,为快速临床分型铺平道路。
3. 治疗革新:明确 PD-L1 抑制剂治疗的获益人群,为个性化疗法的设计提供新依据。
1 、前言
近年来,免疫检查点抑制剂的出现,掀起了肿瘤治疗的新浪潮。然而,对于尿路上皮癌( UC )患者, PD-L1 抑制剂的疗效差异明显。为什么有些患者受益匪浅,而另一些却无动于衷?
近日,发表在《 Cancer Cell 》杂志上的一篇题为“ Molecular heterogeneity in urothelial carcinoma anddeterminants of clinical benefit to PD-L1 blockade ”的研究论文为我们带来了全新视角,突破传统的“单一治疗适应症”框架,探索 UC 的分子异质性如何影响免疫治疗的成功与否。
2 、研究背景
尿路上皮癌是男性常见的恶性肿瘤之一,年新发病例超 8 万,死亡人数近 2 万。 PD-L1 抑制剂近年来获得批准,用于治疗不同阶段的 UC 。然而,只有部分患者对这种免疫疗法产生积极响应。传统生物标志物如 PD-L1 免疫组化和肿瘤突变负荷难以有效预测疗效,这也使得明确 UC 的分子异质性成为亟待解决的难题。
本研究整合了四项大型随机对照试验的数据,试图通过多组学分析及机器学习,分解 UC 背后的分子复杂性,为精准治疗提供新思路。
3 、研究内容
肿瘤微环境中的“性格特征”
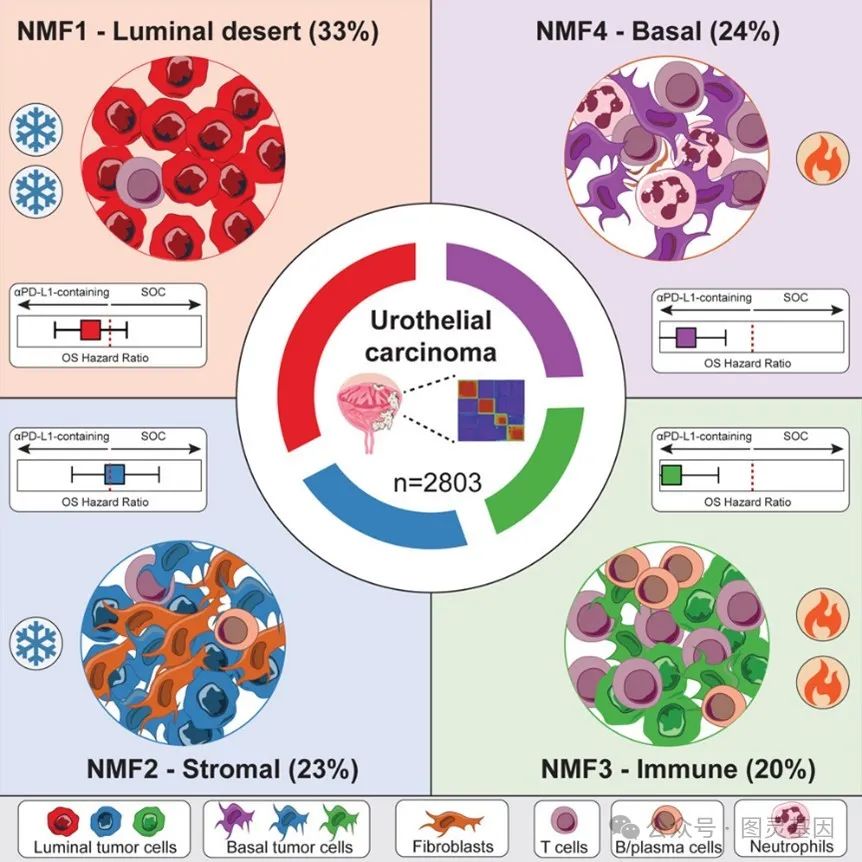
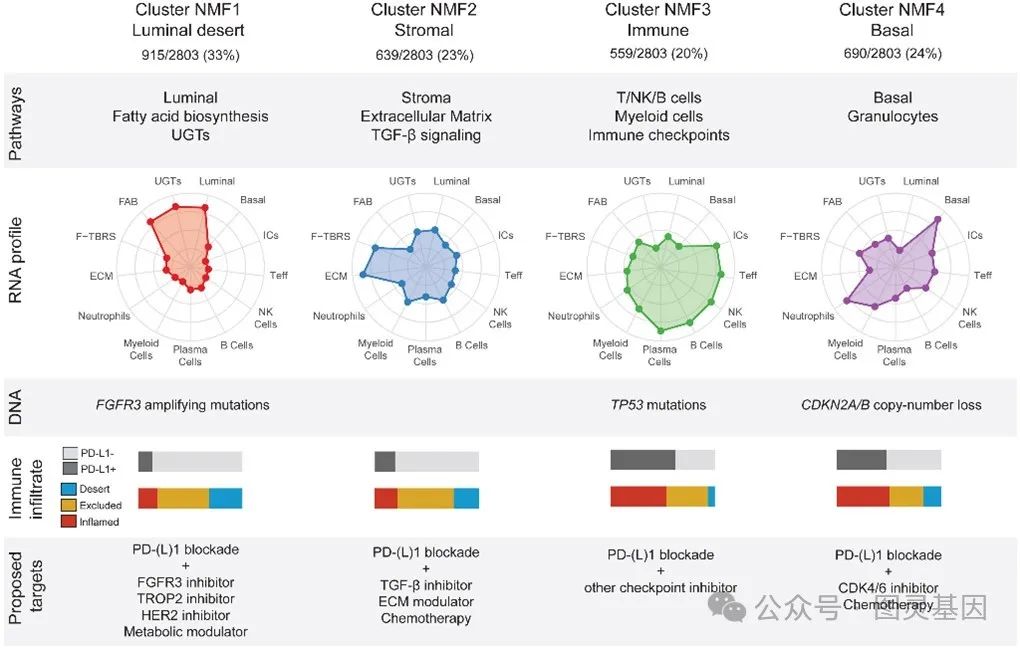
通过对 2803 名 UC 患者的肿瘤样本进行 RNA 测序,研究团队应用非负矩阵分解( NMF )算法,结合其他多组学数据,识别出了四种分子亚型。首先是 Luminal Desert (腔型贫免疫型),这一亚型的肿瘤微环境中免疫浸润极低,几乎没有 T 细胞和 B 细胞的参与,同时表现出显著的代谢活跃特征,表明其免疫反应能力受限。
Stromal (基质型)则以成纤维细胞和细胞外基质信号的显著富集为特征,展现了一个被“屏障”包围的肿瘤环境,这种特性使得免疫细胞难以有效进入肿瘤部位。
与前两种相比, Immune (免疫型)展现出强烈的免疫反应,其肿瘤微环境中充满 T 细胞、 B 细胞和浆细胞等免疫成分,同时伴有较高的 PD-L1 表达,这使得这一亚型成为 PD-L1 抑制剂的潜在受益者。
最后, Basal (基底型)肿瘤表现出独特的基底表型,伴随大量中性粒细胞浸润,提示其免疫微环境中可能存在复杂的炎症反应。
图 1 具有不同肿瘤微环境的尿路上皮癌中的 4 种分子亚型
谁是免疫治疗的“天选之子”?
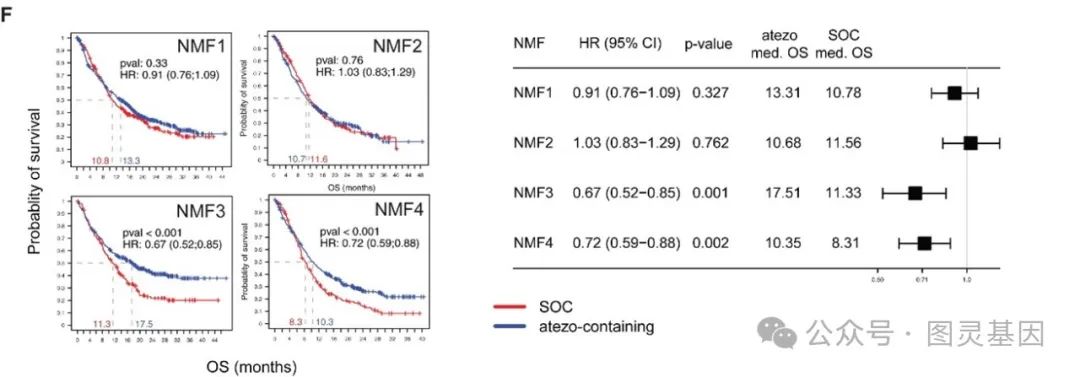
研究团队进一步分析了 PD-L1 抑制剂在不同亚型中的疗效,并揭示了分子特征与治疗效果之间的微妙联系。
对于免疫型( NMF3 )患者来说, PD-L1 抑制剂无疑是“天降神兵”。这些患者的肿瘤不仅具有高水平的 PD-L1 表达,而且富含 B 细胞和效应 T 细胞,最终使他们的中位总生存期达到了 17.5 个月,是所有亚型中表现最为亮眼的。
而基底型( NMF4 )患者中,尽管免疫环境较为复杂,但 PD-L1 高表达者同样显著受益,中位总生存期从传统疗法的 8.3 个月延长至 10.3 个月。
与之相比,腔型贫免疫型( NMF1 )和基质型( NMF2 )则表现出明显的“冷淡”。这些亚型的肿瘤缺乏足够的免疫细胞浸润,特别是在腔型贫免疫型中, T 细胞几乎无法进入肿瘤核心,这使得 PD-L1 抑制剂难以发挥作用。
图 2 每种 NMF 亚型的 OS 概率,蓝色: atezolizumab; 红色:对照
这一发现进一步表明,免疫治疗的成功很大程度上依赖于肿瘤微环境中的免疫细胞活动,而不是单纯的 PD-L1 表达水平。
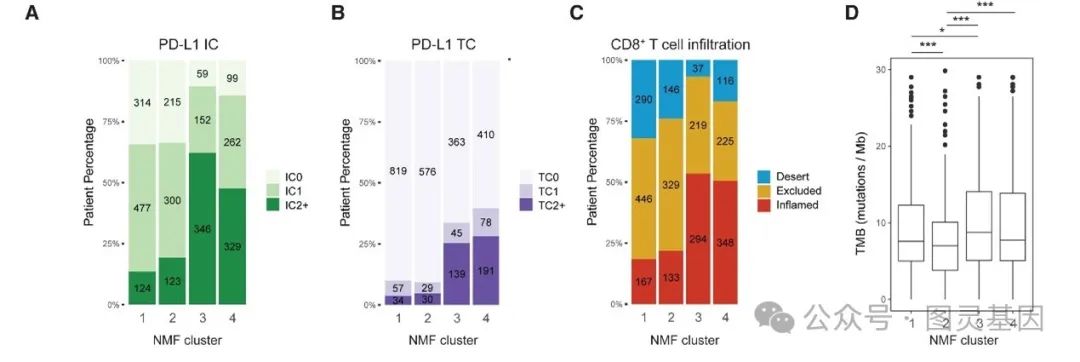
图 3 UC NMF 亚型的生物学特性
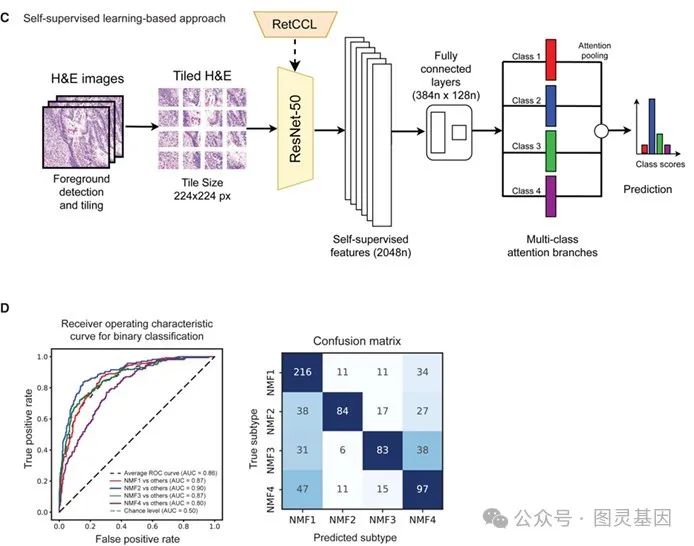
数字病理学:加速分型的未来之路
为了将分子分型的研究成果转化为临床应用,研究团队通过人工智能驱动的深度学习模型,分析超过 1000 张肿瘤切片中的组织特征(如肿瘤细胞密度、免疫细胞浸润等),快速预测患者的分子亚型。该方法在独立验证数据集上的 AUC 高达 0.86 ,特别是在区分免疫型和基底型肿瘤时表现优异。
图 4 预测 UC NMF 亚型的数字病理学
此外,模型还能够准确预测与亚型相关的生物学特征。例如,免疫型肿瘤中淋巴细胞和巨噬细胞的密度显著升高,而基质型肿瘤则展现出更高的成纤维细胞密度和基质信号。
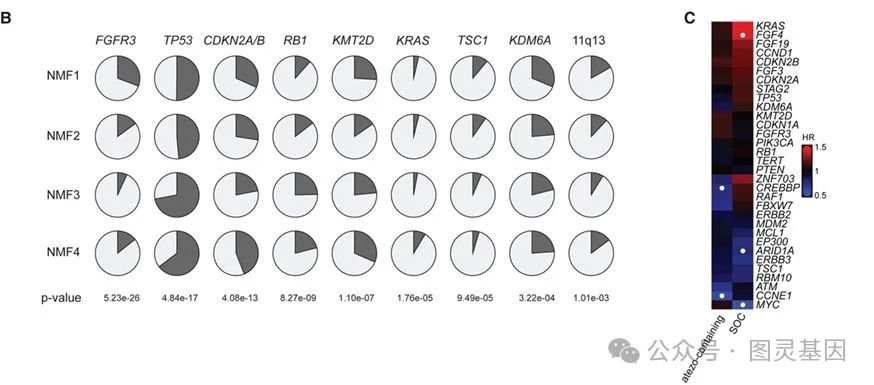
图 5 UC NMF 亚型的体细胞改变
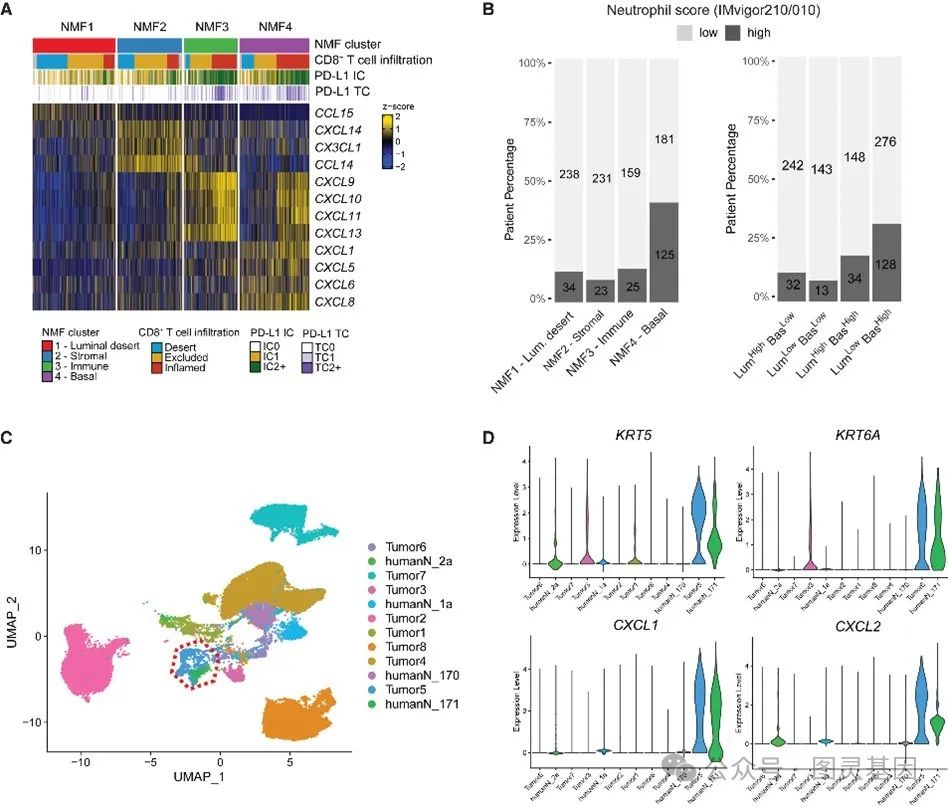
此外,研究还发现基底型( NMF4 )肿瘤中中性粒细胞显著富集,主要由肿瘤细胞高表达粒细胞趋化因子(如 CXCL1 、 CXCL2 )驱动。这种特性塑造了独特的免疫微环境,可能影响其致病性和治疗反应。
图 6 基底肿瘤中中性粒细胞增多
科学的下一步:让治疗更精准
研究团队不仅揭示了分型,还为每种亚型的治疗策略指明了方向。例如,腔型贫免疫型的患者可能从结合 FGFR3 抑制剂的组合疗法中获益;基质型患者则需要联合 TGF- β抑制剂以打破基质屏障;而免疫型和基底型患者,则可以通过调整 PD-L1 抑制剂的联合用药策略进一步提高疗效。
图 7 UC 分子亚型 RNA 谱、富集的体细胞改变、 PD-L1 IC 表达、 CD8 T 细胞浸润模式和拟议的联合治疗靶点
4 、总结
这一研究不仅绘制了膀胱癌的全新分子地图,还让我们看到了精准治疗的无限可能。从发现四种截然不同的分子亚型到揭示免疫治疗的潜在获益人群,这些成果将膀胱癌的治疗从“盲人摸象”带入了“对症下药”的新时代。同时, AI 技术的引入,简化了诊断流程,让复杂的分子分型成为普惠医疗的一部分。
5 、展望
未来,这一分类模型有望在更大范围内推广,并应用于更多癌种。而对于膀胱癌,研究提示我们可以开发针对亚型的组合疗法,比如结合靶向 FGFR3 的药物用于腔隙型,或结合 TGF-β 抑制剂用于基质型。在 AI 与分子生物学技术的助力下,癌症治疗将从粗放式管理走向精准化定制,为每位患者找到最合适的治疗方式。这不仅是肿瘤研究的进步,也是患者福祉的希望所在。
教授介绍
Romain Banchereau 博士是著名的免疫学家和肿瘤生物学家,现任基因泰克( Genentech )公司肿瘤免疫研究的负责人。他的研究专注于肿瘤免疫学、系统性免疫失调(如狼疮)及个性化治疗策略,尤其关注先天免疫与适应性免疫在疾病中的相互作用。他在基因组学和转录组学分析方面拥有深厚的专业背景,通过整合多组学数据解析疾病分子机制。 Banchereau 博士的工作涵盖从基础研究到临床转化的广泛领域,发表了多篇高影响力的论文,包括在《 Nature Medicine 》和其他顶级期刊上的重要成果。
参考文献
Romain Banchereau, et al. Molecular heterogeneityin urothelial carcinoma and determinants of clinical benefit to PD-L1 blockade CancerCell (2024). https://doi.org/10.1016/j.ccell.2024.10.016 .
链接:http://www.lewenyixue.com/2025/01/02/Cancer%20Cell%20%7C%20AI%E8%AF%86%E5%88%AB%E5%B0%BF%E8%B7%AF/







赶快来坐沙发