Br J Cancer| 免疫沙漠和免疫排斥型肿瘤的关键机制和治疗机会
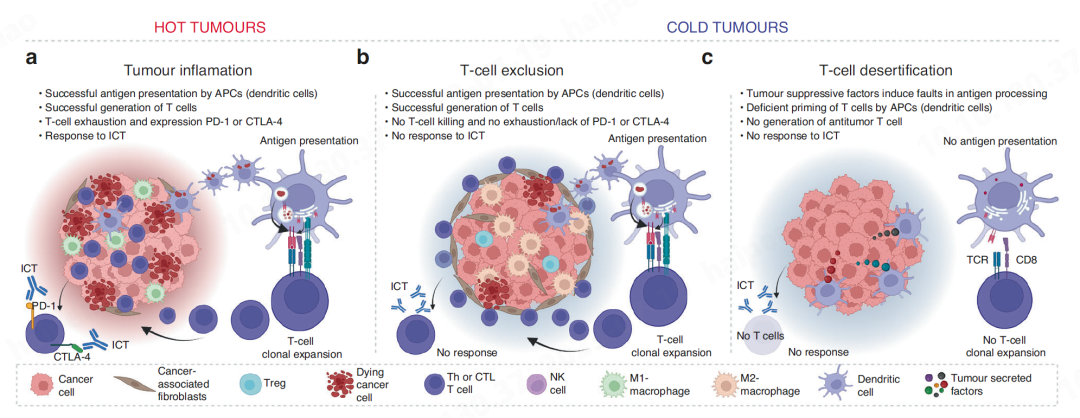
目前 许多患者对免疫 检查点疗法( ICT )难以治疗, 由于 他们的肿瘤被认为是 “ 冷 ” 肿瘤 —— 也就是说,他们不允许 T 细胞(所谓的 “ 沙漠 ” 肿瘤)的产生或现有抗肿瘤 T 细胞( T 细胞除外的肿瘤)的浸润。沙漠型肿瘤通过利用源自其遗传不稳定性的抑制性肿瘤因子靶向 APC 来干扰抗原处理和 T 细胞的启动。相比之下, T 细胞 排斥型 肿瘤的特点是通过障碍物(如纤维化和肿瘤细胞诱导的免疫抑制)阻止有效抗肿瘤 T 淋巴细胞浸润癌症肿块。 因此 深入探讨癌 而对于 T 细胞 “ 荒漠化 ” 和 “ 排斥 ” 的关键机制 目前缺乏系统的研究认识 。
来自芬兰图尔库大学的研究人员在Nature子刊British Journal of Cancer期刊发表《Resistance to immune checkpoint therapies by tumour-induced T-cell desertification and exclusion: key mechanisms, prognostication and new therapeutic opportunities》综述, 该论文深入探讨癌症细胞在ICT难治性肿瘤中诱导T细胞“荒漠化”和“排斥”的关键机制,将填补对这些促肿瘤机制的认识,有助于研究人员开发新的免疫疗法,有望释放ICT在难治性患者中的临床益处。
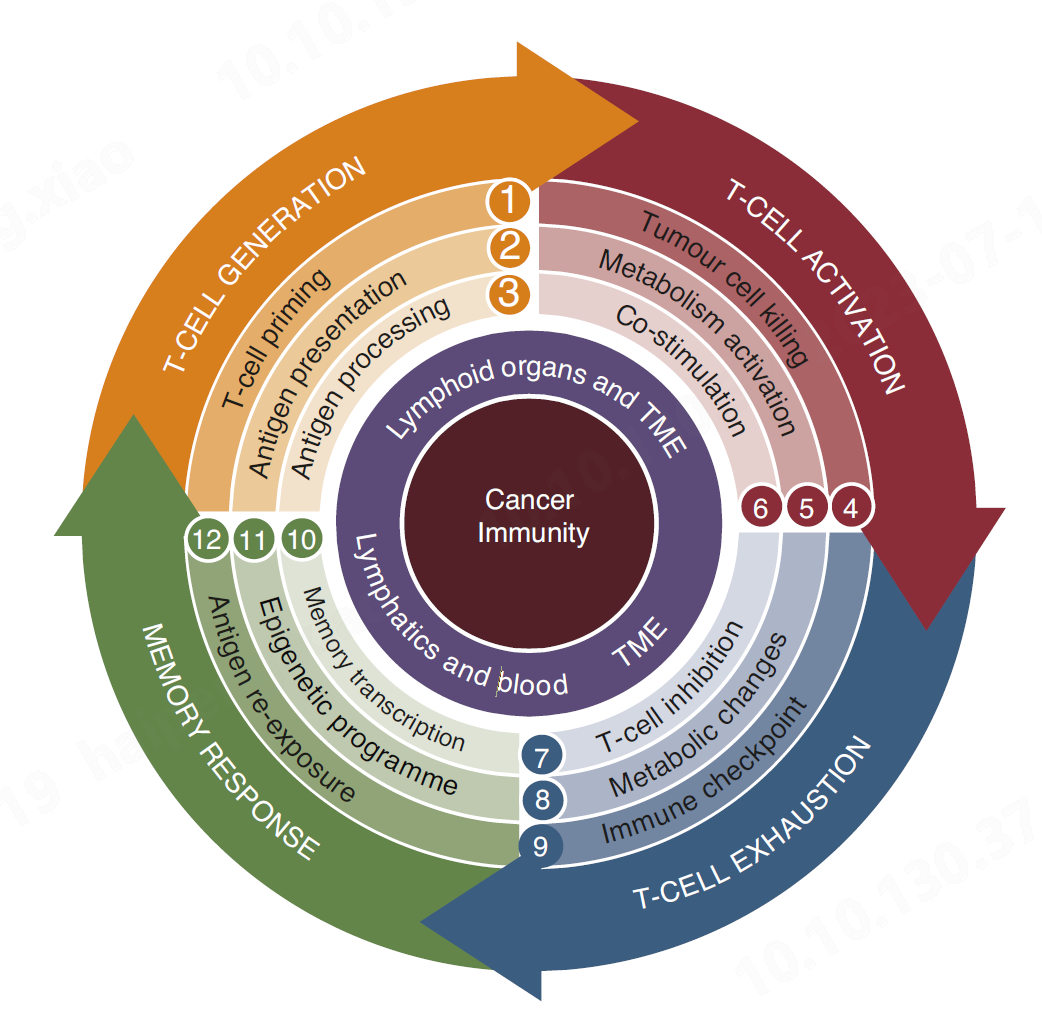
癌症免疫循坏
ICT 反应的第一个条件规则是肿瘤抗原以肽的形式成功地以 MHC 依赖性呈递给 T 细胞受体( TCR ),这导致抗肿瘤效应淋巴细胞克隆扩增群体的产生(橙色, 1-3 期)。从 T 细胞生成阶段开始,它强调对实现 ICT 临床益处至关重要的关键事件,如 T 细胞的激活(红色, 4-6 期)、 T 细胞耗竭(蓝色, 7-9 期)和记忆反应(绿色, 10-12 期)。简言之,在临床试验中,试图改善复发患者 ICT 反应的努力目前集中在改善 T 细胞效应功能,靶向新的免疫检查点调节因子(如淋巴细胞活化基因 3 ( LAG-3 ))和共刺激激动剂(如诱导型 T 细胞共刺激剂( ICOS )激动剂),以及使用表观遗传学调节剂增强记忆表型。
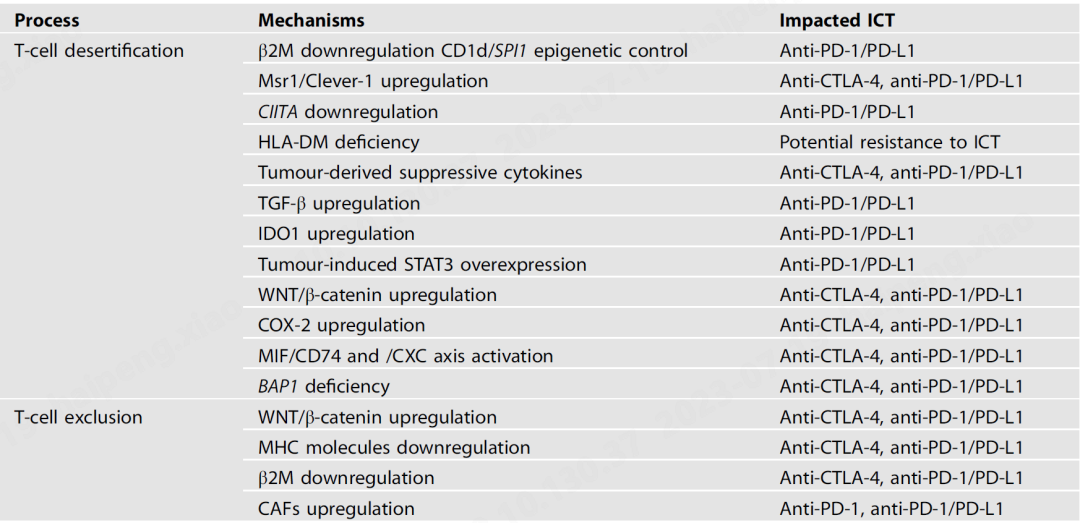
T细胞沙漠和排斥驱动ICT抗性的关键机制
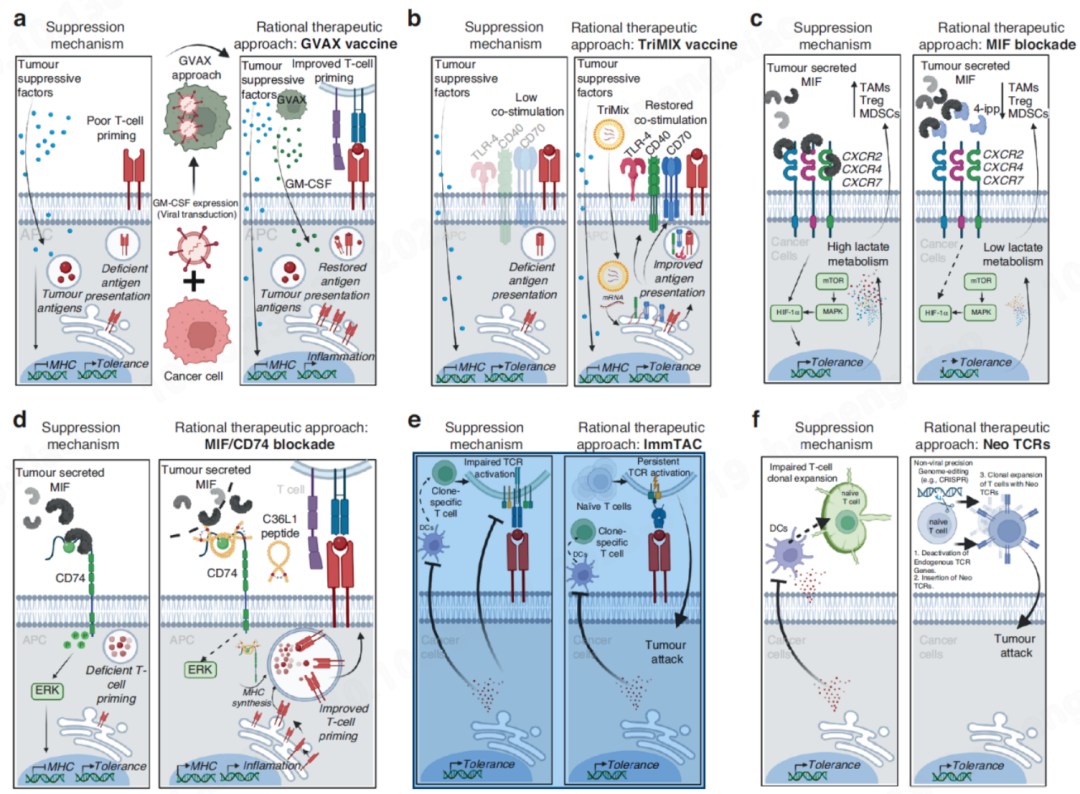
克服癌症患者T细胞沙漠和排斥化的理性设计
对于恢复 “ 沙漠 型 ” 肿瘤中 DC 免疫原性来恢复 T 细胞生成,结合上述阐述的关键机制,可以 采用的组合治疗策略有:
A: GVAX疫苗增强全身和局部GM-CSF水平,以重新建立单核细胞衍生的DC的免疫原性功能,从而产生抗肿瘤T细胞。
总结
Reference:Wang, M.M., Coupland, S.E., Aittokallio, T.et al. Resistance to immune checkpoint therapies by tumour-induced T-cell desertification and exclusion: key mechanisms, prognostication and new therapeutic opportunities. Br J Cancer (2023). https://doi.org/10.1038/s41416-023-02361-4
链接:http://www.lewenyixue.com/2025/01/02/Br%20J%20Cancer%7C%20%E5%85%8D%E7%96%AB%E6%B2%99%E6%BC%A0%E5%92%8C%E5%85%8D%E7%96%AB/






赶快来坐沙发