Dev Cell | 杜文静/贺晓静/赵海涛合作揭示肝癌中GABA从头合成的机制及其促进肝癌转移的功能
GABA 是哺乳动物中枢神经系统 (CNS) 中的主要抑制性神经递质,但也存在于多种非神经组织中,包括周围神经和内分泌系统。近年来有研究发现GABA也存在于某些肿瘤包括肿瘤微环境 (TME) 中,通过作用于肿瘤细胞或免疫细胞表面的受体,激活下游信号通路,调控肿瘤生长。在神经系统中,环境中的GABA 水平受到高亲和力钠依赖性 GABA 转运体的严格控制,但GABA 转运体是否在肿瘤中发挥作用仍不清楚。此外,有些肿瘤细胞能够合成GABA,然而肿瘤细胞内能否以及如何感知GABA尚未可知。因此,确定GABA转运体对TME中GABA调控肿瘤的作用,肿瘤细胞从头合成GABA的代谢途径,以及肿瘤细胞如何感知GABA的机制,将为开发肿瘤治疗的新靶点提供思路。
2024年12月30日,中国医学科学院基础医学研究所 杜文静 教授课题组、华中科技大学生命科学与技术学院 贺晓静 教授、与北京协和医院肝外科 赵海涛 教授合作,在 Developmental cell 杂志在线发表了题为 The de novo synthesis of GABA and its gene regulatory function control hepatocellular carcinoma metastasis ( GABA 的从头合成及其基因调控功能控制肝癌转移) 的研究长文, 解析了肝癌(HCC)中γ-氨基丁酸(GABA)的从头合成途径,揭示了神经递质GABA作为一种oncometabolite促进HCC转移的功能及机制,发现了GABA调控肿瘤的新行为方式。

在该研究工作中,研究人员首先在不同疾病阶段的 HCC 患者样本队列中明确了 GABA的积累与 HCC 进展和转移呈正相关。通过构建尾静脉注射肺转移、肝原位注射转移等多种小鼠肿瘤转移模型,发现GABA可以促进HCC的转移。敲降GABA转运体SLC6A12后补充GABA,并不能挽救HCC的转移,然而抑制或敲降GABA受体并不会影响GABA促进HCC转移的功能,说明GABA通过其转运体SLC6A12进入肝癌细胞内促进HCC转移,而不是通过传统意义上的细胞表面受体发挥作用。
GABA 可以从谷氨酰胺 (glutamine) 由谷氨酸脱羧酶 (GAD1、GAD2) 代谢产生,或者从腐胺 (putrescine) 通过二胺氧化酶 (DAO) 和醛脱氢酶 (其中ALDH9A1是主要形式) 合成。研究人员通过基因表达检测发现,在包括HCC在内的23种癌细胞系中,ALDH9A1的表达远远高于GAD1。分别用[U5- 13 C]-glutamine或[U4- 13 C]-putrescine培养细胞通过代谢流检测发现,ALDH9A1 的耗竭降低了来自putrescine的 m+4 13 C 标记 GABA 的比例,表明ALDH9A1 是 HCC中负责从putrescine合成 GABA 的主要代谢酶。敲低ALDH9A1显著抑制HCC的转移,而外源添加 GABA 能挽救HCC的转移能力,表明 ALDH9A1通过其产生GABA促进了HCC转移。详细的分子机制研究发现,GABA能够直接结合β-catenin,并且更倾向于与未磷酸化的β-catenin相互作用,阻断其S33位的磷酸化,抑制泛素化降解,从而加强β-catenin蛋白稳定性与入核,最终通过Wnt/β-catenin信号通路的激活促进HCC的转移。当β-catenin被抑制时,GABA失去了促进HCC转移的能力。更为有趣的是,研究人员发现β-catenin转录上调SLC6A12,GABA -β-catenin-SLC6A12通路存在正反馈回路,即:外源添加GABA导致 β-catenin稳定,进而上调 SLC6A12 的表达,导致更多的 GABA 被转运到细胞中以稳定β-catenin。
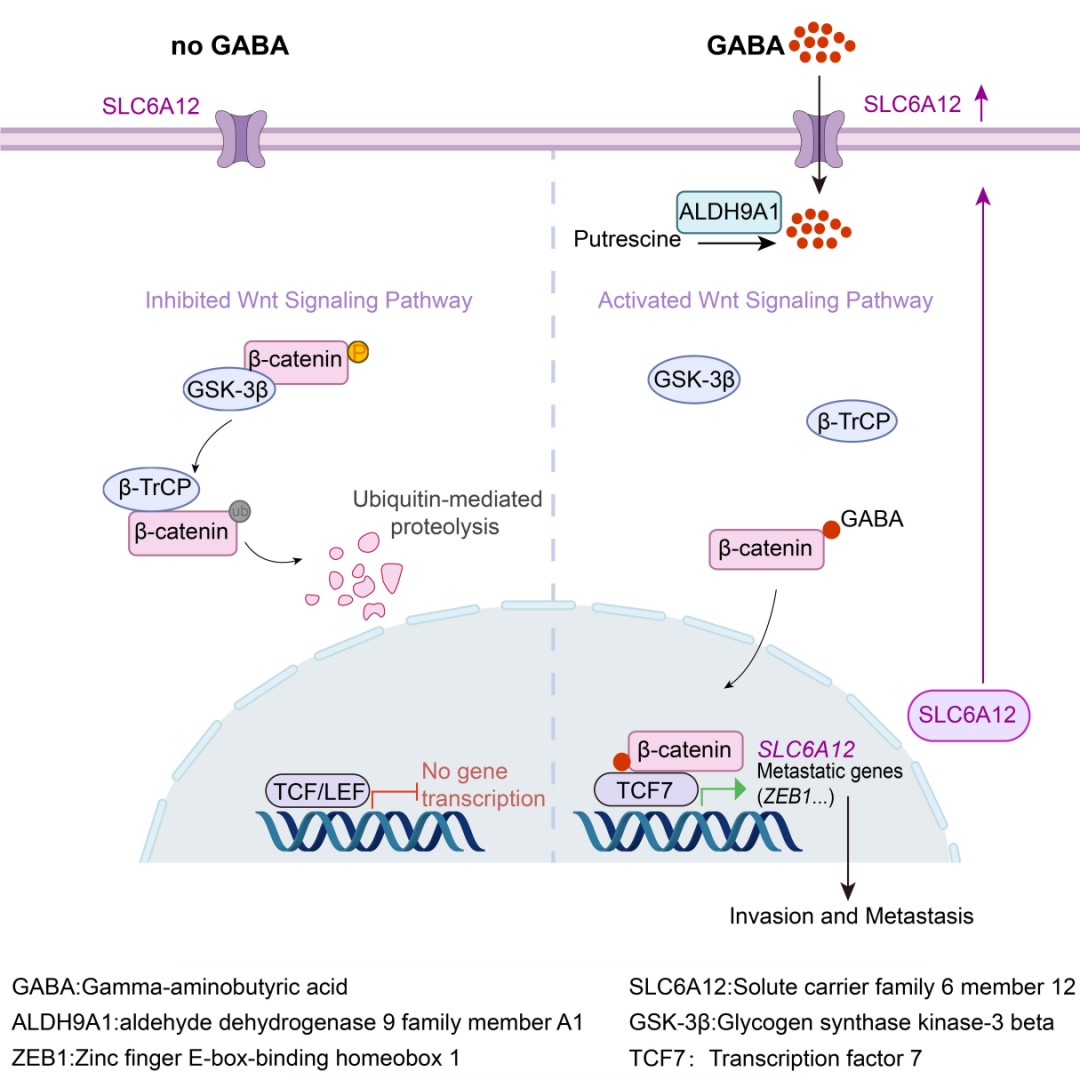
综上所述, 本研究解析了HCC中 ALDH9A1 介导从腐胺从头合成 GABA 的代谢通路,阐明GABA 是一种促进肝癌转移的oncometabolite,发现GABA-β-catenin-SLC6A12正反馈回路在HCC转移中的重要作用,揭示β-catenin可能是HCC内GABA的天然感受器,通过感知GABA的水平来调节肿瘤细胞的命运决定。总之,这些发现提供了一种通过阻断 GABA 合成或阻止其转运来抑制HCC 转移的潜在治疗方法。
值得注意的是,GABA目前被广泛用作各种市场上的功能性食品配料,由于其具有改善情绪、睡眠或缓解焦虑等的作用,许多人将 GABA 作为保健品服用。本研究结果 提醒人们在考虑服用GABA时需要谨慎,特别是癌症患者。
中国医学科学院基础医学研究所杜文静教授,华中科技大学生命科学与技术学院贺晓静教授,北京协和医院肝外科赵海涛教授,为论文共同通讯作者。助理研究员李莉博士,康有力硕士 (已毕业) ,程润宁硕士 (在读) 为共同第一作者。
https://doi.org/10.1016/j.devcel.2024.12.007
制版人:十一
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/12/31/Dev%20Cell%20%7C%20%E6%9D%9C%E6%96%87%E9%9D%99-%E8%B4%BA%E6%99%93%E9%9D%99-%E8%B5%B5/
THE END







赶快来坐沙发