【Leukemia】髓系肿瘤伴der(1;7)(q10;p10)具有独特的临床和突变特征
Der (1;7)(q10;p10)是一种不平衡易位,在多种髓系肿瘤中经常存在,其中+1q和-7q是常见的结果。尽管是亚洲髓系肿瘤患者中最常见的染色体异常之一,但der(1;7) (q10;p10)(+)髓系肿瘤的分子学特征尚未完全阐明。因此日本学者开展纳入3385例髓系肿瘤的多中心回顾性研究,研究了der(1;7) (q10;p10)的临床特征和突变谱,证明der(1;7) (q10;p10)(+)髓系肿瘤具有独特的临床和突变特征,是髓系肿瘤的一个独特亚群,近日发表于《Leukemia》。

3385例髓系肿瘤中,在常规细胞遗传学和/或基于测序的拷贝数分析的基础上,共鉴定出148例der(1;7)(q10;p10),并利用全外显子组测序(WES)和/或靶向捕获测序研究临床特征和突变谱,并与单独具有-7/del(7q)(n=376)和1q三体(+1q)(n=54)的病例进行比较。剩余的2808例定义为为“OTHER”。
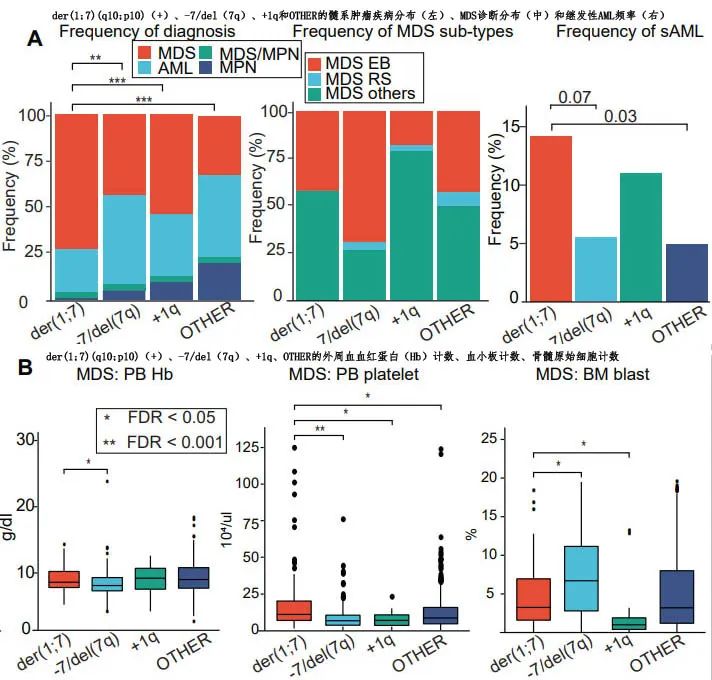
以944例德国MDS患者作为种族间对照。der(1;7)(q10;p10)在亚洲(54/936)比德国(4/944)骨髓增生异常综合征(MDS)病例中更为普遍(5.8% vs. 0.4%)。与 −7/del(7q)和+1q相比, der(1;7)(q10;p10)中更富集MDS(72.3%)而非急性髓系白血病(AML)(23.6%)和MDS/骨髓增生性肿瘤(MPN)(3.4%)。MDS伴原细胞增多(MDS-EB)在der(1;7)(q10;p10)(+) MDS患者中的比例少于 −7/del(7q)(+) MDS患者中,但多于+1q患者中。继发性AML在der(1;7)(q10;p10)(+) AML中比在非der(1;7)(q10;p10)病例中更富集。与 −7/ del(7q) MDS患者相比,der(1;7)(q10;p10)(+) MDS患者的血红蛋白水平明显更高、血小板计数更高、原始细胞计数更低。
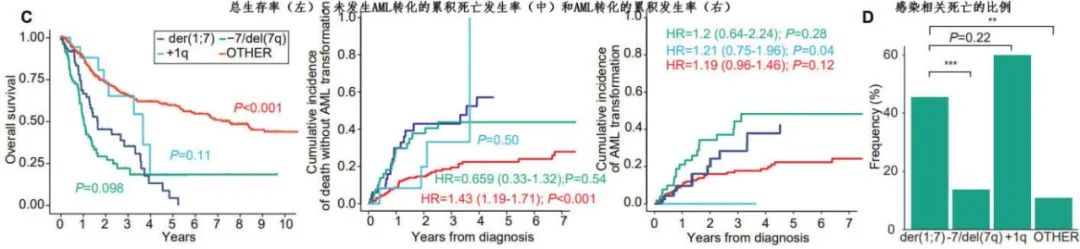
相对于OTHER MDS,der(1;7)(q10;p10)(+) MDS和 −7/del(7q)(+) MDS的总生存期明显更短,白血病转化速度更快,并且der(1;7)(q10;p10)(+) MDS患者比 −7/del(7q) MDS患者有稍好的OS和较慢的白血病进展;而+1q MDS患者显示出更好OS的趋势。与OTHER MDS患者相比,der(1;7)(q10;p10)(+) MDS患者倾向于发生无AML进展死亡;值得注意的是,在der(1;7)(q10;p10)(+) MDS患者中感染相关死亡占非白血病死亡的比例高达45%,而在 −7/del(7q)和OTHER MDS中分别为13.9%和10.8%;+1q MDS患者也表现出类似的趋势,感染相关原因占60%。
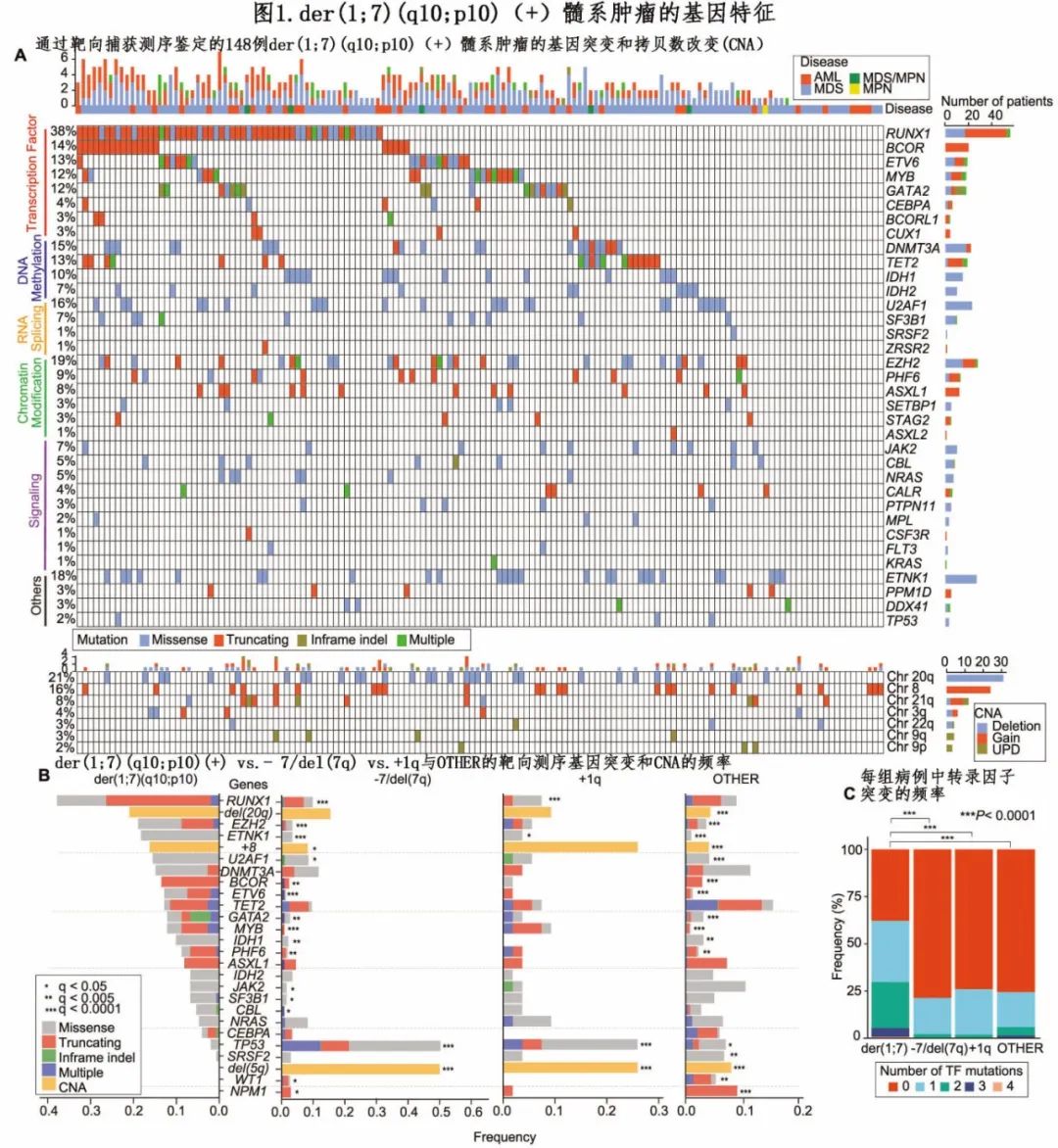
对26例der(1;7)(q10;p10)(+)病例的已知驱动基因和基因突变进行靶向捕获测序,发现148例der(1;7)(q10;p10)(+)病例中有132例(89.2%)具有一个或多个基因突变(图1A)。与其他亚组(范围1.7-1.9)相比,der(1;7)(q10;p10)(+)病例的平均突变数(2.8/样本)显著更高(P<0.001)。der(1;7)(q10;p10)(+)病例中最常发生突变的基因包括RUNX1、EZH2、ETNK1、U2AF1、DNMT3A、BCOR、ETV6、TET2、GATA2、MYB、IDH1、PHF6和ASXL1,其中大部分基因在der(1;7)(q10;p10)(+)中的突变频率高于其他亚组(图1B)。转录因子基因(包括RUNX1、BCOR、ETV6、GATA2、MYB和CEBPA)占这些基因的一半,是der(1;7)(q10;p10)(+)病例的主要突变靶点(图1C)。还观察到影响其中部分转录因子基因的多个突变,包括RUNX1、ETV6、MYB和GATA2,表明在der(1;7) (q10;p10)(+)群体中存在强大的选择压力,有利于这些突变(图1A)。总体而言,62.2%的der(1;7)(q10;p10)(+)病例至少携带一个转录因子突变,比der(1;7)(q10;p10)( −)病例的频率高得多(图1C)。此外+8和del(20q)在der(1;7)(q10;p10)(+)病例中很常见;而TP53突变和del(5q)很少出现,与 −7/del(7q)、+1q和OTHER病例中这些突变的高频率形成鲜明对比。
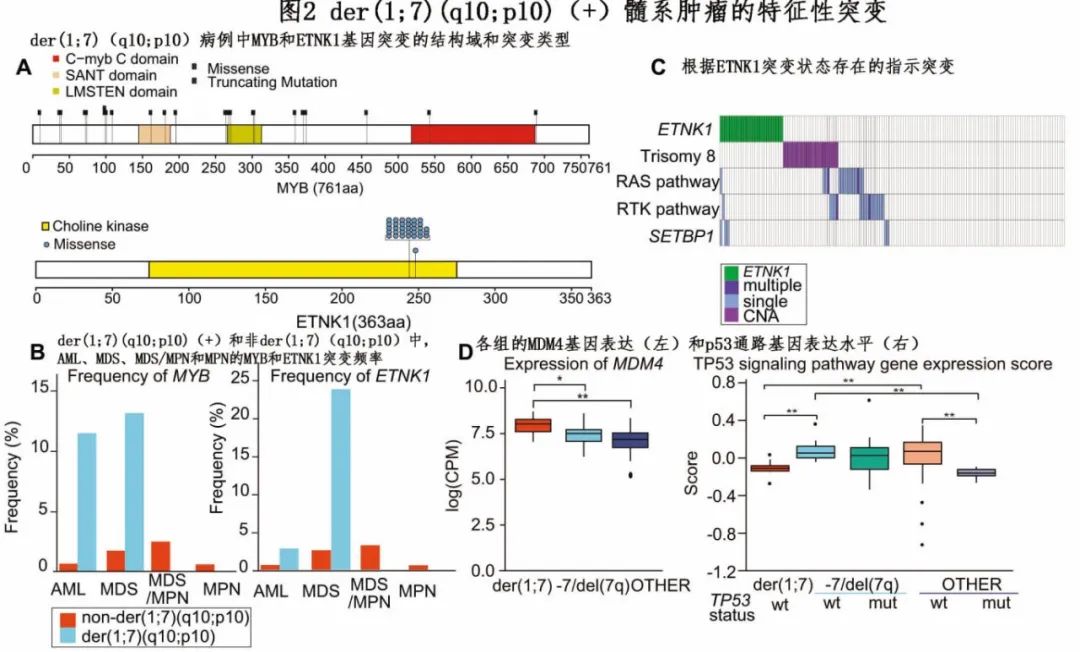
在der(1;7)(q10;p10)的常见突变靶点中,MYB和ETNK1两个基因在OTHER和- 7/ del(7q)亚群中很少发生突变,因此是der(1;7)(q10;p10)(+)的高度特征。MYB突变在+1q病例中也很常见(图1B)。大多数变异为蛋白质截断,并广泛分布在整个编码序列中,因此导致功能丧失(图2A)。MYB突变存在于13.1%的MDS和11.4%的der(1;7)(q10;p10)(+) AML中,但在der(1;7)(q10;p10)( −)病例中很少检测到(图2B)。有和没有MYB突变的患者的全血细胞计数没有显著差异。突变谱在MYB突变型(mut)和野生型(wt)病例之间没有实质性差异;MYB-mut病例的OS比MYB-wt病例短但无统计学意义。ETNK1是另一个在der(1;7)(q10;p10)(+)病例中唯一突变的基因,18%的der(1;7)(q10;p10)(+)病例携带频繁的ETNK1突变,显示出影响N244的突出突变热点。突变在MDS病例中具有高度特异性(24.3%),在AML病例中仅为2.9%,与der(1;7)(q10;p10)( −)MDS(2.6%)和MDS/MPN(3.3%)病例相当(图2A, B)。与不典型慢性髓系白血病一样,在der(1;7)(q10;p10)(+)髓系肿瘤中ETNK1突变与SETBP1突变显著共同发生(P=0.042),而+8倾向于与ETNK1突变互斥(P=0.0078)(图2C)。值得注意的是,ETNK1-mut (1;7)(q10;p10)(+)病例表现为嗜酸性粒细胞增多(平均:6.2% vs. 14.8%)(P=0.025)。ETNK1突变MDS患者预后较ETNK1-wt差。
接下来使用RNA测序检测了10例der(1;7)(q10;p10)(+)、20 - 7/del(7q)和62例OTHER MDS患者的基因表达谱。正如预期,作者证实了等位基因剂量的影响:在1q和7q上,基因的表达分别升高和降低,而个体基因的影响高度可变。例如,EZH2和CUX1的基因表达一致降低,它们是两种主要的抑癌因子,也是各种髓系肿瘤中7q突变和局灶性缺失的常见靶点,而1q上的几个癌基因,如AKT3、BCL9、NCSTN、LAMC1、MDM4和RIT1的表达升高。这些抑癌因子和癌基因的失调可以解释der(1;7)(q10;p10)(+) MDS的发病机制。其中特别令人感兴趣的是MDM4,因为MDM4是p53功能的负调节因子,而缺乏TP53突变是der(1;7)(q10;p10)(+)病例的另一个独特特征。1q gain引起的MDM4表达升高与其他肿瘤+1q中TP53突变的缺乏有关。与这些报道一致,在TP53突变MDS中也观察到p53信号通路基因的表达下调,无论是否伴有- 7/del(7q),在der(1;7)(q10;p10)(+)病例中也被证实(图2D)。TP53突变在单独+1q的病例中也很常见,然而TP53突变往往比+1q突变的细胞比例更大,表明+1q克隆是从先前存在的TP53突变克隆中进化而来的,这意味着der(1;7)(q10;p10)和+1q单独突变之间存在不同的发病机制。
最后,为了研究der(1;7)(q10;p10)(+)克隆演变,作者通过评估变异等位基因频率来推断遗传改变的获得顺序。在大多数情况下,der(1;7)(q10;p10)、del(20q)以及DNMT3A和ETNK1突变代表主要克隆,表明它们在克隆进化过程中起源较早;而der(1;7)(q10;p10)中的特征性转录因子基因突变,如ETV6、GATA2和MYB,是相对较晚发生的事件。此外,在健康个体发生AML/ MDS之前,der(1;7)(q10;p10)鉴定为克隆嵌合体。根据SNP阵列数据对来自日本BioBank的179417名健康个体的CNAs进行调查,发现29人同时存在1q gain和7q确实,从而提示der(1;7)(q10;p10),其中4人后来死于AML或MDS。另一个有趣的发现在于,通过双测序分析64人(包括6个der(1;7)(q10;p10))的突变时,仅在der(1;7)(q10;p10)个体中发现了ETNK1热点突变。146份BBJ样本的数字PCR (ddPCR)也仅在der(1;7)(q10;p10)患者中发现这些热点突变。鉴于ETNK1突变与der(1;7)(q10;p10)之间强烈而独特的关联,ETNK1突变可能在der(1;7)(q10;p10)(+)髓系肿瘤作为克隆性造血的早期演变过程中获得

der(1;7)(q10;p10)(+)髓系肿瘤具有许多独特的遗传特征和独特的血液学特征,因此可代表髓系肿瘤的一个独特亚型,最近来自IWG队列的研究结果也支持了这一点。鉴别髓系肿瘤的这一亚群可以为这些患者提供更好的预后和治疗。与1q gain相关的MDM4表达升高表明MDM4抑制剂可能在这些肿瘤中发挥作用,需要在未来的临床环境中进行评估。
参考文献
Okuda, R., Ochi, Y., Saiki, R. et al. Genetic analysis of myeloid neoplasms with der(1;7)(q10;p10). Leukemia (2024). https://doi.org/10.1038/s41375-024-02494-2
链接:http://www.lewenyixue.com/2024/12/31/%E3%80%90Leukemia%E3%80%91%E9%AB%93%E7%B3%BB%E8%82%BF%E7%98%A4%E4%BC%B4der%281/






赶快来坐沙发