放射免疫疗法( RIT )是一种将单克隆抗体(M ab )与放射性核素结合的靶向治疗方法。它利用单克隆抗体的高特异性靶向作用,将放射性核素精确递送至肿瘤细胞,实现对肿瘤的精准杀伤,同时最大程度降低对正常组织的损伤。与此同时, ImmunoPET 是一种将单克隆抗体(或抗体片段)与正电子发射断层扫描( PET )技术结合的成像方法,它利用抗体的高靶向性,将放射性同位素标记的抗体递送到肿瘤或其他疾病相关部位,通过 PET 扫描对病灶进行高灵敏度和高分辨率成像。
二唾液酸神经节苷脂2(Disialoganglioside,GD2)几乎在所有神经母细胞瘤细胞表面均有丰富表达,是靶向免疫治疗的一种有前途的生物标志物。多种抗GD2单克隆抗体已被评估并用于高危疾病患者的维持治疗。目前,chimeric14.18和3F8是美国食品药品监督管理局(FDA)批准的两个被广泛研究的抗GD2抗体家族。作为一种普遍的抗GD2抗体,hu3F8对GD2的结合亲和力高出10倍,并且避免了鼠源抗体的免疫原性。
近日,首都医科大学附属北京友谊医院 的 杨吉刚/朱先玉 和北京协和医学院的 弓建华 等 在 European Journal of Nuclear Medicine and Molecular Imaging 上发表题为 GD2-targeted theranostics of neuroblastoma with [64Cu]Cu/[177Lu]Lu-hu3F8 的研究, 利用人源化抗GD2单克隆抗体hu3F8与GD2的强亲和力,将hu3F8与NOTA/DOTA结合,并与 64 Cu或 177 Lu络合,发展了一类新型靶向神经母细胞瘤的抗体-放射性核素偶联药物(RAC,Radionuclide Antibody-Conjugates),并对其PET成像和放射免疫治疗进行了初步研究。

[ 64 Cu]Cu/[ 177 Lu]Lu-hu3F8的标记和验证
为了开发用于免疫PET成像和RIT实验的探针,首先将hu3F8与金属螯合剂NOTA和DOTA结合,然后分别用 64 Cu和 177 Lu标记(图1)。经过多次标记实验,[ 64 Cu]Cu-NOTA-hu3F8和[ 177 Lu]Lu-DOTA-hu3F8的标记率分别为87.38% ± 5.01和87.39% ± 4.40(n = 3),放化纯度分别为96.7% ± 0.44和97.8% ± 0.62(n = 3),标记剂的比活度分别达到约209.11 ± 20.91 MBq/mg和271.19 ± 29.55 MBq/mg(n = 3),表明两种标记产品的比活度、标记率和放化纯度都很高。HPLC测定[ 177 Lu]Lu-DOTA-hu3F8 放射性标记后抗体完整性超过95%。在10% FBS(Fetal Bovine Serum,胎牛血清)/PBS(Phosphate Buffered Saline,磷酸缓冲盐溶液)孵育7天后,放射薄层色谱和SDS-PAGE结果显示[ 177 Lu]Lu-DOTA-hu3F8的放射化学纯度仍然高于85%,说明该探针具有良好的体外稳定性。
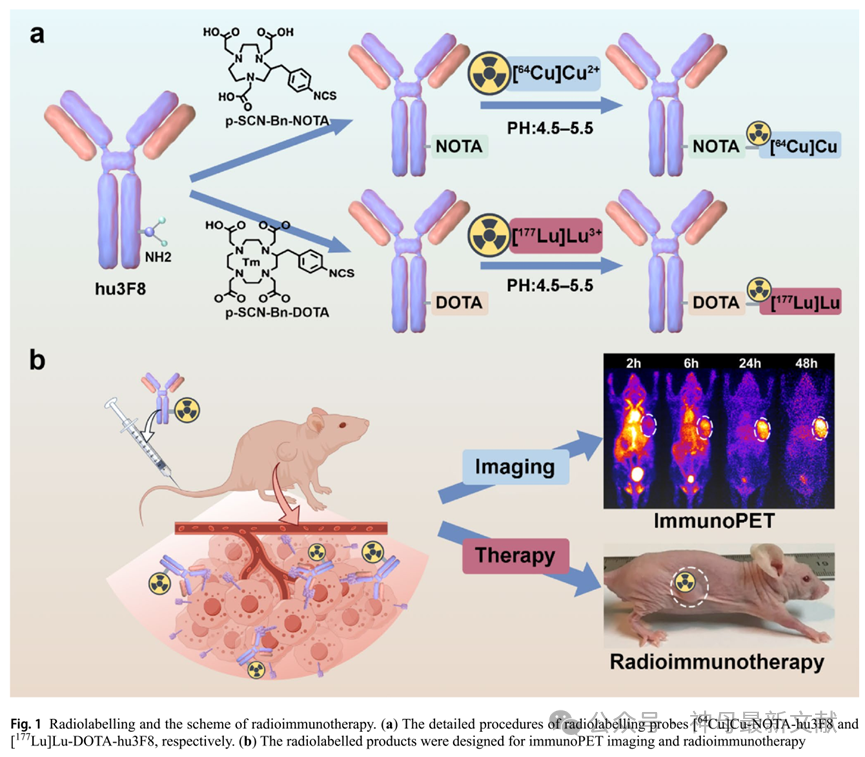
图1. 放射性标记和放射免疫治疗方案。(a)放射性标记探针[ 64 Cu]Cu-NOTA-hu3F8和[ 177 Lu]Lu-DOTA-hu3F8的详细步骤。(b)放射性标记产品设计用于免疫PET成像和放射免疫治疗。
[ 64 Cu]Cu-NOTA-hu3F8的免疫PET成像和生物分布
小动物PET图像显示[ 64 Cu]Cu-NOTA-hu3F8随时间在IMR32肿瘤中高度积累。6小时后肿瘤即可被勾勒出来,并一直保留到72小时后(图3a)。相反,阻断组的摄取显著下降(图3b),而在GD2阴性HO8910组中几乎未观察到[ 64 Cu]Cu-NOTA-hu3F8的停留或摄取(图3c)。肿瘤的GD2 IHC结果支持IMR32和HO8910肿瘤模型之间的不同GD2表达水平。
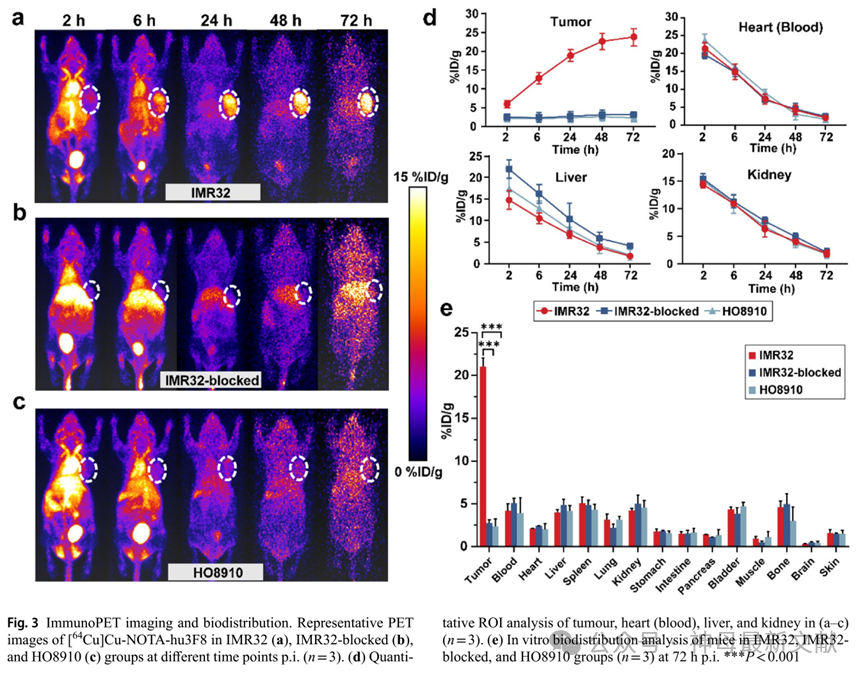
图3 . 免疫PET成像和生物分布。在注射后不同时间点(n=3),IMR32组(a)、IMR32阻断组(b)和HO8910组(c)中[ 64 Cu ]Cu-NOTA-hu3F8的代表性PET图像。(d)对(a–c)中肿瘤、心脏(血液)、肝脏和肾脏的定量ROI分析(n=3)。(e)注射后72小时,IMR32组、IMR32阻断组和HO8910组(n =3)小鼠的体外生物分布分析*** P < 0.001
此外,通过对注射后72 h从安乐死的小鼠中获取的器官组织进行体外γ计数,获得了三组的生物分布概况(n=3,图3e)。除了在血液(4.20±0.82%ID/g)和富含血液的器官如肝脏和脾脏(4.03±0.31%ID/g和5.07±0.73%ID/g)中少量滞留外,大部分注射的探针积聚并残留在IMR32肿瘤中(21.04±0.99%ID/g)。此外,IMR32组的肿瘤放射性摄取量明显高于其他两组( 分别为2.79 ± 0.38%ID/g和2.37 ± 0.89%ID/g,P < 0.001),这与PET成像结果一致。显著的肿瘤摄取和良好的药代动力学使得基于[ 177 Lu]Lu标记的hu3F8的进一步RIT成为可能。
[ 177 Lu]Lu-DOTA-hu3F8的SPECT成像和分布
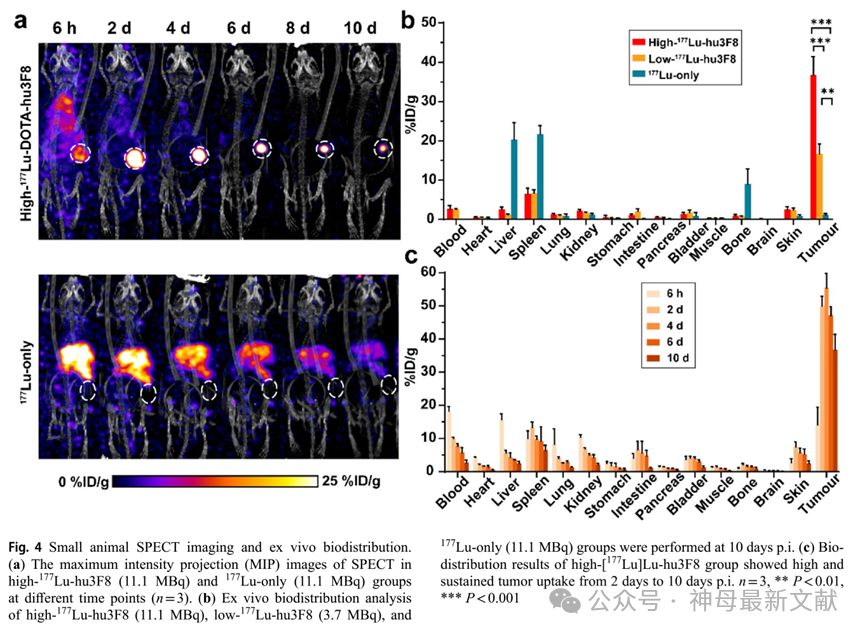
在高剂量 177 Lu-hu3F8组和 177 Lu单独注射组中,于不同时间点进行了系统性SPECT成像(图4a)。在高剂量 177 Lu-hu3F8组中,从注射后第2天到第10天可以清晰显示肿瘤形态,而 177 Lu单独注射组则未能显示肿瘤,并且表现出高水平但逐渐降低的肝脏摄取。高剂量 177 Lu-hu3F8组的肝脏摄取较低,并在2天内迅速下降。这些结果与PET成像结果一致。
接下来,在最后一次成像时间点后对高剂量 177 Lu-hu3F8、低剂量 177 Lu-hu3F8和 177 Lu单独注射组进行了生物分布分析(图4b)。高剂量 177 Lu-hu3F8组的肿瘤摄取量(36.81 ± 4.62%ID/g)显著高于低剂量 177 Lu-hu3F8(16.64 ± 2.58%ID/g)和 177 Lu单独注射(1.13 ± 0.33%ID/g)组(n = 3,P < 0.001),这一结果与放射免疫治疗(RIT)结果一致。同时,低剂量 177 Lu-hu3F8组与 177 Lu单独注射组之间的肿瘤摄取量差异具有统计学意义(P = 0.001)。在 177 Lu单独注射组中,观察到肝脏和脾脏的中央高摄取(20.33 ± 4.24%ID/g和21.71 ± 2.17%ID/g),可能是由于 177 Lu的非特异性亲和性造成的。此外,高剂量 177 Lu-hu3F8在多个时间点的生物分布显示,从注射后第2天至第10天,肿瘤摄取量持续保持高水平,并在第4天达到峰值(55.34 ± 4.38%ID/g)(图4c)。SPECT成像能够可视化肿瘤治疗过程并监测治疗效果,且离体生物分布结果与SPECT成像结果一致。
图4. 小动物SPECT成像和离体生物分布分析
(a) 在不同时间点,高剂量 177 Lu-hu3F8(11.1 MBq)组与 177 Lu单独注射(11.1 MBq)组的SPECT最大强度投影(MIP)图像(n = 3)。
(b) 对高剂量 177 Lu-hu3F8(11.1 MBq)、低剂量 177 Lu-hu3F8(3.7 MBq)和 177 Lu单独注射(11.1 MBq)组在注射后10天的离体生物分布进行了分析。
(c) 高剂量[ 177 Lu]Lu-hu3F8组的生物分布结果显示,从注射后第2天至第10天,肿瘤摄取量始终保持在高水平且持续稳定。n = 3,**P < 0.01,***P < 0.001。
[ 177 Lu]Lu-hu3F8对神经母细胞瘤肿瘤模型的放射免疫治疗(RIT)
在注射后第0天、第5天、第15天和第30天,小鼠的代表性图像展示了5个治疗组中肿瘤大小的变化(图5a)。根据绘制的肿瘤体积曲线,在高剂量 177 Lu-hu3F8组中观察到最显著的肿瘤抑制效果,其标准化肿瘤体积在30天时约为20.47 ± 6.32%,显著低于其他治疗组(PBS组 = 433.88 ± 65.58%,hu3F8组 = 272.70 ± 57.20%, 177 Lu单独注射组 = 418.83 ± 73.17%,低剂量 177 Lu-hu3F8组 = 107.5 ± 21.45%,n = 5,P = 0.000–0.02,见图5b和补充表S4)。
从注射后第5天开始,高剂量 177 Lu-hu3F8组的标准化肿瘤体积(82.98 ± 6.33%,n = 5)显著小于PBS组(157.49 ± 18.1%,n = 5,P < 0.001)、 177 Lu单独注射组(150.90 ± 5.08%,n = 5,P < 0.001)和hu3F8组(123.43 ± 22.15%,n = 5,P = 0.003),这表明其短期内具有高度有效的治疗效果。同时,低剂量 177 Lu-hu3F8组的肿瘤体积也显著小于PBS、 177 Lu单独注射和hu3F8组(P < 0.001)。此外,与PBS组(P < 0.001)和 177 Lu单独注射组(P = 0.001)相比,hu3F8组的肿瘤体积略有减少。然而,在PBS组和 177 Lu单独注射组之间的标准化肿瘤体积无显著差异(P = 0.677)。
总之,接受[ 177 Lu]Lu-hu3F8治疗的小鼠表现出显著的剂量依赖性和持久的抗肿瘤效果,且较高剂量的治疗效果更好。单独使用hu3F8并不足以抑制肿瘤生长,而[ 177 Lu]Lu-hu3F8放射免疫治疗在GD2阳性肿瘤模型的治疗中发挥了重要作用。
对于体重而言,尽管高剂量 177 Lu -hu3F8、低剂量 177 Lu -hu3F8和 177 Lu 单独注射治疗组呈现出轻微的下降趋势,但在治疗结束的最后时间点,这些组之间未观察到显著差异(n = 5,P = 0.309),这表明可能存在可耐受的短期毒性。
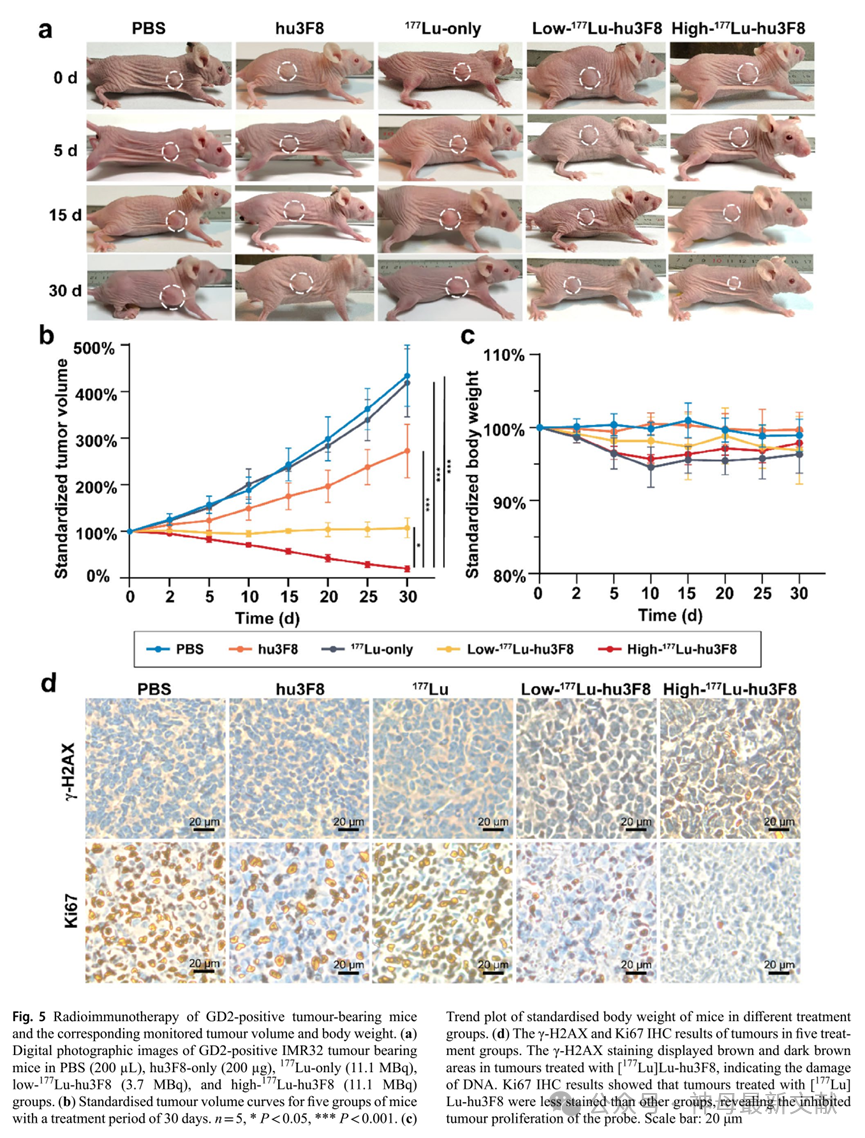
图5. GD2阳性肿瘤荷瘤小鼠的放射免疫治疗及相应的肿瘤体积和体重监测
(a) GD2阳性IMR32肿瘤荷瘤小鼠在PBS(200 µL)、仅注射hu3F8(200 µg)、仅注射 177 Lu(11.1 MBq)、低剂量 177 Lu-hu3F8(3.7 MBq)和高剂量 177 Lu-hu3F8(11.1 MBq)组中的数字照片图像。
(b) 5组小鼠在30天治疗期间标准化肿瘤体积曲线(n = 5,P < 0.05,P < 0.001)。
(c) 不同治疗组小鼠的标准化体重变化趋势图。
(d) 5个治疗组中肿瘤的 γ-H2AX和Ki67 IHC(免疫组化)结果。γ-H2AX染色显示[ 177 Lu]Lu-hu3F8处理的肿瘤中出现棕色和深棕色区域,表明DNA损伤。Ki67 IHC结果显示,[ 177 Lu]Lu-hu3F8处理的肿瘤染色较其他组明显减少,揭示探针抑制了肿瘤增殖。比例尺:20μm。
讨论节选
本研究发现 64 Cu标记的抗体hu3F8能够在体内特异性靶向GD2阳性神经母细胞瘤(NB)肿瘤,而不影响其亲和力和特异性,这有助于评估GD2靶向治疗前后的疗效。
新型示踪剂[ 177 Lu]Lu-DOTA-hu3F8的单次给药在NB肿瘤模型中表现出良好且持久的抗肿瘤反应,并且较高剂量与更好的治疗效果相关。
在该研究中,对于GD2阳性模型,[ 64 Cu]Cu-NOTA-hu3F8在肿瘤中表现出出色的GD2靶向能力和肿瘤对比度,主要在肿瘤中积聚,并可从非靶组织中迅速清除。
尽管抗GD2免疫疗法已展现出强大的治疗效果,但神经母细胞瘤的低免疫原性和剂量依赖性毒性限制了其广泛的临床应用。放射免疫治疗(RIT)的主要优势在于将特异性单克隆抗体与放射性核素治疗相结合。有研究报道RIT可调节肿瘤免疫反应,包括诱导免疫原性细胞死亡、增强肿瘤抗原免疫性以及促进免疫细胞浸润,从而增强对免疫“冷”肿瘤的靶向治疗效果。本研究证明了 177 Lu放射治疗发挥了重要作用,而[ 177 Lu]Lu-hu3F8治疗可能优化抗体的应用剂量,从而减少抗体相关毒性。
在本研究中,新型示踪剂[ 177 Lu]Lu-DOTA-hu3F8在神经母细胞瘤(NB)肿瘤模型中展现了良好的治疗效果,通过诱导凋亡和坏死以及抑制肿瘤细胞增殖,发挥了高效的抗肿瘤作用。
作为一种释放高能量 β 粒子的治疗性放射性核素, 177 Lu不仅通过直接靶向肿瘤细胞来杀灭肿瘤,还可通过对周围未靶向肿瘤组织的交叉火力效应(cross-fire effect)起作用,这可能弥补非放射性免疫治疗因肿瘤抗原表达异质性导致的疗效有限。
该研究证明,使用[ 64 Cu]Cu-NOTA-hu3F8的ImmunoPET成像能够评估神经母细胞瘤肿瘤模型中GD2的表达水平。此外,[ 177 Lu]Lu-DOTA-hu3F8展现出显著的肿瘤抑制效果,具有高且持久的肿瘤摄取,且副作用几乎可以忽略不计。 科学家们相信[ 177 Lu]Lu-DOTA-hu3F8在GD2阳性肿瘤中将显示出卓越的治疗效果,并具有潜在的临床转化前景。
责编

制作
排版 | Sheila 校对 | uu
▼滑动查看更多▼
Purpose: Neuroblastoma (NB) is a malignant embryonic tumour with poor prognosis and high mortality rate. The antigen gisialoganglioside (GD2), which is highly expressed on the surface of NB cells, is an effective target for therapy. This study aims to evaluate the GD2 expression with [ 64 Cu]Cu-NOTA-hu3F8 positron emission tomography (PET) imaging and explore the radioimmunotherapy (RIT) effect of [ 177 Lu]Lu-DOTA-hu3F8 in NB tumour models.
Methods: The in vitro validation of the binding ability of anti-GD2 humanised monoclonal antibody (hu3F8) to GD2 was achieved via flow cytometry, cell immunofluorescence, and cell uptake test. Hu3F8 were conjugated with p-SCN-Bn-NOTA (NOTA) and p-SCN-Bn-DOTA (DOTA) for 64 Cu- and 177 Lu- radiolabelling. PET imaging and RIT studies were conducted using [ 64 Cu]Cu-NOTA-hu3F8 and [ 177 Lu]Lu-DOTA-hu3F8 in subcutaneous NB tumour models.
Results: The Institute for Medical Research-32 (IMR32) cell line exhibited a specific binding ability of hu3F8. PET imaging demonstrated a specific accumulation of [ 64 Cu]Cu-NOTA-hu3F8 in IMR32 tumour models, with a maximum tumour uptake of 23.73 ± 2.29%ID/g (n = 3) at 72 h post-injection (p.i.), outperforming other groups significantly (P < 0.001). The high dose [ 177 Lu]Lu-DOTA-hu3F8 group (11.1MBq) showed the most potent tumour suppression, with a standardised tumour volume of about 20.47 ± 6.32% at 30 days p.i., significantly smaller than other groups (n = 5, P < 0.05).
Conclusion: This study demonstrated that 64 Cu-/ 177 Lu- labelled hu3F8 could noninvasively evaluate the GD2 expression and effectively inhibit tumour growth in NB tumour models. The excellent therapeutic efficacy of [ 177 Lu]Lu-DOTA-hu3F8 may be helpful for the clinical translation of this GD2-targeted theranostics approach in GD2-positive tumours.
DOI: 1 0.1007/s00259-024-07033-w
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/12/30/EJNMMI%EF%BD%9C%E6%9D%A8%E5%90%89%E5%88%9A-%E6%9C%B1%E5%85%88%E7%8E%89-%E5%BC%93%E5%BB%BA%E5%8D%8E%E5%9B%A2%E9%98%9F/










赶快来坐沙发