Cancer Discov | 癌症免疫疗法可以通过抑制UBA1来提高对冷肿瘤的治疗效果
并不是所有的癌症对免疫疗法都有强烈的反应,或者根本没有反应。反应较强的癌症包括“热”肿瘤,其具有许多瘤内 T 细胞,而反应较弱的癌症,如前列腺癌,包括“冷”肿瘤,肿瘤内 T 细胞很少,因此免疫反应减弱。冷肿瘤之所以能保持“冷”,部分原因是它避开了免疫系统。
为了加大对冷肿瘤的治疗力度,密歇根大学健康罗格尔癌症中心的科学家们选择重新燃起对泛素样修饰物激活酶 1 ( UBA1 )的兴趣。之前已经确定它是癌细胞中必不可少的存在,可以直接靶向实现抗肿瘤作用。事实上, TAK-243 等抑制剂药物靶向 UBA1 取得了一些成功。然而,尚未进行任何测试来确定 UBA1 抑制对肿瘤微环境或整体免疫反应可能产生的影响。
在一项新的研究中,由 Arul M.Chinnaiyan 医学博士领导的密歇根大学团队已经确定 UBA1 酶是肿瘤免疫反应的关键介质。该团队证明,抑制 UBA1 可以增加 T 细胞募集,降低肿瘤对免疫疗法的耐药性。
详细的研究结果最近发表在《 CancerDiscovery 》杂志上的一篇题为“ TheUBA1-STUB1 axis mediates cancer immune escape and resistance to checkpointblockade ”的文章中。
“通过筛选癌症中经常获得的候选基因,我们发现泛素样 UBA1 的表达与效应 CD8+ T 细胞相关的特征最负相关。”该文章的作者写道,“在 ICB 队列中, UBA1 的高表达强烈预测了治疗耐药性和较差的生存率。”
UBA1 高表达与瘤内 CD8+ T 细胞水平低相关,预示着 ICB 队列中 ICB 耐药和低生存率
“功能研究表明, UBA1 介导免疫逃逸以促进肿瘤生长。免疫分析进一步表明, UBA1 过表达或缺失分别显著降低或增加了肿瘤内 CD8+T 细胞的功能。”
UBA1 通过介导免疫逃逸促进肿瘤生长
研究人员分析了来自 208 个转移性前列腺肿瘤样本的遗传数据,研究了 600 多个基因及其与干扰素 - γ( IFNG )的相关性。他们发现了 17 个与 IFNG 表达呈负相关的基因,表明对癌症存在的免疫反应减弱。
UBA1 减少肿瘤内功能性 T 细胞
其中, UBA1 与 IFNG 表达的负相关最强。 UBA1 高表达的肿瘤患者往往对免疫检查点阻断( ICB )治疗更具抵抗力,导致预后较差。
UBA1 抑制与抗 PD-1 治疗协同控制肿瘤生长
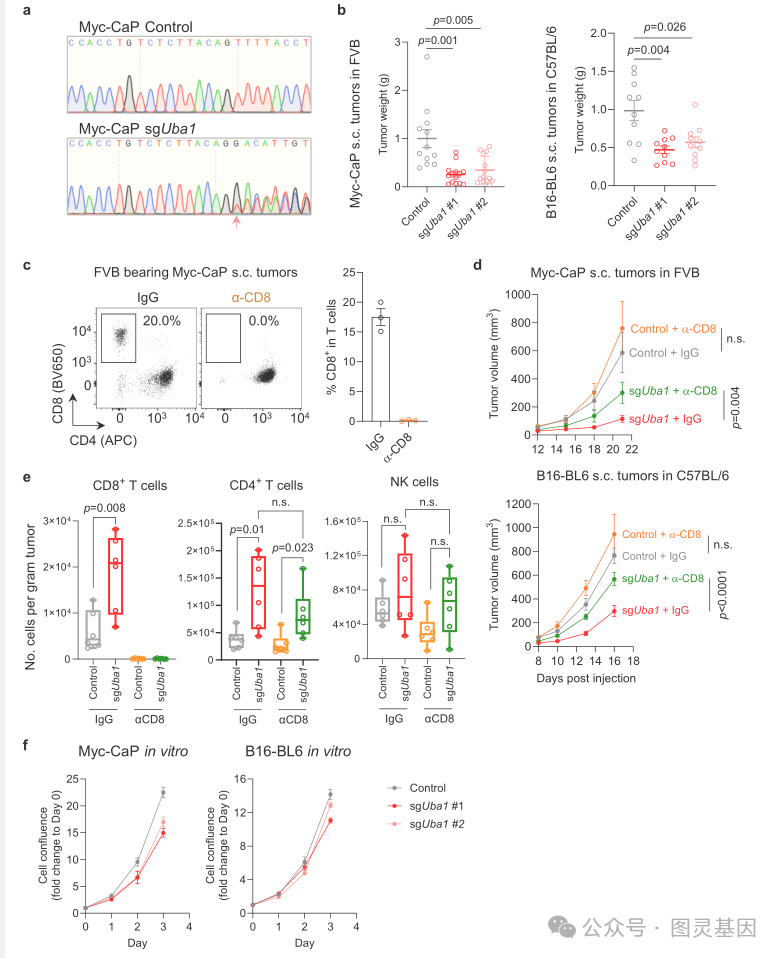
为了探索 UBA1 和 IFNG 之间的负相关是否存在因果关系,研究人员随后进行了临床前研究,在小鼠肿瘤中过度或过低表达 UBA1 。 UBA1 表达水平较高的小鼠肿瘤生长较快,而 UBA1 表达水平较低的小鼠肿瘤增长较慢。
UBA1 失活可上调体内干扰素信号
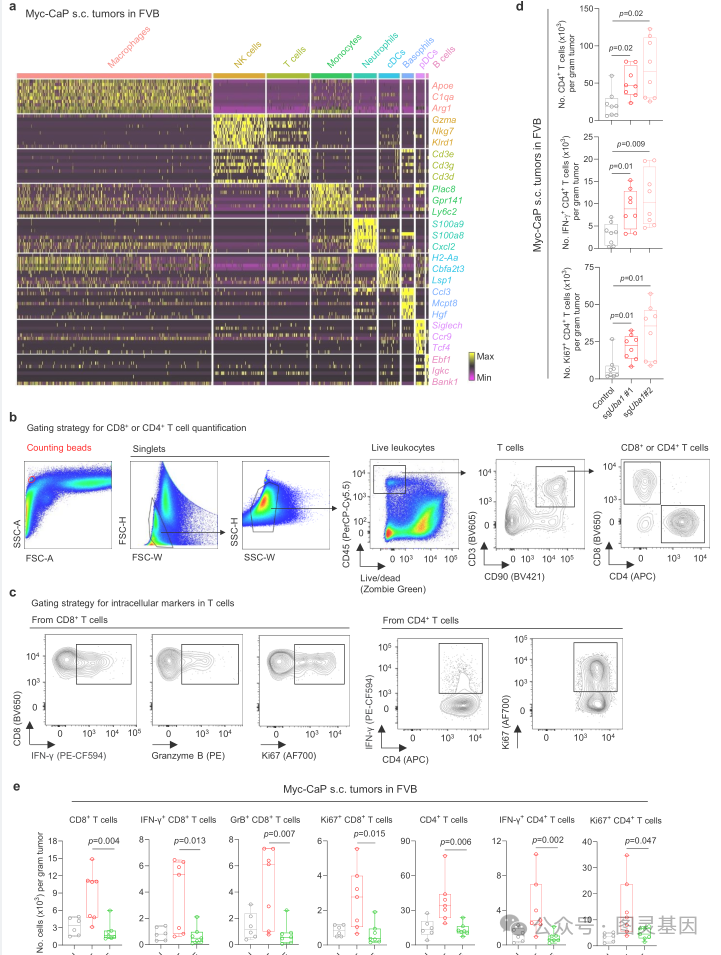
研究人员发现, UBA1 过表达阻断了 CD8+ T 细胞被招募到肿瘤中,使肿瘤逃脱免疫监视并迅速生长。
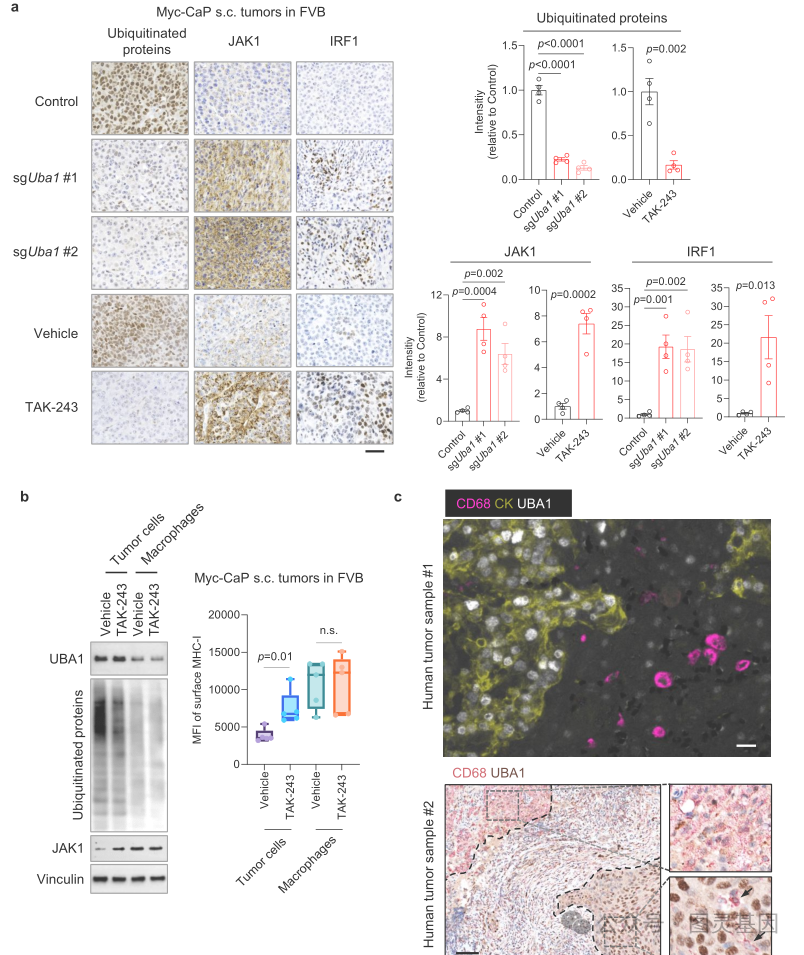
科学家们解释说:“重要的是,选择性 UBA1 抑制剂 TAK-243 在多个同基因模型中与 ICB 显著协同作用。从机制上讲, UBA1-STUB1 轴的衰竭或失活稳定了一个关键的干扰素通路组分( JAK1 ),增强了干扰素信号,并提高了关键的免疫调节剂,包括 CXCL9 、 CXCL10 和 MHC I 类。”
有了现在掌握的机制,研究人员测试了使用 TAK-243 抑制 UBA1 是否会增加免疫功能正常小鼠的 CD8+ 募集。结果确实如此:接受 TAK-243 和 ICB 治疗的小鼠中,有一半的肿瘤消失了。
Chinnaiyan 说:“在 UBA1 和 T 细胞募集之间建立这种联系是令人兴奋的。这在以前还没有被真正描述过。这可能会对免疫系统产生如此深远的影响,这令人惊讶(并真正为潜在的新疗法组合打开了大门)。”
这一发现意味着,将 TAK-243 与免疫检查点阻断疗法结合使用,可以使免疫疗法更加有效,甚至为冷肿瘤患者打开了大门。
Chinnaiyan 宣称:“我们已经奠定了基础, UBA1 抑制剂和 ICB 的结合可以很好地治疗某些类型的癌症。对于这背后的机制还有更多的研究要做,但令人兴奋的是,这项工作可能会刺激公司开发更多的 UBA1 抑制剂。但由于 TAK-243 已经可用,这种治疗组合实际上可能并不遥远。”
链接:http://www.lewenyixue.com/2024/12/27/Cancer%20Discov%20%7C%20%E7%99%8C%E7%97%87%E5%85%8D%E7%96%AB/







 知道|国家药品不良反应监测年度报告(2024年)
知道|国家药品不良反应监测年度报告(2024年)
赶快来坐沙发