来看点新东西,单细胞空间蛋白组
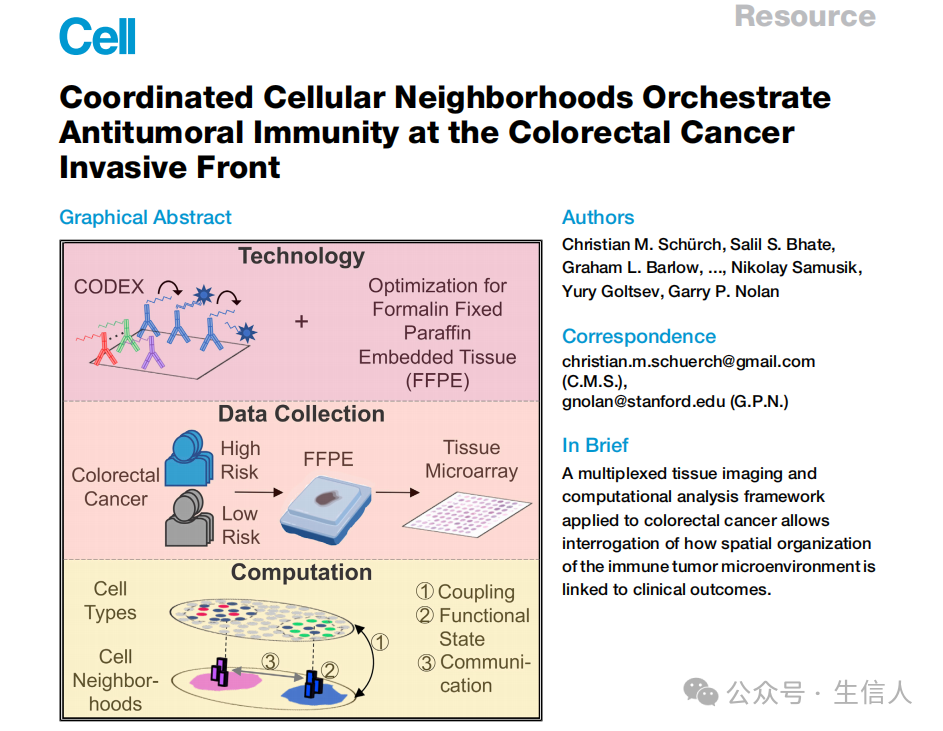
本文结论亮点
-
使用技术:FFPE样本的CODEX技术对35例CRC患者140个组织中56个标记物的多重组织成像
-
空间单细胞蛋白细胞邻域分析:揭示肿瘤微环境的空间组织
-
低、高危患者空间细胞比例变化:肿瘤组织和免疫成分的改变
-
预后分析:PD-1+ CD4+ T细胞的局部富集与高危患者的生存相关
抗肿瘤免疫需要免疫肿瘤微环境(iTME)组成部分之间有组织的、空间上细微的相互作用。了解有效和无效肿瘤控制中的这种协调行为将推进免疫治疗。
作者重新设计了检测FFPE样本的CODEX技术, 能够同时使用56种蛋白质标记物对35例晚期结直肠癌(CRC)患者的140个组织区域进行分析。 作者确定了9个保守的、不同的细胞邻域(cellular neighborhoods,CNs) - CRC iTME 特征的组成部分的集合。在高危患者亚群中,仅在粒细胞CN内富集PD-1+ CD4+ T细胞与生存率呈正相关。肿瘤和免疫CNs的偶联、T细胞和巨噬细胞CNs的断裂以及CN间通讯的中断与不良预后相关。
这项研究为探究复杂的生物过程(如抗肿瘤免疫)如何通过细胞和空间域的协同作用发生提供了一个框架。
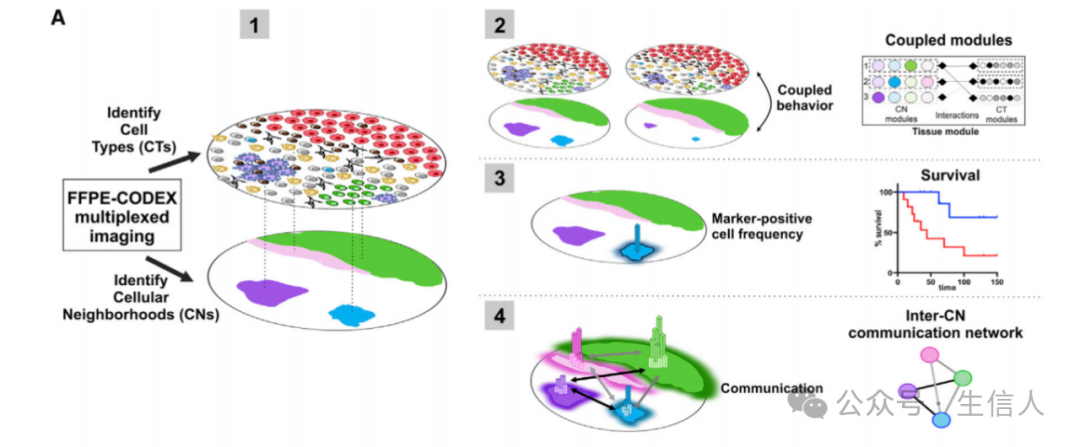
本文的分析思路
1:CODEX成像技术数据可以分别进行细胞类型鉴定(cell types、CTs)分析、细胞邻域(cellular neighborhoods、CNs)分析
2:将CTs与CNs结果进行整合分析,得到Coupled modules
3:在CNs结果基础上进行不同区域marker阳性细胞频率统计,预后分析
4:不同邻域间的细胞通讯分析,通讯网络构建
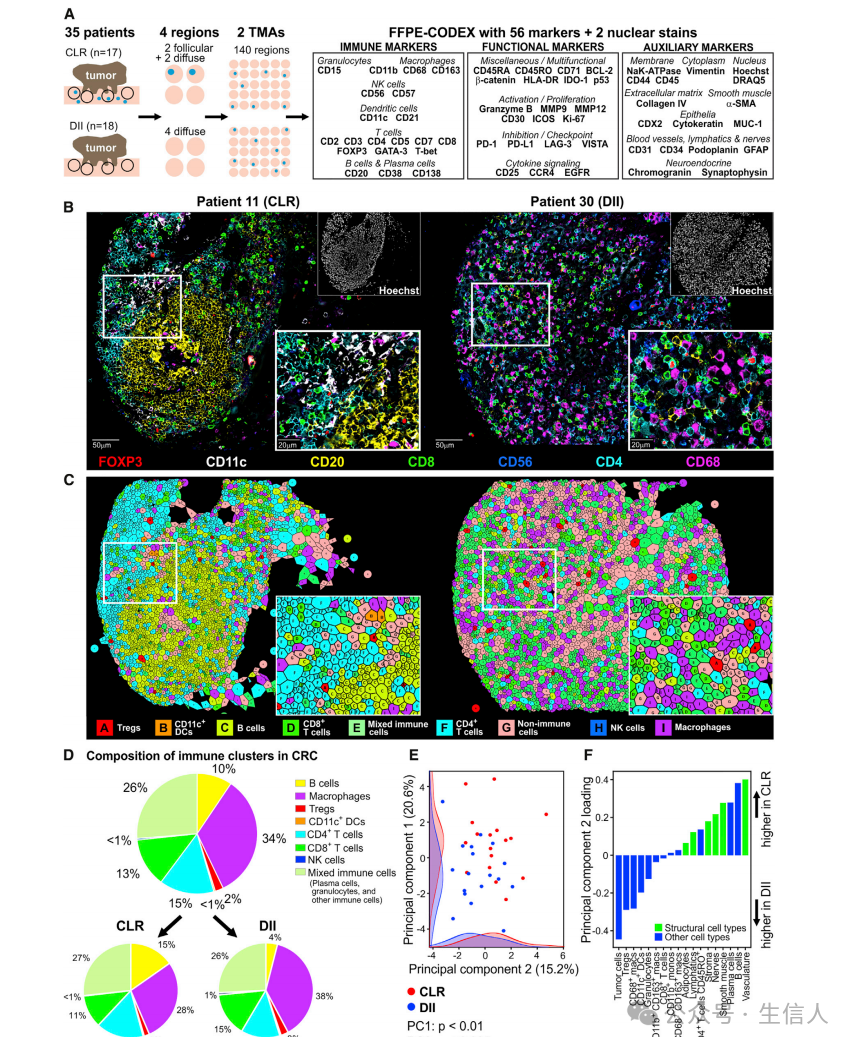
样本选择
淘汰标准: 术前治疗、病理肿瘤、结节、转移(pTNM)评分0-2分或未知、免疫浸润缺失(K-M评分0)、G-A得分资料不足、低免疫浸润(KM1)和缺失卵泡(GA0)或少量卵泡(GA1)的组合。 最终从715例CRC患者数据库中,选择了17例CLR和18例DII患者的队列,在肿瘤浸润前构建免疫肿瘤微环境的组织芯片(图1B和1C)。
CLR组: 其中一组在肿瘤浸润前沿表现出大量三级淋巴组织(TLSs)的从头形成——“克罗恩样反应”(Crohn’s-like reaction,CLR)
DII组: 另一组的定义为无TLSs和存在弥漫性炎症浸润(diffuse inflammatory infiltration,DII)
临床特征: CLR患者的总生存期远长于DII患者。
CLR患者中存在TLSs而DII患者中不存在TLSs,表明这两组之间的生存差异可能受到其抗肿瘤免疫反应差异的影响,而不仅仅是肿瘤内在因素。因此,使用CODEX技术比较CLR和DII患者的iTME将使我们能够识别出TLS之外的新邻域。

对FFPE样本优化的CODEX技术
优化的CODEX适用于临床相关组织中高度多重的单细胞标记物可视化、定量和生物标记物发现。
CODEX的工作流以及抗体验证:
图A:CODEX workflow;作者重新设计并完全自动化了CODEX平台,使用迭代退火、成像和剥离荧光标记的DNA探针,与组织结合抗体上的DNA条形码互补。优化的技术使用IHC与HE染色进行了验证(见图S1)。
图B:56-marker CODEX panel,多个肿瘤样本的7色组织芯片概览,7色标记marker在图片底部
图C:选取样本核心区域的高倍放大七色图像

FFPE-CODEX可以对样本iTME中主要免疫细胞类型进行原位识别和定量分析
在结直肠癌侵袭前沿,iTME通常表现为白细胞密集区与稀疏免疫浸润区交替。如前所述,在DII患者中免疫浸润中TLSs(滤泡)缺失,但在CLR患者的肿瘤中含量丰富。因此,作者对两个专门创建的高精度组织芯片进行了56个marker的CODEX,包括每个患者肿瘤浸润前的4个具有代表性的白细胞密集iTME区域,共得到140个区域。
CT聚类:通过使用X-shift进行无监督聚类,然后基于标记物表达谱、组织定位和形态学进行监督聚类合并,识别并验证了28个独特的CT clusters,包括18个免疫细胞簇,6个间质和血管系统簇,2个混合簇,1个肿瘤细胞簇和1个未定义簇。
图A:结直肠癌组织芯片示意图,蓝点代表卵泡/TLSs(三级淋巴结构)。
图B:CLR和DII患者代表性TMA核心采用七色图像描述。
图C:聚类的细胞类型Voronoi图(沃罗诺伊图),合并以降低复杂性
图D:8个免疫Cluster(n = 132,437个细胞)及其在所有CRC患者中的频率(上),并分为CLR (n = 57,894个细胞)和DII (n =74,543个细胞)(下)。在CLR和DII患者之间观察到这些免疫细胞簇组成的差异,CLR患者的B细胞出现频率更高,而DII患者的巨噬细胞的频率更高。其他没有显著差异。
图E:CLR与DII患者的细胞类型丰度的PCA分析
图F:主成分2中的细胞类型loadings。
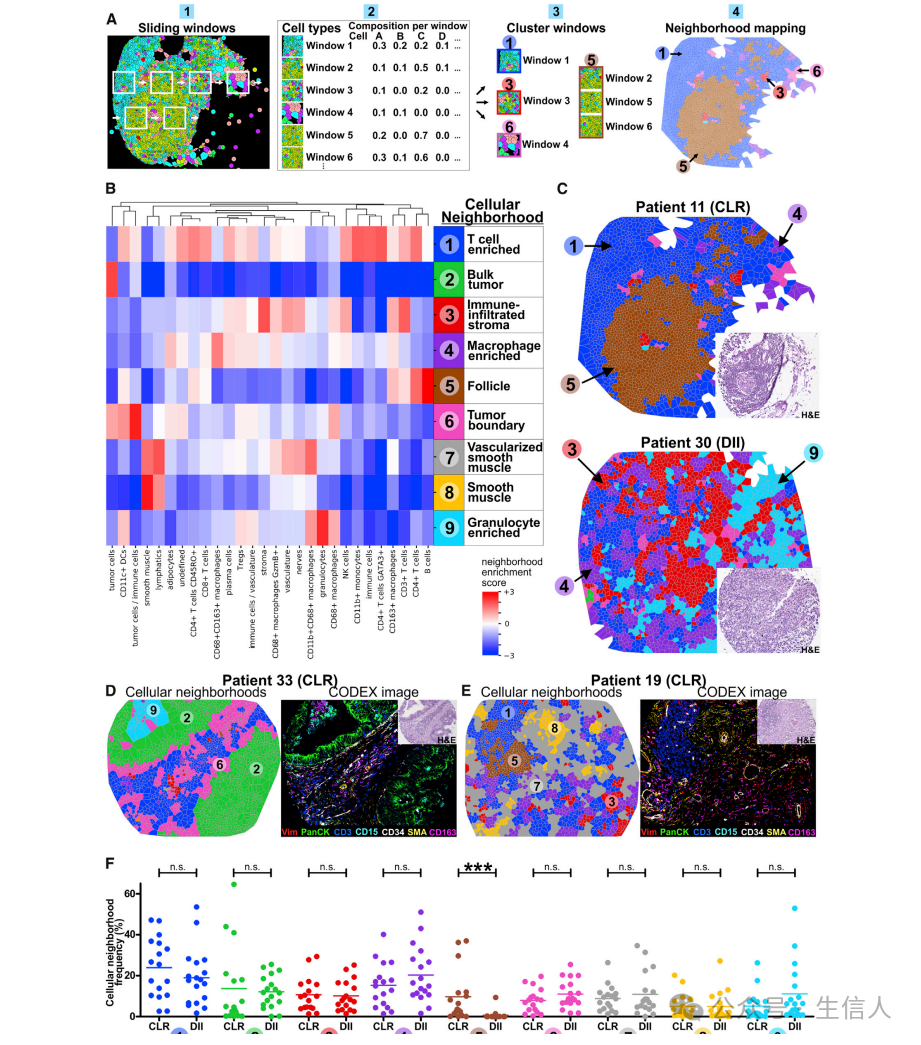
结直肠癌免疫肿瘤微环境的细胞邻域特征:在不同病人Group间具有保守性
从细胞形成的空间结构来观察患者样本,而不仅仅是单个细胞的集合,将为iTME的组织过程提供见解。
CN: 细胞邻域(cellular neighborhoods、CNs),定义 :We identified CNs as regions of the tissue with a specific local density of various CTs。
窗口定义: For every cell in the tissue, its 10 nearest spatial neighbors, which we labeled its ‘‘window,’’ were identified。
作者在CRC iTME中发现了10个不同的CNs,它们再现了核心组织成分,这在原始H&E染色切片和两组患者的荧光图像上得到了验证。除与TLS(滤泡)相对应的CN外,其余8个CNs广泛存在于CLR和DII患者中。接着,作者评估了不同CRC患者组之间CNs的频率是否不同,发现CNs在不同患者组中是常见的,很可能代表了CRC iTME的保守组织隔间。 这就提出了一个问题,即这些CNs之间是否有其他的结构和关系,可以解释CLR和DII之间的差异。
图A:CN识别示意图。
图B:识别9个不同的CNs
图C:CLR和DII患者CN代表性Vorsonoi图。插页为H&E图像。
图D &E:选择具有代表性的Voronoi图显示患者33 (D)和19 (E)的9种不同的CNs(左面板)和相应的7色图像(右面板)。插图,H&E图像
图F:CLR与DII患者的CNs频率。每个点代表每个患者四个TMA核的平均CN频率,水平线代表每个患者之间的平均频率(***p < 0.001, Student’s t检验)
DII患者中:肿瘤和免疫成分的偶联与T细胞和巨噬细胞CNs的偶联和碎片化有关
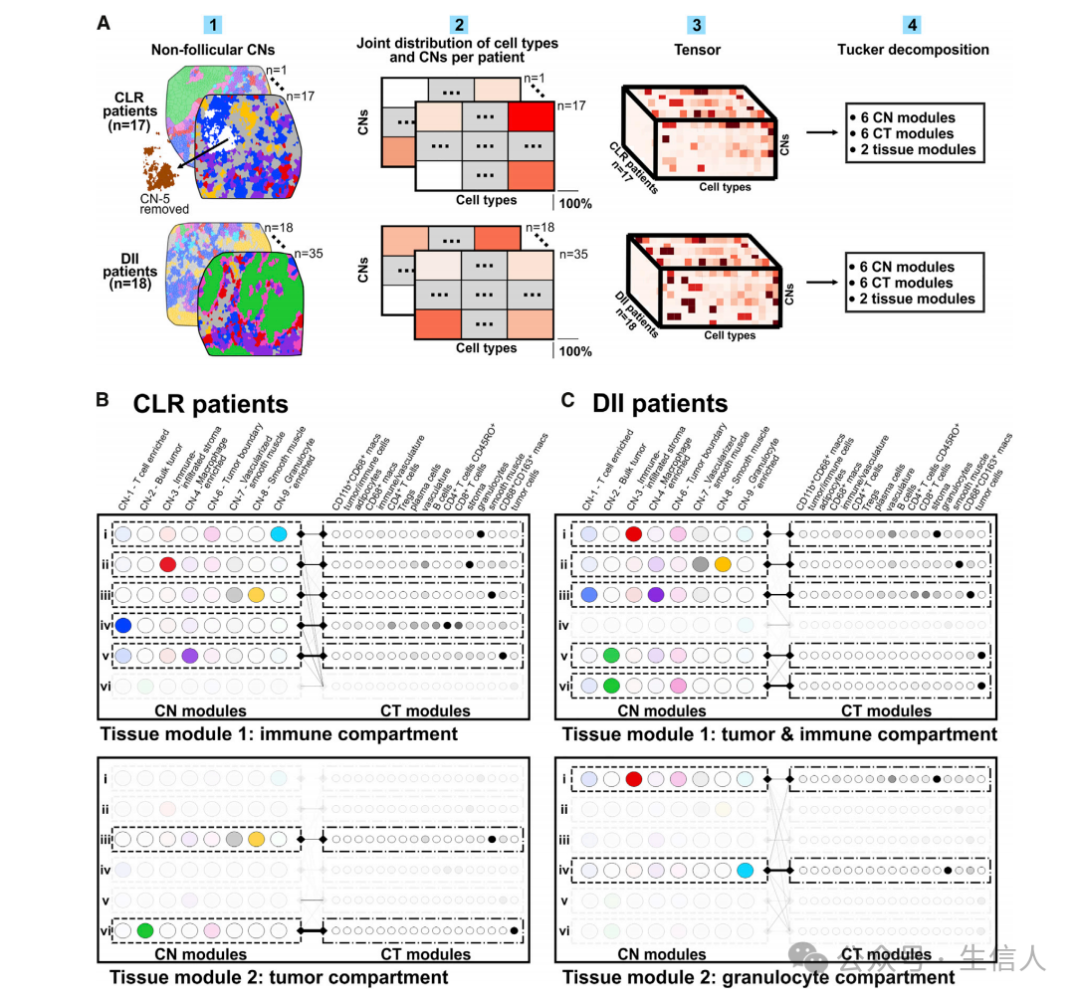
上一个结果中,鉴定的CNs提供了一个不同于CTs的患者样本视角。作者认为:同时从CT视图和CN视图可以更好地理解形成iTME的底层程序。因此,作者考虑对每例样本将CNs和CTs联合得到一个 joint composition matrix,并去掉CN-5(滤泡)的数据,因为它仅存在于CLR患者。该矩阵不仅描述了组织水平上的细胞定位(即,给定类型的随机抽样细胞在给定CN中的概率),而且还考虑了CN的丰度。联合的CN-CT组成差异应该有助于深入了解iTME过程在患者组之间的差异。
结果表明,在CLR和DII患者中存在潜在的程序差异导致iTME具有不同的空间组织。
图A:the tensor decomposition analysis示意图
图B:CLR患者的分解结果。组织模块(CN模块和CT模块的交互对)对应于“免疫室”(顶部)和“肿瘤室”(底部)。
图C:DII 患者的分解结果。组织模块对应于“免疫和肿瘤室”(顶部)和“粒细胞室”(底部)。
T细胞亚群上功能标记物的邻域特异性表达暗示:Bulk肿瘤中T细胞过程变化
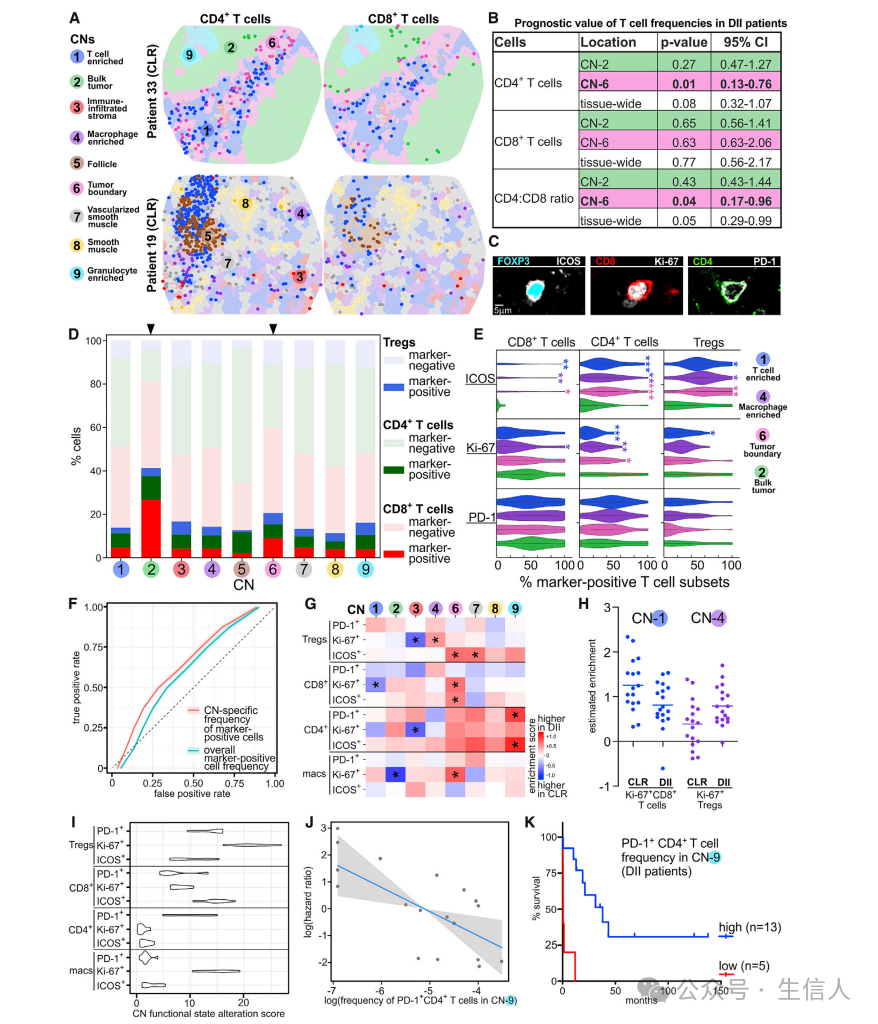
假设:如果每个CN中与抗肿瘤免疫同步相关的生物学过程在患者组之间发生改变,我们可以期望观察到其中相关功能CT的频率同时发生变化。
作者做了一系列模型验证说明:CLR和DII患者之间的CNs的功能状态是不同的,并且CN的功能状态可能与抗肿瘤免疫反应的功能相关。具体来说,通过PD- 1+ CD4+ T细胞的频率显示,富含粒细胞的CN的功能状态与DII患者的总生存率相关。在富含粒细胞的CN中所包含的T细胞亚群活性的某些方面可能有助于免疫活性。
图A:TMA spots的Voronoi图示例。不同颜色表示不同CNs,CN中的点表示CD4+(左)和CD8+ T细胞(右)。
图B:CNs中T细胞频率的Cox比例风险回归结果表。
图C:不同T细胞亚群上ICOS、Ki-67和PD-1染色
图D:每个CN中CD4+ (FOXP3) T细胞、CD8+ T细胞和Treg细胞至少有一种功能标记(ICOS、Ki-67和PD-1)呈阳性的相对比例。
图E:CN-1、CN-2、CN- 4和CN-6中标记阳性CD4+ T细胞、CD8+ T细胞和Treg细胞的CN特异性CT频率的小提琴图。
图F:ROC曲线 总的marker阳性细胞频率 vs CN特异的marker阳性细胞频率
图G:差异富集系数的热图,正系数(红色)表示在给定CN中相应的CT更富集。在DII患者中,Ki-67+ Treg细胞在CN-4中更富集,而在CLR患者中,Ki-67+ CD8+ T细胞在CN-1中更富集。
图H:每个患者CN-1中Ki-67+ CD8+ T细胞和CN-4中Ki-67+ Treg细胞的富集
图I:每个CT的CN功能状态改变评分
图J:CN-9中PD-1+ CD4+ T细胞的对数频率与DII患者总生存率的估计对数风险比的部分残差图(p = 0.006;n = 18,13例死亡;Cox比例风险回归)
图K:根据PD-1+CD4+ T细胞CN-9特异性频率将DII患者划分为两组的最佳Kaplan-Meier曲线
相关的CN功能状态提示在DII患者中存在免疫抑制的CN间通信和改变的通信网络
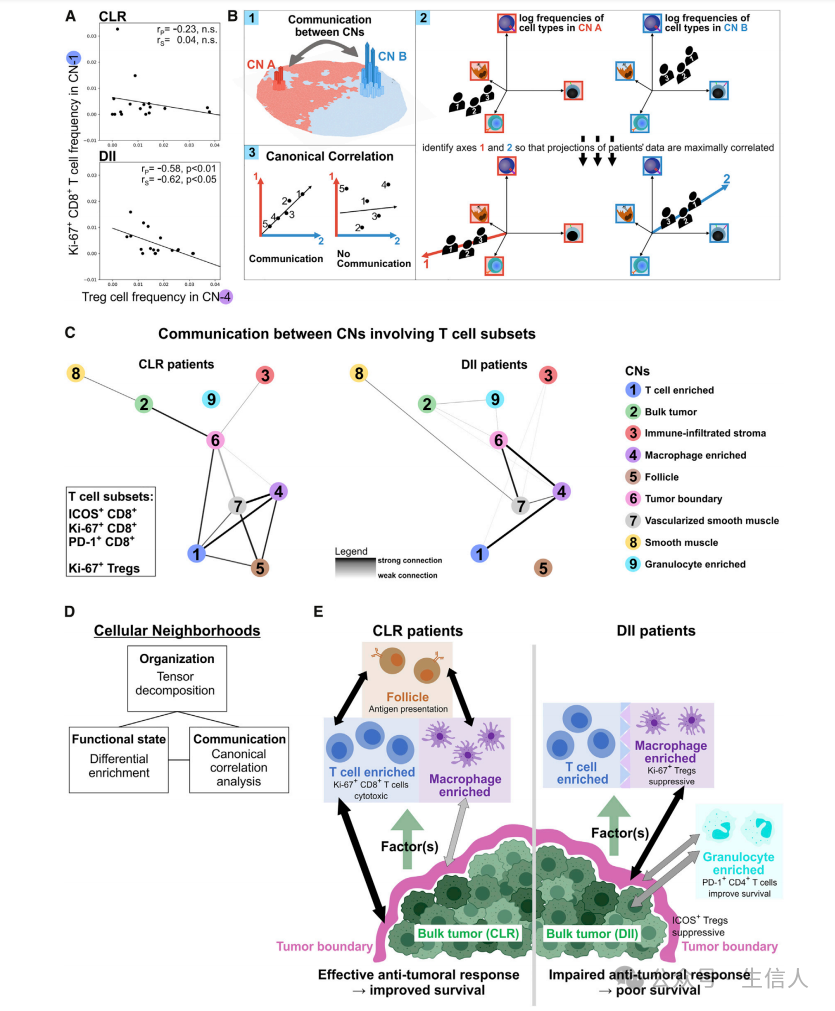
The tensor decomposition 表明不同的CNs可以招募相似的CTs组合,这可以解释为这些CNs之间的一种交流形式。因此,作者假设CNs之间的其他形式的交流可以产生功能状态相关性。这些相关性可能是由生物过程介导的,如免疫细胞浸润、抗原呈递、细胞因子产生或仍有待确定的过程。在DII患者中,相关性分析允许我们观察到CN-1(T细胞富集)和CN-4(巨噬细胞富集)之间可能的免疫抑制程序。此外,患者组之间关于功能性T细胞亚群的通信网络发生了改变,表明这种免疫抑制程序可能影响肿瘤边界和整体肿瘤中功能性T细胞亚群的表型。
图A:各患者组中CN-1(T细胞富集)中Ki-67+ CD8+ T细胞的频率与CN-4(巨噬细胞富集)中treg细胞的频率的相关性。斯皮尔曼秩和皮尔逊相关系数和p值显示。
图B:相关性分析的示意图
图C:将ICOS+、Ki-67+和PD-1+ CD8+ T细胞以及Ki-67+ Treg细胞在每对CNs中频率的典型相关性与每组患者的排列零分布进行比较。观察到的与这些CTs的典型相关性高于90%排列的CNs对通过边连接并可视化为图。
图D:描述CRC iTME空间行为的概念框架
图E:CLR和DII患者之间的iTME在CN组织(图5)、细胞功能(图6)和CN间通信方面的差异模型。
总结
该研究利用CODEX技术和分析框架系统描述了CRC的免疫肿瘤微环境iTME,鉴定了多个CNs并探测了它们的组织、功能状态和通讯关系。
参考文献
Schürch, Christian M et al. “Coordinated Cellular Neighborhoods Orchestrate Antitumoral Immunity at the Colorectal Cancer Invasive Front.” Cell vol. 182,5 (2020): 1341-1359.e19. doi:10.1016/j.cell.2020.07.005
链接:http://www.lewenyixue.com/2024/12/26/%E6%9D%A5%E7%9C%8B%E7%82%B9%E6%96%B0%E4%B8%9C%E8%A5%BF%EF%BC%8C%E5%8D%95%E7%BB%86%E8%83%9E%E7%A9%BA%E9%97%B4%E8%9B%8B%E7%99%BD%E7%BB%84/