致瘤新机制!同济大学赵德平团队:发现肿瘤治疗潜在策略
【导读】 胸腺上皮肿瘤(TETs)是一种罕见的恶性肿瘤,起源于前纵隔。TETs,尤其是胸腺癌(TC)的治疗选择仍然相对有限。
12月19日,同济大学赵德平研究团队在期刊《Journal of Experimental & Clinical Cancer Research》上发表了研究论文,题为“SNAI1 promotes epithelial-mesenchymal transition and maintains cancer stem cell-like properties in thymic epithelial tumors through the PIK3R2/p-EphA2 Axis”,本研究中,SNAI1被确定为TETs的中心转录因子,其与疾病侵袭性的正相关性得到证实。随后的实验表明,SNAI1的上调增强了TET细胞系的迁移、侵袭和上皮间质转化。此外,研究人员观察到SNAI1的过表达维持了癌干细胞样特性。单细胞RNA测序显示,SNAI1抑制剂抑制了巨噬细胞从M1表型向M2表型的转变,这一发现进一步通过多重免疫组织化学(mIHC)得到验证。研究人员通过CUT&Tag和RNA测序,识别出PIK3R2是SNAI1的下游靶点之一,这一发现通过ChIP-qPCR、CUT&RUN-qPCR、荧光素酶报告基因和免疫荧光分析得到验证。相关分析进一步证实PIK3R2直接与磷酸化的EphA2(p-EphA2)相互作用,促进下游GSK3β/β-连环蛋白信号通路。 本研究初步验证了SNAI1通过PIK3R2/p-EphA2轴在TETs中的致瘤作用。抑制SNAI1可能是TETs潜在的治疗策略。

https://jeccr.biomedcentral.com/articles/10.1186/s13046-024-03243-0#Sec31
背景介绍
01
胸腺上皮肿瘤(TETs)起源于胸腺。尽管它是前纵隔常见的肿瘤之一,但TETs的发病率相对较低,约为每百万人1.5例。近年来,多组学技术的进步使研究人员对TETs有了更深入的了解。分子亚型分类与疾病的临床特征密切相关。随后的研究整合了基因组学、转录组学、表观遗传学和蛋白质组学测序的数据,进一步阐明了TETs的基因组景观。研究人员还利用质谱和单细胞RNA测序阐明了肿瘤微环境的特征。遗憾的是,尽管研究人员对TETs有了初步的认识,但对潜在治疗靶点的探索和药物开发仍处于初期阶段。最近的临床试验仅证实了舒尼替尼和仑伐替尼在化疗耐药性TETs治疗中的有效性。仅使用帕博利珠单抗和纳武利尤单抗作为复发或晚期TETs的非一线疗法的可行性已经得到证明。还需要进行更多的研究来深入了解肿瘤发生机制,并为TETs确定潜在的治疗靶点。
上皮-间质转化(EMT)是一种生物学过程,它使上皮细胞转化为间质细胞。它在各种生理过程中起着至关重要的作用,包括组织重塑、伤口愈合和肿瘤发生。伴随着典型的形态学变化,基因、生理和代谢的改变共同促成了肿瘤细胞的肿瘤发生转变。它还被证实与癌细胞干性获得密切相关。SNAI1基因编码的Snail1蛋白是一种已广泛研究的转录因子,它可以直接促进EMT,因此被认为是EMT标志物之一。由于Snail1在EMT和维持癌细胞干性方面的关键作用,它也被认为是药物开发的有前途的治疗靶点。然而,Snail1在TETs中的肿瘤发生功能尚未得到充分验证。Snail1在促进EMT和促进TETs获得癌细胞干性方面的基本作用仍有待阐明。
SNAI1通过转录调控PIK3R2的表达,促进肿瘤进展
02
为了理解TETs的致瘤机制,研究人员进一步评估了SNAI1调控的靶基因。首先,采用CUT&Tag测序技术评估SNAI1与其下游靶基因的基因组相互作用。共鉴定出5301个靶基因的启动子区域。随后,通过RNA测序评估过表达SNAI1的TET细胞与对照细胞之间的DEGs。共鉴定出372个DEGs。之后,研究人员对重叠的105个SNAI1靶基因进行通路富集分析。KEGG分析揭示了几个明显的致瘤通路,尤其是PI3K/Akt信号通路。这与之前通过纤维细胞的scRNA-seq分析获得的结果一致。在这些致瘤通路中,PIK3R2被确定为关键基因。研究人员重新评估了CUT&Tag测序的结果,发现SNAI1的分布位点集中在PIK3R2的启动子区域附近。为了验证测序结果,研究人员在JASPAR数据库中进行了启动子扫描,并在PIK3R2启动子区域识别出高度可能的SNAI1结合位点。该位点与通过CUT&Tag识别的位点重叠。ChIP-qPCR分析进一步证实了SNAI1在Ty82细胞中直接与PIK3R2启动子结合。研究人员还进行了荧光素酶报告基因实验,以在体外验证SNAI1与PIK3R2启动子区域的结合,使用Ty82细胞。研究人员还进行了CUT&RUN分析,以证明SNAI1与PIK3R2 DNA的结合。此外,免疫荧光共定位实验显示,Snai1主要定位于细胞核中,而PIK3R2编码的p85β主要定位于TET细胞系的细胞质中。
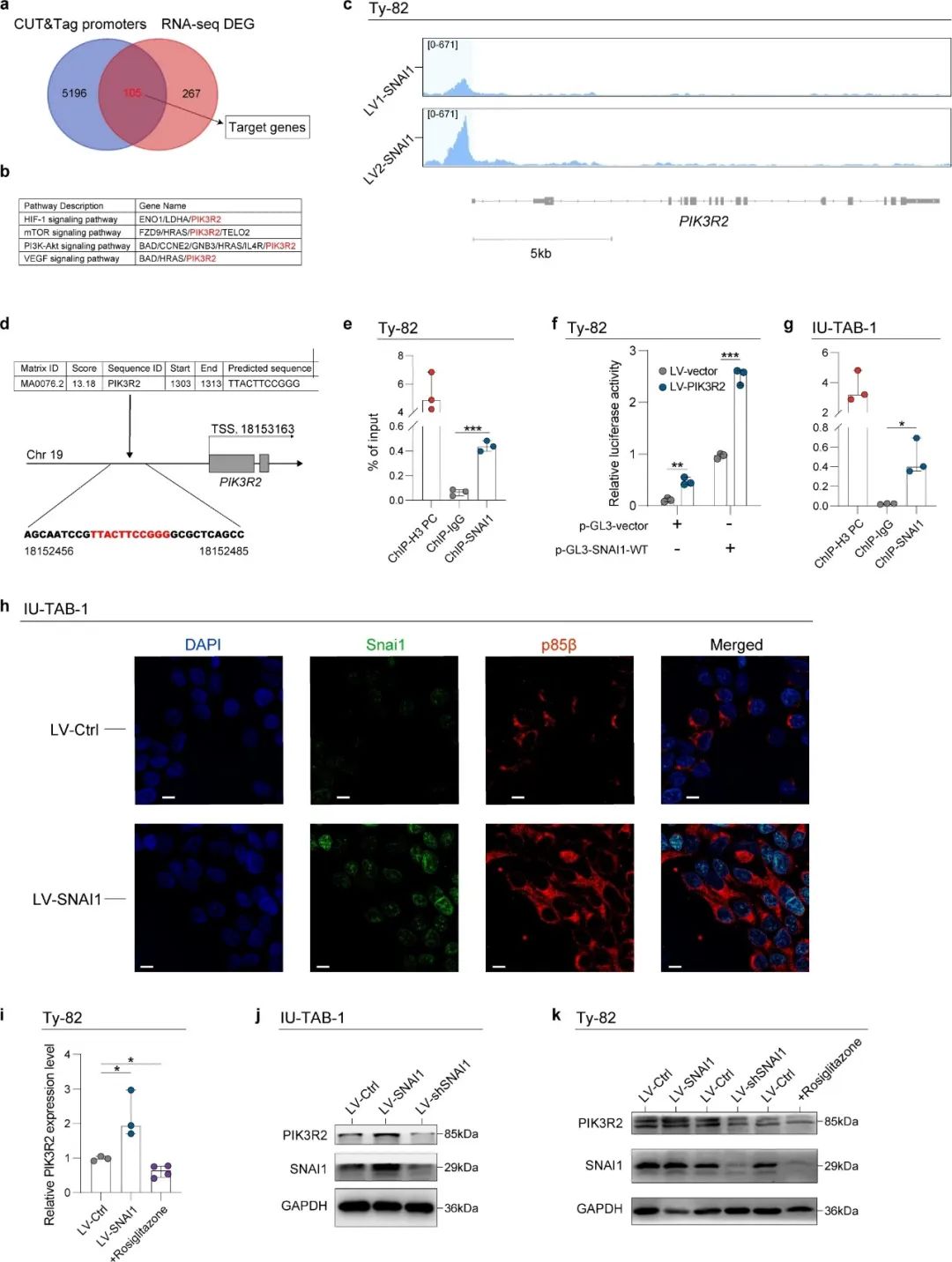
SNAI1下游靶点的选择
为了探讨PIK3R2在TETs中的临床意义,研究人员对获取的TC组织及其相邻的正常胸腺组织进行了IHC染色。结果显示,TC组织中PIK3R2的染色分值确实高于相应的正常对照组。此外,研究人员还证实,SNAI1的过表达可导致PIK3R2表达水平升高,而SNAI1的敲低则可逆转这一效应。
PIK3R2的敲低也逆转了SNAI1过表达对TET细胞增殖、迁移和侵袭能力的促进作用。在TET细胞中,PIK3R2敲低后,上皮间质转化(EMT)标志物的表达水平降低。相关实验进一步证实,PIK3R2敲低降低了肿瘤干性。PIK3R2敲低后,TET细胞的转移能力受到抑制。总之,这些结果表明,SNAI1功能性地调节PIK3R2的表达,从而促进肿瘤侵袭性。
结论
03
综上,SNAI1已被确认为TETs中一种重要的转录因子。SNAI1的致瘤作用通过PIK3R2/p-EphA2轴介导。这些发现有助于更深入地了解TETs的肿瘤发生机制,并为开发新的治疗策略提供了启示。
【参考资料】
https://jeccr.biomedcentral.com/articles/10.1186/s13046-024-03243-0#Sec31
链接:http://www.lewenyixue.com/2024/12/24/%E8%87%B4%E7%98%A4%E6%96%B0%E6%9C%BA%E5%88%B6%EF%BC%81%E5%90%8C%E6%B5%8E%E5%A4%A7%E5%AD%A6%E8%B5%B5%E5%BE%B7%E5%B9%B3%E5%9B%A2%E9%98%9F%EF%BC%9A%E5%8F%91%E7%8E%B0%E8%82%BF%E7%98%A4/





赶快来坐沙发