中国抗癌协会青年科学家奖专栏 | 病理分级的时空异质性在非转移性肾癌动态演进过程中的预后价值探索
临床研究
与应用
病理分级的时空异质性在非转移性肾癌动态演进过程中的预后价值探索
雷畅, 葛思论, 周烨, 陈辉, 王林辉, 曲乐
(南京大学医学院
附属金陵医院)
前言
目的: 探讨非转移性肾癌在潜伏性和侵袭性生长过程中病理分级的时空异质性特点及其与临床结局的相关性。
方法: 回顾性分析2003年1月至2023年12月期间于国内13家医疗中心接受手术治疗的316例肾癌伴局部复发患者和429例肾癌伴静脉癌栓患者的病例资料,分别选取肾癌原发灶与复发灶、原发灶与癌栓组织之间的病理分级差异,作为肾癌动态演进过程中时空异质性的应用场景,并将病理分级变化定义为一种新的四分级方案(升级、降级、稳定低级别和稳定高级别):稳定低级别或稳定高级别是指肿瘤原发灶和癌栓/复发灶均表现为低级别(WHO/ISUP Ⅰ级或Ⅱ级)或高级别(WHO/ISUP Ⅲ级或Ⅳ级)。升级是指原发灶为低级别,癌栓/复发灶为高级别;相反,降级是指原发灶为高级别,癌栓/复发灶为低级别。分析病理分级变化的潜在影响因素及其对患者预后的影响。
结果: 肾癌伴静脉癌栓患者和肾癌伴局部复发患者的中位癌症特异性生存期(cancer-specific survival,CSS)分别为83个月和76个月,5年CSS率分别为65.6%和60.6%。分别有38.0%和43.6%的患者原发灶与癌栓、原发灶与复发灶的病理分级存在变化。Lasso-Logistic回归分析显示原发肿瘤坏死与病理分级变化密切相关。Kaplan-Meier生存曲线显示病理分级变化与患者预后显著相关,将Leibovich评分、UISS评分和GRANT评分中的病理分级替换为病理分级变化后,模型的预测效能得到显著提升,差异具有统计学意义(P<0.05)。
结论: 在非转移性肾癌动态演进过程中,存在病理分级的时空异质性。相对于孤立事件的病理分级,病理分级的时空变化是预测肾癌伴静脉癌栓患者和肾癌伴局部复发患者预后更准确的独立影响因素,纳入病理分级变化可显著提高既往预后模型的预测效能。

通信专家
曲乐 教授
南京大学医学院
附属金陵医院
教授,现任南京大学医学院附属金陵医院泌尿外科行政副主任、副主任医师、博士生导师,为教育部青年长江学者、江苏省杰出青年基金获得者。兼任中华医学会泌尿外科分会基础学组委员、江苏省抗癌协会泌尿男生殖系肿瘤专业委员会委员、江苏省医师协会泌尿外科医师分会委员。长期聚焦肾脏肿瘤的精准诊疗和转化研究,并获国家发明专利授权5项。主持国家自然科学基金面上项目、博士后创新人才支持计划,江苏省六大人才高峰等课题,作为学术骨干参与国家重点研发计划。以第一或通讯作者在Cancer Cell、EuropeanUrology、Nature Communications、Science Advances等SCI期刊发表论文数十篇。获全军优秀博士论文、中国医师协会年度最佳临床研究论文奖、江苏医学科技进步奖一等奖、教育部科技进步奖一等奖和国家科学技术进步奖二等奖等。受英国皇家外科学院邀请参编英文专著Kidney Cancer,作为副主编出版国内首部肾脏肿瘤专著《肾脏肿瘤外科学》,任《国际泌尿系统杂志》、Clinical Genitourinary Can-cer及Chinese Medical Journal期刊编委。
前言
肾细胞癌(renal cell carcinoma,RCC),简称肾癌,是最常见的泌尿系统肿瘤之一,约30%的患者在根治性切除术后会发生复发或转移[1]。在肾癌的动态演进过程中,其潜伏性生长可以表现为肾脏肿瘤根治性切除术后的局部复发,侵袭性生长可以表现为肾脏肿瘤向血管内的延伸,导致肿瘤在不同时间节点和空间位置上展现出独特的异质性。 这种时空异质性不仅导致治疗效果的参差不齐,也使得预后评估难以精确化[2]。 既往针对肾癌时空异质性的研究主要聚焦于转移性疾病状态,如发现原发灶和远处转移灶的免疫微环境不同[3]、不同转移部位对免疫治疗的敏感性存在显著差异[4]。然而,对于预后差异更加显著的非转移性肾癌,目前关于时空异质性的研究相对较少,其在预后价值方面的探索仍是空白。
针对非转移性肾癌的差异性预后现状,既往研究已开发了多种预测模型并被指南采纳。例如,欧洲泌尿外科协会(European Association of Urology,EAU)认为加利福尼亚大学洛杉矶分校的综合分期系统(University of California Integrated Staging System,UISS)[5]、Leibovich评分[6]和病理分级、年龄、淋巴结和肿瘤大小(Grade, Age, Nodes and Tumour, GRANT)[7]评分是目前评估透明细胞性肾细胞癌预后最有效的模型,而欧洲肿瘤内科学会(European Society for Medical Oncology, ESMO)则推荐UISS和Leibovich评分。然而,当这些模型应用于前瞻性肾癌队列进行验证时,其预测效能均不能达到令人满意的效果[8]。如何提高上述模型的预后预测效能成为了肾癌领域研究的热点问题。
既往文献表明,病理分级是透明细胞性肾细胞癌与乳头状肾细胞癌患者预后最有力的预测因子之一[9],上述模型都纳入了原发肿瘤的病理分级这一重要指标。然而, 在临床实践中,观察到非转移性肾癌的演进过程中,肿瘤原发灶与复发灶、原发灶与癌栓组织的病理分级往往不一致,如果将肿瘤病理分级在时间和空间上的差异纳入上述模型,可能会提供更多有价值的预后信息。
考虑到局部复发代表了肿瘤潜伏性生长导致的时间维度上的动态演进,而静脉癌栓则代表了肿瘤侵袭性生长导致的空间维度上的动态演进, 本研究选取了肾癌伴局部复发时复发灶与原发灶之间的病理分级差异,以及肾癌伴静脉癌栓时癌栓组织与原发灶之间的病理分级差异,分别作为非转移性肾癌时间异质性和空间异质性的应用场景, 旨在加深对肿瘤时空异质性的理解和探索,利用肾脏肿瘤的时空变化为当前指南推荐的预后模型提高效能,从而为非转移性肾癌患者提供更准确的风险分层。
01
材料与方法
1.1 研究对象
通过华东地区肾脏肿瘤临床研究协作组(REMEMBER),回顾性收集了2003年1月至2023年12月期间国内13家医疗中心因肾癌伴局部复发或肾癌伴静脉癌栓行手术治疗的患者资料。肾癌伴局部复发是指肾部分切除术或根治性肾切除术后,在同侧腹膜后(包括残余肾脏、肾窝、腰肌、血管、肾上腺和区域淋巴结)再次出现经病理证实的肾癌。肾癌伴静脉癌栓是指肾肿瘤向肾静脉系统的血管管腔内扩散, 从而形成静脉癌栓。排除标准:1)患者年龄小于18周岁;2)存在远处转移;3)静脉癌栓或局部复发灶未行手术治疗;4)遗传性肾癌或双侧肾癌;5)除透明细胞性肾细胞癌或乳头状肾细胞癌之外的亚型;6)手术切缘阳性;7)最后一次手术前行新辅助治疗;8)缺乏病理切片进行集中审查;9)临床资料或随访信息缺失;10)对于局部复发队列,排除了原发灶与复发灶病理类型不一致的患者,以及复发时间间隔小于3个月的患者。
1.2 数据收集和临床结局
收集患者的性别、年龄、体重指数(body mass index, BMI)、肿瘤大小等临床和病理资料,以及 Leibovich评分、UISS评分和GRANT评分所需的变量。对所有患者的病理切片进行集中审查,并根据世界卫生组织/国际泌尿病理学会(World Health Organization/International Society of Urological Pathology,WHO/ISUP)提出的病理分级标准[9],重新评估了肿瘤原发灶和癌栓、原发灶和复发灶的病理分级,并将病理分级变化定义为一种新的 四分级方案(升级、降级、稳定低级别和稳定高级别):稳定低级别或稳定高级别是指肿瘤原发灶和癌栓/复发灶均表现为低级别(WHO/ISUP Ⅰ级或Ⅱ级)或高级别(WHO/ISUP Ⅲ级或Ⅳ级)。升级是指原发灶为低级别,癌栓/复发灶为高级别;相反,降级是指原发灶为高级别,癌栓/复发灶为低级别。
主要终结统计指标是癌症特异性生存期(cancer-specific survival, CSS),定义为从手术治疗到癌症相关死亡或到末次随访的时间。
1.3 统计学分析
所有统计分析均使用R软件(4.2.1)进行。连续变量以平均值±标准差或中位数(四分位数间距)表示,分类变量以频率和百分比表示。生存分析采用Kaplan-Meier法进行,使用Log-rank检验比较不同组别间的生存差异。通过Lasso回归分别筛选出癌栓和局部复发队列病理分级变化的潜在影响因素,并将这些因素纳入多因素Logistic回归分析。使用多因素Cox回归评估各变量对预后的影响,将既往模型报告的回归系数应用于癌栓和局部复发队列中的每个相应变量,计算C-指数以评估模型的预测效能。此外,将模型中的病理分级替换为病理分级变化,计算改良模型的C-指数,并通过非参数检验方法与原模型进行比较,以评估病理分级变化对模型的增量价值[10]。采用受试者工作特征(receiver operating characteristic,ROC)曲线评估模型预测的准确性。所有检验均为双尾,P< 0.05代表差异具有统计学意义。
02
结果
2.1 患者基本情况
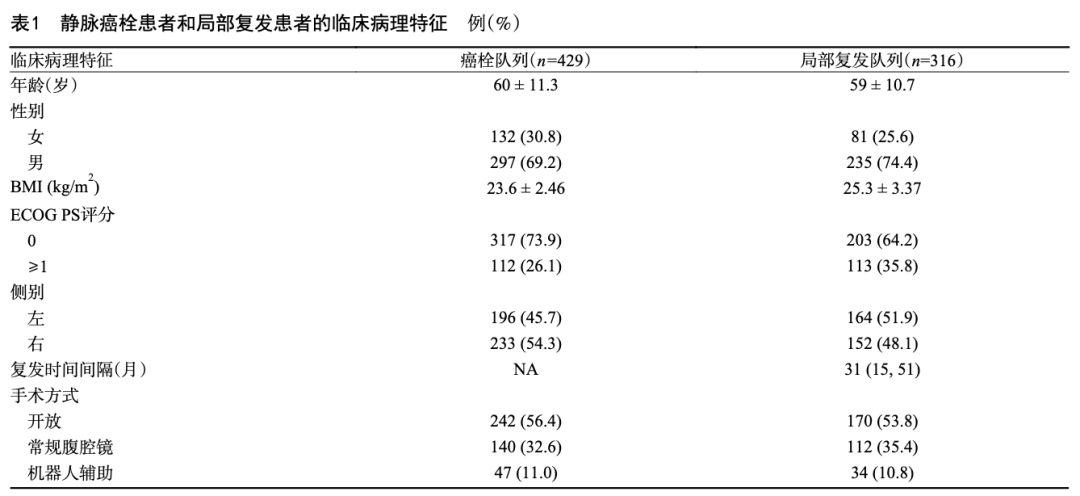
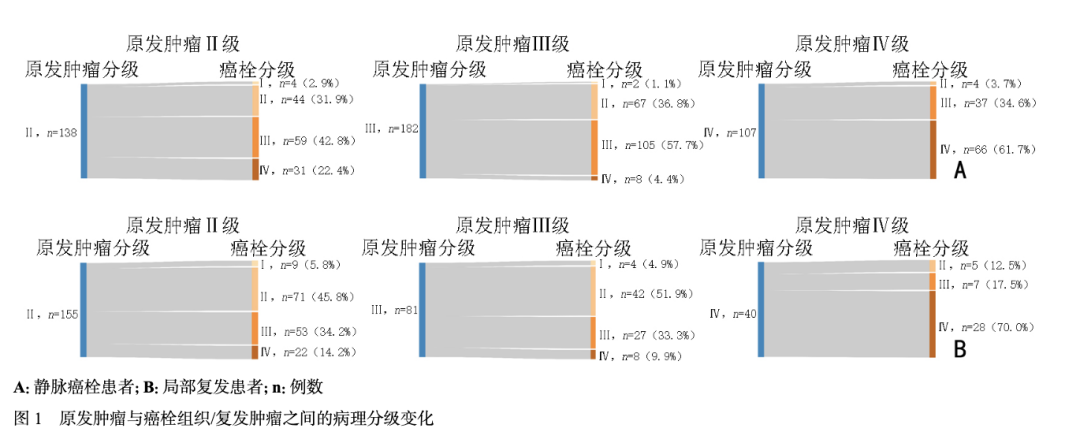
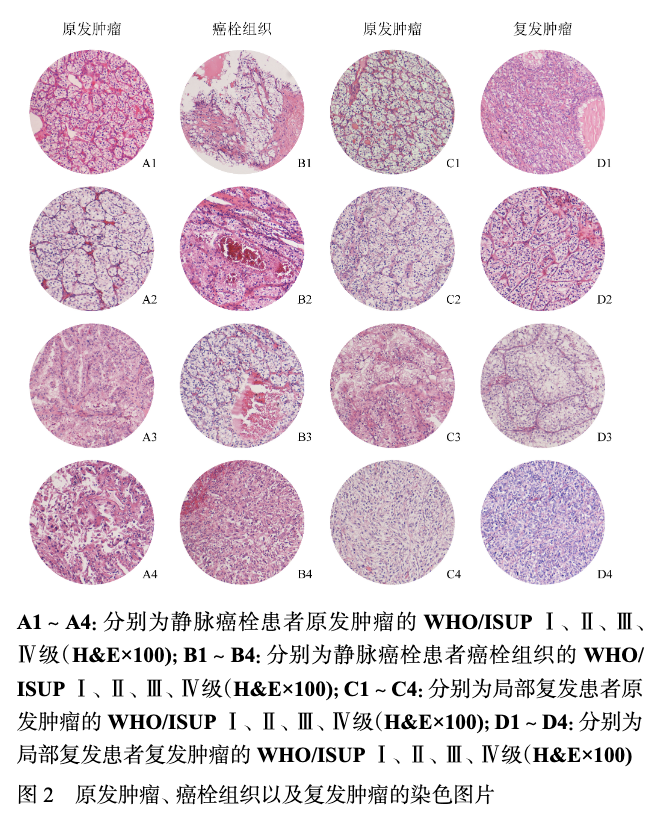
共纳入符合标准的肾癌伴静脉癌栓患者429例,肾癌伴局部复发患者316例,两组患者的临床病理特征见表1。 癌栓和局部复发患者的中位CSS分别为83个月和76个月,5年CSS率分别为65.6%和60.6%。在癌栓和局部复发患者中,分别有38.0%和43.6%的患者癌栓组织和局部复发灶的病理分级与原发灶存在差异,其中17.0%和16.1%为降级,21.0%和27.5%为升级。详细的病理分级变化见图1。原发肿瘤、癌栓组织以及复发肿瘤的代表性WHO/ISUP Ⅰ、Ⅱ、Ⅲ、Ⅳ级H&E染色图片见图2。

2.2 病理分级变化的影响因素
通过Lasso-Logistic回归分析,确定了病理分级变化的独立影响因素(图3)。在癌栓队列中,癌栓组织坏死是病理分级变化的潜在影响因素,但未达到显著性水平(P > 0.05)。在两个队列中,原发肿瘤坏死均与病理分级变化显著相关(P < 0.05)。
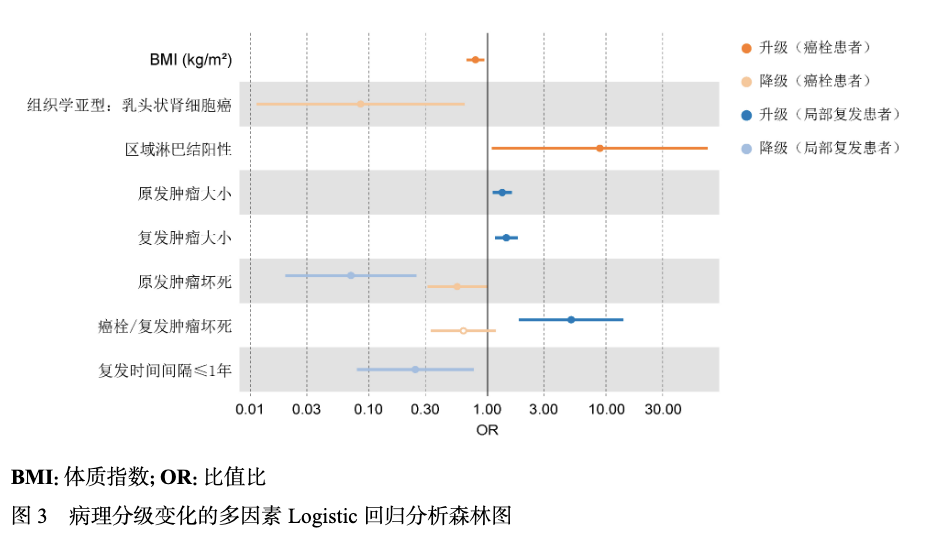
2.3 病理分级变化的预后价值
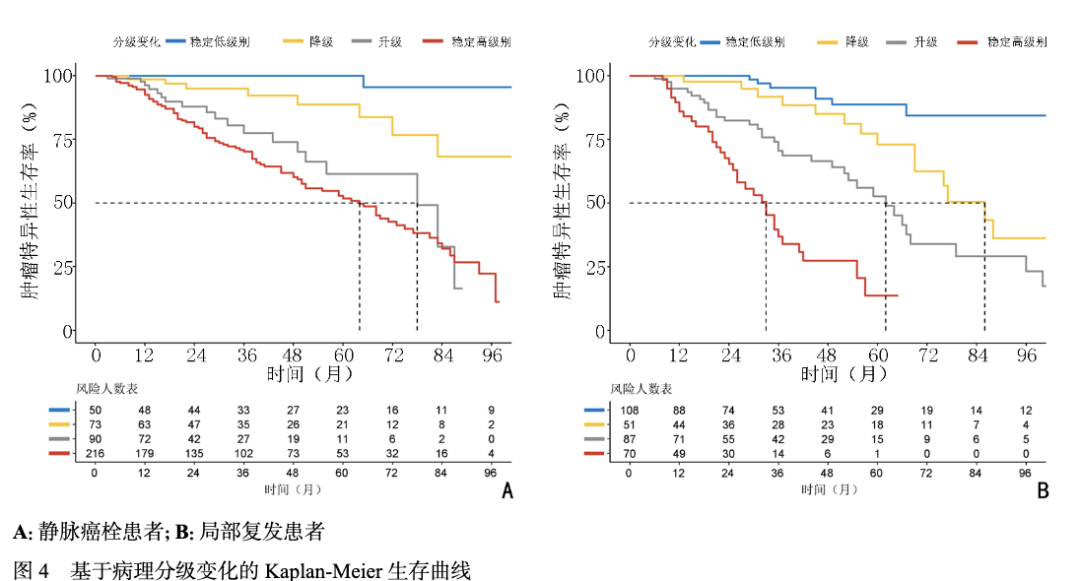
按病理分级变化分组的Kaplan-Meier生存曲线见图4。癌栓队列的中位CSS分别为稳定高级别组64个月、升级组78个月、降级组和稳定低级别组均未达到。局部复发队列的中位CSS分别为稳定高级别组33个月、升级组62个月、降级组86个月、稳定低级别组未达到,差异有统计学意义。
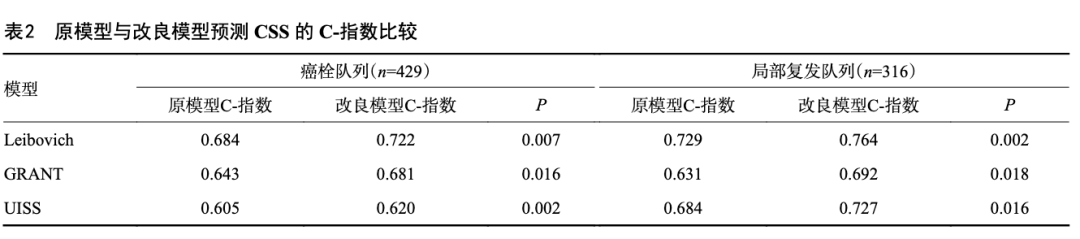
将Leibovich评分、UISS评分和GRANT评分应用于癌栓和局部复发队列,根据各模型报告的回归系数对每个变量进行赋值,其预测CSS的C-指数见表2。将原模型的病理分级替换为病理分级变化后,构建改良模型,结果显示病理分级变化的引入显著提高了各模型的预测效能,差异有统计学意义(表2)。ROC曲线显示,改良模型的曲线下面积优于原模型,其预测预后的准确性更高(图5)。

03
讨论
在临床实践中,肿瘤的动态演进与时空异质性对于确定生物标志物、选择治疗方案、明确耐药机制及预测预后具有至关重要的作用。本研究揭示了非转移性肾癌基于病理分级的时空异质性及其与患者预后的相关性,强调了肿瘤动态演进的复杂性。
Fuhrman分级作为评估细胞核和核仁特征的病理分级系统,已在国际上广泛应用多年。尽管该系统已被证明具有预后预测效用,但由于难以一致地描述形态并分配四个等级,分级评估的可重复性一直存在问题[11-14]。根据2012年的ISUP肾肿瘤病理学共识会议的结论,病理学家提出了一种新的WHO/ISUP分级系统,并被WHO推荐使用[15]。该系统也是一个四分级系统,通过评估核仁突出程度来确定Ⅰ~Ⅲ级,并以高度非典型的“多形性”细胞、肉瘤样或横纹肌样分化的存在来定义Ⅳ级。在实践中,WHO/ISUP分级与Fuhrman分级相似,但更易于应用,并且具有更好的可重复性和临床相关性。在采用WHO/ISUP分级系统后,RCC的分级应更为一致。然而,由于RCC的瘤内异质性,同一肿瘤内常常存在不同等级的区域。在这种情况下,总体病理分级应基于肿瘤内观察到的最高分级区域,这也是目前临床实践中最常用的标准[15]。然而,关于将何种比例的最高分级区域作为总体病理分级的标准尚未统一,仍需要进一步研究。
目前已有许多预后模型被广泛接受并应用于肾癌术后管理和辅助临床试验设计中,虽然这些模型考虑了临床病理变量,但未能涵盖肿瘤动态演进过程中所产生的时空异质性,而且这些模型在前瞻性队列验证中的预测能力未达预期[8],因此,迫切需要对模型进行改良,以更精准地用于预后评估和辅助临床试验设计。本研究通过将病理分级变化与现有预后模型结合,显著提升了模型的预测效能。对于静脉癌栓患者和局部复发患者,改良的Leibovich评分能更准确地预测预后,C-指数分别为0.722和0.764。
本研究是首次针对非转移性肾癌患者的病理分级时空异质性进行预后价值评估。然而,研究仍存在以下局限性:首先,本文两个队列均缺乏基因组学特征,因此无法确定驱动癌栓形成的关键克隆亚群,以及复发是否源自肿瘤的残留生长或新的肿瘤形成,但本研究排除了手术切缘阳性的患者;其次,所有组织标本均通过手术切除获得,仅行穿刺活检的患者的病理分级异质性及其预后价值尚不明确;最后,作为一项回顾性研究,可能存在选择偏倚,本文发现仍需在前瞻性的大规模研究中进行验证。
综上所述,本研究首次将肿瘤时空异质性应用于非转移性肾癌患者的动态演进过程中,发现肾癌伴局部复发以及肾癌伴静脉癌栓存在病理分级的不一致。病理分级变化可作为预测非转移性肾癌患者预后的参考指标,并且将其引入既往的预测模型中可显著提高预测效能。
End
引用本文:
雷畅, 葛思论, 周烨, 陈辉, 王林辉, 曲乐. 病理分级的时空异质性在非转移性肾癌动态演进过程中的预后价值探索[J]. 中国肿瘤临床, 2024, 51(17): 902-908. DOI: 10.12354/j.issn.1000-8179.2024.20240647
链接:http://www.lewenyixue.com/2024/12/23/%E4%B8%AD%E5%9B%BD%E6%8A%97%E7%99%8C%E5%8D%8F%E4%BC%9A%E9%9D%92%E5%B9%B4%E7%A7%91%E5%AD%A6%E5%AE%B6%E5%A5%96%E4%B8%93%E6%A0%8F%20%7C%20%E7%97%85%E7%90%86%E5%88%86/





赶快来坐沙发