Blood丨朱平/杨文钰联合剑桥团队合作揭示儿童急性髓系白血病单细胞水平克隆演化及表观调控机制
儿童急性髓系白血病(Pediatric acute myeloid leukemia, pAML)约占儿童白血病的20%,是一种异质性强、预后不良的恶性血液肿瘤。根据基因组突变,pAML可分为多种分子亚型。目前,传统化疗仍是其主要治疗手段,但复发和耐药问题严重影响患者的生存率和预后。现有研究表明,耐药性通常与白血病干细胞(Leukemia stem cells, LSCs)的存在密切相关,这类细胞在化疗后残留并推动疾病复发。近年来,表观遗传调控,特别是染色质可及性的异常变化在造血干细胞分化过程中发挥关键作用,被认为是多种恶性血液肿瘤的重要致病因素。但表观遗传调控机制在pAML发病和复发中的具体作用尚未完全阐明,特别是调控疾病复发和耐药过程中优势克隆和恶性克隆的分子机制,有待进一步研究。
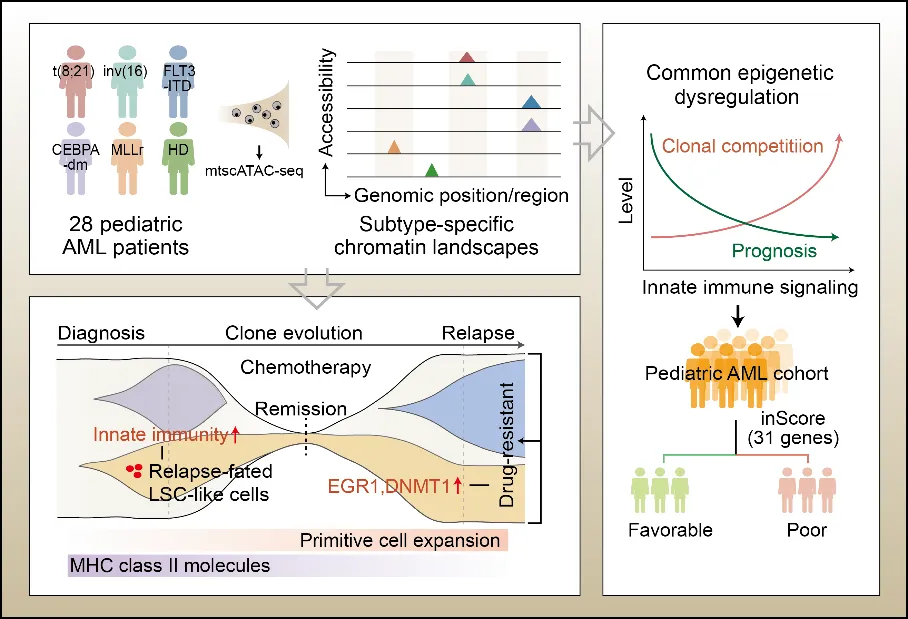
近日,中国医学科学院血液病医院(中国医学科学院血液学研究所) 朱平研究员、杨文钰教授 联合英国剑桥大学 Bertie Gottgens教授 团队,在 Blood 发表题为 Single-cell epigenetic and clonal analysis decodes disease progression in pediatric acute myeloid leukemia 的研究论文。 该研究利用mtscATAC-seq技术,系统分析了28例初诊及8例复发配对的pAML患者,涵盖了多种具有不同预后风险的分子亚型,在表观调控水平构建了pAML的单细胞染色质可及性图谱 。研究揭示了pAML分子亚型特异性的异常分化模式和染色质可及性特征,这些发现为进一步理解pAML的发病机制和复发耐药提供了重要线索。此外,研究团队还搭建了开放的数据访问平台(http://www.pzhulab.com/app/Pediatric_AML_mtscATAC),供研究人员在线访问。
通过比较初诊和正常样本,该研究表明,天然免疫信号异常激活是pAML恶性克隆扩增的重要驱动因素,并与患者预后不良显著相关。通过深入分析,研究团队提炼出一个核心基因集“inScore”。该基因集独立于儿童AML COG(Children's Oncology Group)预后风险分组体系,能够进一步提高pAML患者临床预后风险分级的准确性,为个体化治疗方案的制定提供了新依据。此外,研究还鉴定出一类存在于初诊样本中与复发相关的白血病干细胞样群体(LSC-like细胞),该群体表现出更强的天然免疫信号激活。靶向调控天然免疫通路,有望为消除LSC-like细胞、预防AML复发提供新的治疗策略。
在复发阶段,pAML患者的上游干/祖细胞(HSC/MPP-like细胞)异常增殖,且MHC II分子基因的染色质开放性较初诊时期显著降低。结合流式细胞分析检测初诊-复发配对的pAML患者上游干/祖细胞的MHC II分子蛋白的表达水平证实了上述发现。进一步研究显示,MHC II基因活性与AML细胞克隆演化的大小呈显著负相关。AML细胞与T细胞的体外共培养实验进一步表明AML细胞MHC II分子的下调抑制了T细胞的活化和增殖,从而促进了AML复发时期细胞恶性克隆的免疫逃逸,并导致其大量增殖。此外,通过单细胞水平的克隆演化分析,研究鉴定了药物敏感和耐药克隆。差异分析结果显示,耐药克隆的代谢和细胞周期相关通路存在异常调控。进一步,通过相互作用网络分析发现DNMT1和EGR1等关键调控因子在耐药克隆细胞周期异常激活过程中发挥了重要作用,从而促进了pAML的复发进程。
综上所述,本研究在单细胞水平系统分析了pAML患者从初诊到复发阶段的克隆演化及表观调控特征。研究不仅构建了pAML不同分子亚型的表观调控图谱,还揭示了天然免疫信号异常激活和复发阶段MHC II分子表达下调共同促进pAML疾病进展的机制。这些重要发现不仅加深了我们对pAML发病和复发机制的理解,同时也为AML的临床治疗提供了新的潜在靶点。
参考文献
1.Umeda M, Ma J, Westover T, et al. A new genomic framework to categorize pediatric acute myeloid leukemia. Nat Genet .2024;56(2):281-293.
2.Stelmach P, Trumpp A. Leukemic stem cells and therapy resistance in acute myeloid leukemia. Haematologica .2023;108(2):353-366.
3.Assi SA, Imperato MR, Coleman DJL, et al. Subtype-specific regulatory network rewiring in acute myeloid leukemia. Nat Genet .2019;51(1):151-162.
责编

制作
排版 | Sheila 校对 | uu
▼滑动查看更多▼
Pediatric acute myeloid leukemia (pAML) is a clonal disease with recurrent genetic alterations that affect epigenetic states. However, the implications of epigenetic dysregulation in disease progression remain unclear. Here, we interrogated single-cell and clonal level chromatin accessibility of bone marrow samples from 28 pAML patients representing multiple subtypes using mtscATAC-seq, which revealed distinct differentiation hierarchies and abnormal chromatin accessibility in a subtype-specific manner. Innate immune signaling was commonly enhanced across subtypes and related to improved advantage of clonal competition and unfavorable prognosis, with further reinforcement in a relapse-associated leukemia stem cell-like population. We identified a panel of 31 innate immunity related genes to improve the risk classification of pAML patients. By comparing paired diagnosis and post-chemotherapy relapse samples, we showed that primitive cells significantly reduced MHC class II signaling, suggesting an immune evasion mechanism to facilitate their expansion at relapse. Key regulators orchestrating cell cycle dysregulation were identified to contribute to pAML relapse in drug-resistant clones. Our work establishes the single-cell chromatin accessibility landscape at clonal resolution and reveals the critical involvement of epigenetic disruption, offering insights into classification and targeted therapies of pAML patients.
DOI: 10.1182/blood.2024025618
 点击此处,直达原文
点击此处,直达原文
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/12/21/Blood%E4%B8%A8%E6%9C%B1%E5%B9%B3-%E6%9D%A8%E6%96%87%E9%92%B0%E8%81%94%E5%90%88%E5%89%91%E6%A1%A5%E5%9B%A2%E9%98%9F%E5%90%88%E4%BD%9C/
THE END

 点击此处,直达原文
点击此处,直达原文 





赶快来坐沙发