Adv Sci丨中山大学石明等团队描绘肝动脉输注化疗后肝癌的多细胞生态系统
肝癌,更具体地说是肝细胞癌(HCC),是癌症相关死亡的第三大原因,其发病率在全球范围内呈上升趋势。 针对PD-1/PD-L1轴的免疫治疗最近彻底改变了HCC的治疗。此外,之前的试验表明,肝动脉输注化疗(HAIC)与PD-1阻断具有协同作用,具有显著的抗肿瘤疗效,可作为中期HCC患者的治疗选择之一。尽管取得了这些重大进展,但缺乏对 HAIC 后肿瘤微环境的机制研究。
越来越多的证据表明,化疗的疗效不仅涉及直接的细胞毒性作用,还依赖于伴随的抗肿瘤免疫反应的激活。 然而,临床有效的HAIC驱动细胞和微环境成分引发最佳免疫反应并与PD-1阻断协同作用的潜在机制尚不完全清楚。肿瘤微环境(tumor microenvironment, TME)中的细胞组分在肿瘤生物学和抗肿瘤药物敏感性中起着至关重要的作用。在免疫室中,PD-1CD8 T细胞表达中等水平的检查点分子和高水平的效应基因,在一些研究中与免疫治疗的有效反应有关。此外,据报道, CD4 T、B和树突状细胞(DC)在肿瘤内壁龛积聚并诱导抗原特异性T细胞反应,但这些细胞类型如何参与HAIC后的抗肿瘤免疫仍是未知的。
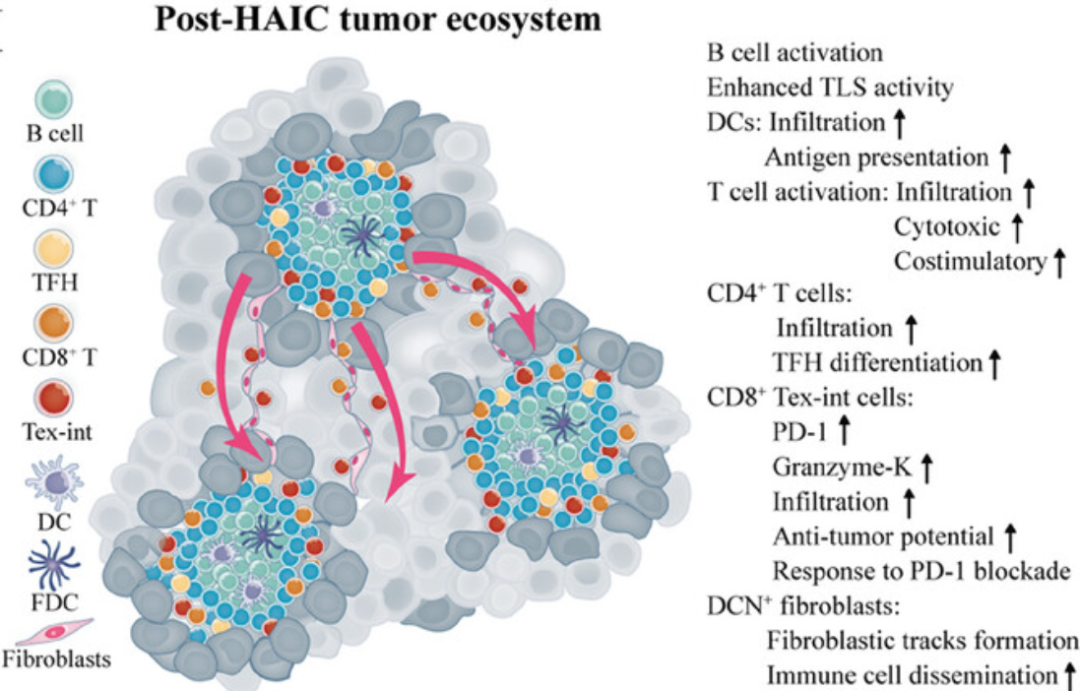
HAIC后HCC独特的肿瘤生态系统示意图(图源自 Advanced Science )
将单核RNA测序(snRNA-seq)与空间转录组学(ST)相结合,为在细胞和空间分辨率上探索TME中的细胞成分及其相互作用提供了一条途径。 最近也发表了对实体肿瘤,如鼻咽癌(NPC)、结直肠癌(CRC)和食管鳞状细胞癌(ESCC)在免疫治疗或化疗后的TME的综合分析,但尚不清楚这些发现是否可以应用于HCC的HAIC治疗研究。
研究对治疗初期原发性肿瘤(PT)和HAIC后肿瘤(HT)的HCC标本进行了snRNA-seq和ST,以系统地表征HAIC治疗后HCC的细胞和空间异质性。 研究证明了HAIC促进了三级淋巴结构(TLSs)的形成,并研究了TLSs作为CD4 T、DC和CD20 B细胞之间细胞通信的空间壁龛的作用。具体来说,研究发现了一个具有功能性抗肿瘤表型的中间耗尽CD8 T细胞亚群,在HAIC治疗后扩大,在TLS附近积聚,并沿成纤维细胞轨道扩散,这表明该CD8 T亚群可能是晚期HCC患者HAIC治疗的有效生物标志物。 研究综合分析首次描绘了HAIC后HCC的肿瘤生态系统,并证明了HAIC联合PD-1阻断的治疗潜力,这可能指导精准医学的发展,使更广泛的患者受益。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202405749
链接:http://www.lewenyixue.com/2024/12/21/Adv%20Sci%E4%B8%A8%E4%B8%AD%E5%B1%B1%E5%A4%A7%E5%AD%A6%E7%9F%B3%E6%98%8E%E7%AD%89%E5%9B%A2%E9%98%9F%E6%8F%8F%E7%BB%98%E8%82%9D/






赶快来坐沙发