《自然-癌症》:迟喻丹团队破解脑膜转移瘤的致命机制,巨噬细胞竟成肿瘤“推手”
大脑中枢的边界构成复杂,涵盖了颅骨、脑膜、脉络丛及血管旁间隙等关键解剖学要素,而脑脊液则是这一边界区域内至关重要的物质交换媒介。在正常生理条件下,中枢边界被多种精密的屏障系统所守护,这些屏障会负责对进入脑脊液的外周环境物质与细胞进行筛选,维持着脑脊液的低细胞浓度与低蛋白含量特性。
然而,越来越多的科学证据表明, 病理条件下的中枢边界屏障稳定性会受损,这种情况下,这些屏障可能转变为活跃的中枢-外周交互界面,加速疾病的恶化进程。此外,大脑还是原发性及转移性癌症的高风险区域,肿瘤生长、免疫细胞募集以及血管异常改变,会促使形成一个独特的病理性微生态系统。该微生态系统对中枢边界屏障稳定性的影响及其潜在机制,是当前脑癌研究领域亟待解决的关键难题,对于深入理解疾病进展以及探索有效治疗策略具有重要意义。
图片来源:123RF
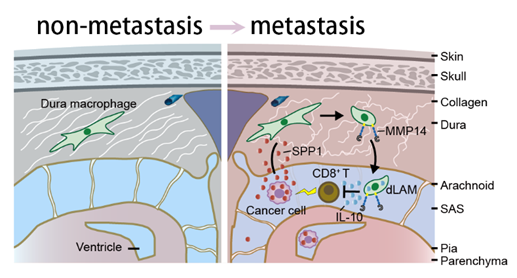
软脑膜转移瘤(leptomeningeal metastasis)是一种严重的恶性肿瘤,肿瘤细胞会侵入个体中枢边界的蛛网膜下腔及脑脊液中,这一现象在肺癌、乳腺癌和黑色素瘤患者中尤为常见。软脑膜转移瘤患者的自然生存期通常仅为两个月左右。尽管临床上已尝试采用放疗、化疗和靶向治疗等多种手段治疗软脑膜转移瘤,但效果依然不尽如人意。
早在2020年,迟喻丹团队首次揭示了软脑膜转移患者脑脊液的微环境特征,并发现 肿瘤细胞能通过竞争脑脊液中的微量元素铁离子,与巨噬细胞争夺生存优势。这一发现为理解软脑膜转移的免疫治疗开辟了新视角。然而,软脑膜转移瘤紧邻中枢边界,会引起脑脊液中免疫细胞的大量浸润和细胞因子上调,但其对中枢边界的具体影响机制仍不清楚。
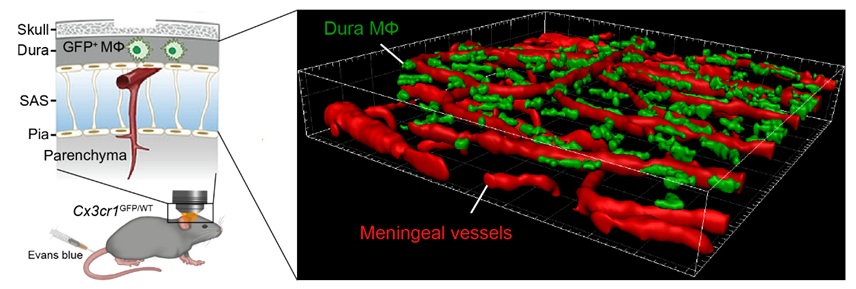
2024年12月20日,复旦大学脑科学转化研究院/附属华山医院的 迟喻丹 课题组携手浙江清华长三角研究院的 张强强 研究员,在《自然-癌症》( Nature Cancer)上发表了论文,新研究深入剖析了软脑膜转移瘤进程中,中枢边界硬脑膜细胞组分和细胞外基质组分的重塑变化。此外,研究特别关注了脑膜巨噬细胞突破受损硬脑膜屏障并迁移到脑脊液中的动态过程及其调控机制。

链接:http://www.lewenyixue.com/2024/12/21/%E3%80%8A%E8%87%AA%E7%84%B6-%E7%99%8C%E7%97%87%E3%80%8B%EF%BC%9A%E8%BF%9F%E5%96%BB%E4%B8%B9%E5%9B%A2%E9%98%9F%E7%A0%B4%E8%A7%A3%E8%84%91%E8%86%9C%E8%BD%AC%E7%A7%BB%E7%98%A4/





 未来|指南共识|广东省药学会发布《医疗机构药品费用科学管理(DES)专家共识》
未来|指南共识|广东省药学会发布《医疗机构药品费用科学管理(DES)专家共识》
赶快来坐沙发