Nature 子刊 | 周彩存教授牵头:EGFR突变非小细胞肺癌治疗进展综述 | 年度盘点
【CMT&CHTV 医学前沿·临床经典】
导语: 近期,周彩存教授牵头多位专家综述了EGFR突变NSCLC治疗的最新进展发表于 Nature 子刊,特别关注第三代EGFR TKIs的应用、耐药机制以及新兴治疗策略,为临床医生提供了宝贵的参考。
非小细胞肺癌(NSCLC)是肺癌中最常见的类型,其中EGFR突变的患者约占20%至30%。EGFR TKIs的发现极大地改善了这部分患者的预后。然而,随着治疗的深入,耐药问题成为限制患者生存获益的主要障碍。近年来,第三代EGFR TKIs因其良好的中枢神经系统穿透力和对EGFR常见突变及T790M耐药突变的选择性抑制,已成为晚期EGFR突变NSCLC的一线治疗标准。
2024年11月29日, 同济大学医学院附属东方医院周彩存教授牵头多位专家在 Nature Reviews Clinical Oncology发表题为“The changing treatment landscape of EGFR-mutant non-small-cell lung cancer”的综述 ,全面回顾和分析EGFR突变NSCLC治疗领域的最新进展,综合了当前第一线治疗选项,概述了第三代EGFR酪氨酸激酶抑制剂(TKIs)耐药机制,并探索了新兴的有前景的治疗策略。
综述包括对现有文献的系统回顾和分析,以及对正在进行的临床试验的评估。重点在于第三代EGFR TKIs的联合治疗策略,如与抗血管生成药物、化疗、EGFR-MET双特异性抗体Amivantamab或局部肿瘤消融的联合应用,以及EGFR TKIs在早期或局部晚期EGFR突变NSCLC患者中的评估。
01
▼
内容概述
第三代EGFR TKIs已成为晚期EGFR突变NSCLC患者的标准一线治疗,但其疗效似乎已达到平台期,关键试验中获批的第三代EGFR TKIs的中位无进展生存期(PFS)均未超过2年。为了延迟耐药、延长缓解持续时间及最大化治疗效果,第三代EGFR TKIs与多种治疗联合策略正在探索中。
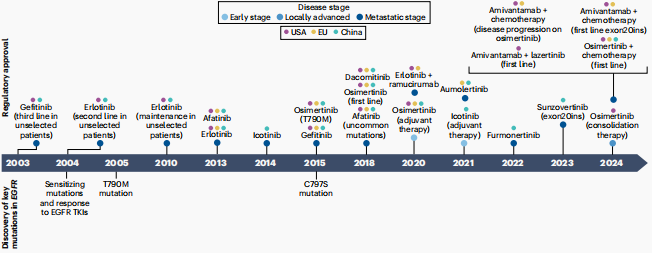
图1 NSCLC患者EGFR TKIs治疗进展
表1 NSCLC患者中常见EGFR突变的分类
第三代EGFR TKIs联合治疗策略的探索
为了克服耐药性并延长患者反应时间,研究者正在探索第三代EGFR TKIs与其他治疗策略的联合应用,包括与抗血管生成药物、化疗、EGFR-MET双特异性抗体Amivantamab或局部肿瘤消融的联合。这些联合治疗策略的初步结果显示出潜在的疗效,尤其是在延迟耐药性和提高治疗反应率方面。
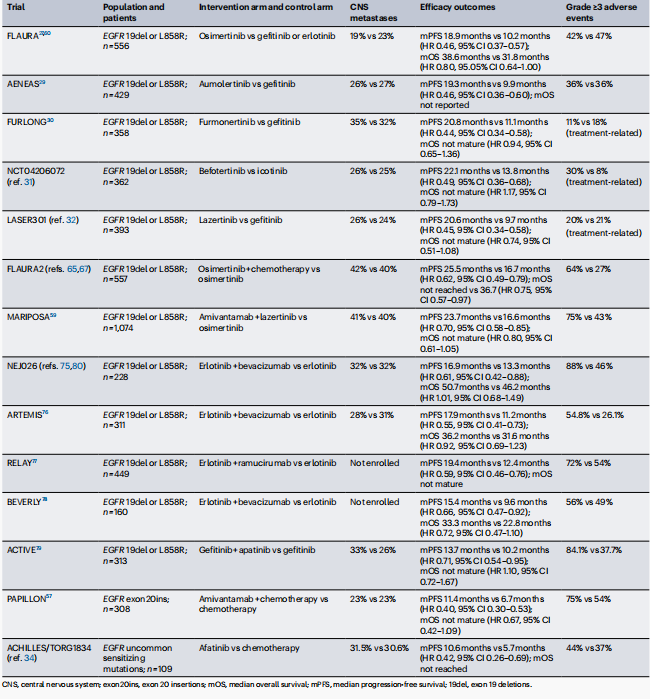
表2 EGFR TKIs 治疗EGFR突变型NSCLC的关键III期临床试验
EGFR TKIs与化疗的联合 :FLAURA2试验中,奥希替尼联合化疗相比于单独奥希替尼,显著提高了PFS(中位25.5个月对比16.7个月; HR= 0.62, 95% CI: 0.49–0.79; P <0.001),并且观察到在联合治疗组中,中位缓解持续时间(DOR)达到24.0个月,相比于奥希替尼单药组的15.3个月有显著提升。并观察到持久反应和改善的CNS疗效。然而,联合治疗伴随着更高的3级及以上不良事件发生率。
EGFR TKIs与EGFR-MET双特异性抗体的联合: CHRYSALIS试验和MAIPOSA试验表明,Amivantamab和Lazertinib的联合治疗在未经治疗的晚期EGFR突变NSCLC患者中显示出高 ORR (100%)和改善的PFS(中位23.7个月对比16.6个月)。这种联合治疗可能通过双重靶向EGFR和MET通路来延迟耐药的发展。但MAIPOSA试验也提出了对应的安全性问题,包括输注相关反应和皮肤毒性。
其他联合治疗策略: EGFR和VEGF-VEGFR信号的双重阻断是另一种有前景的治疗策略。尽管与第一代EGFR TKIs联合使用时未能提供OS益处,但这种联合方法可能对高风险疾病患者有益。此外,局部肿瘤消融在寡转移或寡持续性EGFR突变NSCLC患者中的作用也值得进一步研究。抗体-药物偶联物(ADCs)在EGFR TKIs治疗后进展的NSCLC患者中显示出有前景的疗效,特别是HER3-DXd与EGFR TKIs的联合使用的相关试验正在被评估中。
EGFR TKIs在早期和局部晚期NSCLC中的应用
EGFR TKIs的应用范围已经扩展到可切除的早期和局部晚期EGFR突变NSCLC患者,这标志着在EGFR突变NSCLC的精准管理中迈出了重要一步。
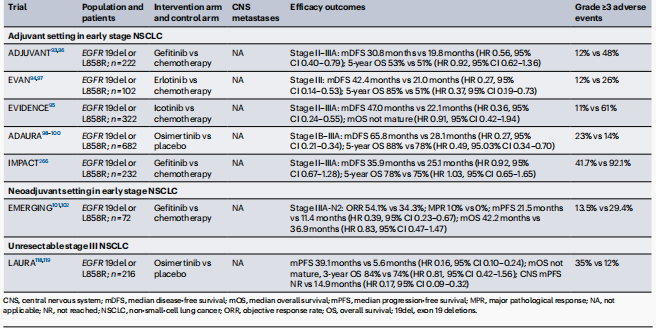
辅助治疗: 在早期(ⅠB-ⅢA期)切除的EGFR突变NSCLC患者中,辅助EGFR TKIs治疗有望改善预后。随机试验表明,与辅助化疗相比,使用第一代EGFR TKIs(包括吉非替尼、厄洛替尼和伊科替尼)治疗2年,显著延长了DFS,OS益处在不同试验中不一致。ADAURA Ⅲ期试验中,完全切除的EGFR突变NSCLC患者随机接受奥希替尼或安慰剂治疗3年,结果显示奥希替尼显著改善了DFS和OS。目前,早期可切除NSCLC患者的标准治疗包括手术切除后辅助奥希替尼,伴或不伴辅助化疗。然而,即使接受奥希替尼辅助治疗长达3年,仍有超过30%的患者在5年内出现疾病复发或死亡。因此,识别高风险复发患者、理解共突变的影响、使用ctDNA监测和确定辅助EGFR TKI治疗的最佳持续时间是提高患者预后的关键问题。
新辅助治疗: 相关临床试验也在积极研究新辅助EGFR TKIs治疗在早期、可切除的EGFR突变NSCLC患者中的疗效。新辅助治疗的目标是通过减小肿瘤体积实现疾病降期,优化手术结果。在Ⅱ期EMERGING试验中,与化疗相比,厄洛替尼治疗组的ORR更高,但两组均未观察到pCR。此外,OS没有显著差异。其他单臂研究也考察了新辅助阿法替尼或奥希替尼在可切除EGFR突变NSCLC患者中的疗效,取得了令人鼓舞的ORR,但pCR率低(<5%)。EGFR TKIs作为新辅助治疗的单药疗效有限。III期NeoADAURA试验目前正在测试新辅助奥希替尼伴或不伴化疗与单独新辅助化疗在可切除EGFR突变NSCLC患者中的疗效。
局部晚期EGFR突变NSCLC: 对于不可切除的Ⅲ期NSCLC患者,同步放化疗后使用度伐利尤单抗进行巩固治疗是标准治疗方法。基于PACIFIC Ⅲ期试验,显著延长了PFS和OS。然而,PACIFIC试验的事后亚组分析发现,在EGFR突变NSCLC患者中接受度伐利尤单抗与安慰剂的PFS和OS没有统计学上的显著差异。Ⅲ期LAURA试验的数据为不可切除的III期EGFR突变NSCLC患者在放化疗后至少稳定疾病后使用奥希替尼巩固治疗的疗效提供了新的见解。这些结果表明,奥希替尼巩固治疗显著改善了PFS和CNS PFS。这些发现将奥希替尼定位为放化疗后III期EGFR突变NSCLC患者的替代治疗选择,并获得了FDA的批准,强调了在NSCLC的所有阶段进行基因检测的必要性。值得注意的是,LAURA试验中放射性肺炎的高发生率(任何级别48%,3级及以上2%)应在常规治疗决策中考虑。OS数据和生物标志物分析结果(包括共突变的影响、ctDNA动态和获得性耐药机制)即将公布。
表3 EGFR TKIs在早期或局部晚期EGFR突变非NSCLC中的关键临床试验
新兴治疗策略的潜力
尽管第三代EGFR TKIs面临获得性耐药的挑战,但新的治疗策略,如新的TKIs、抗体-药物偶联物、新的免疫治疗方法和靶向蛋白降解剂,在EGFR突变NSCLC患者中显示出相当的前景。
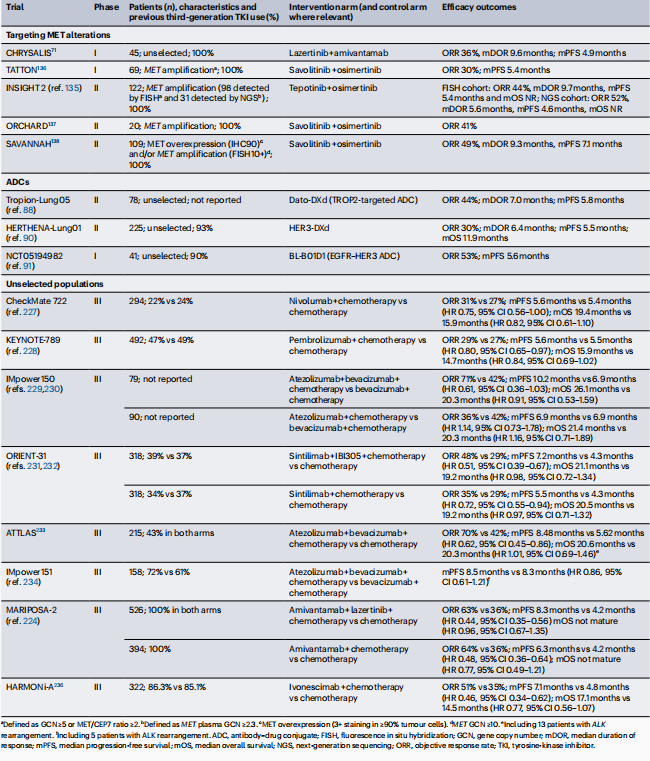
抗体-药物偶联物(ADCs): ADC药物在EGFR TKIs治疗后进展的NSCLC患者中显示出有前景的疗效。特别是HER3-DXd(patritumab deruxtecan),作为一种HER3导向的ADC,因其在EGFR TKIs治疗后表达增加,促进了HER3-DXd的内化,从而提高了其活性。I期试验中,奥希替尼联合HER3-DXd正在被测试,以评估其在先前未治疗的EGFR突变NSCLC患者中的潜力。此外,其他针对TROP2的ADCs,如datopotamab deruxtecan(Dato-DXd)和sacituzumab tirumotecan,以及EGFR-HER3双特异性ADC zalontamab brengitecan,也正在与奥希替尼联合用于晚期EGFR突变NSCLC患者的一线治疗的研究中。
免疫检查点抑制剂(ICIs): ICIs在EGFR突变NSCLC患者中的研究也显示出一定的潜力。尽管EGFR突变的NSCLC通常对单药ICIs的反应较低,但联合化疗和ICIs的策略在一些试验中显示出改善PFS的潜力。例如,III期IMpower150试验中,阿特珠单抗联合贝伐珠单抗和化疗相比于贝伐珠单抗和化疗,改善了EGFR突变NSCLC患者的中位PFS。
局部肿瘤消融: 局部肿瘤消融在寡转移或寡持续性EGFR突变NSCLC患者中的作用也值得进一步研究。随机试验旨在验证TKIs治疗开始后对残留转移部位进行局部消融的好处,并确定局部和系统治疗的最佳时机和顺序,以最大化患者利益并最小化毒性。
个体化新抗原疫苗: 新抗原疫苗通过激活肿瘤抗原特异性CD4+和CD8+ T细胞来识别和消除EGFR突变的癌细胞。I期试验中,针对EGFR突变的个性化新抗原肽疫苗(PPV)在EGFR突变的NSCLC患者中显示出临床反应,提示EGFR突变靶向PPV在EGFR TKIs治疗后的潜力。
表4 已完成的旨在克服第三代EGFR TKIs耐药性的临床试验
第三代EGFR TKIs的耐药性
第三代EGFR TKIs在EGFR突变的NSCLC患者中表现出显著的疗效,但耐药性仍是一个不可避免的挑战。耐药机制可以分为针对药物靶点的耐药(on-target resistance)和非针对药物靶点的耐药(off-target resistance)。
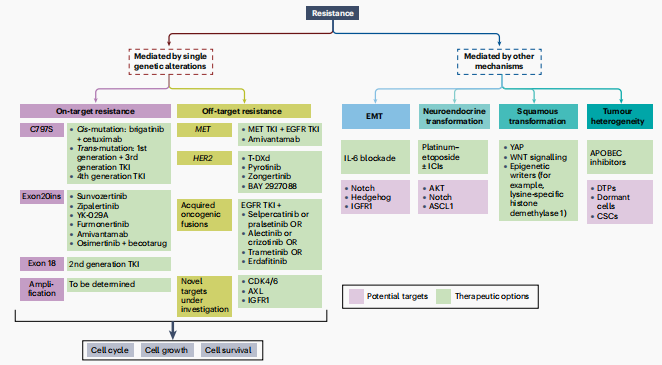
图2 对第三代EGFR TKIs的耐药机制和潜在治疗策略的探索
针对药物靶点的耐药(On-target Resistance)
C797S介导的耐药性: C797S突变是第三代EGFR TKIs耐药性的一个主要机制,发生在约6%至18%的患者中。这种突变可以单独发生或与T790M突变共存,分为顺式(cis)和反式(trans)两种形式。针对C797S/T790M顺式突变的患者,brigatinib联合cetuximab可能比化疗更有益。对于C797S/T790M反式突变的患者,第一代和第三代EGFR TKIs的联合治疗可能有效。此外,第四代EGFR TKIs也在研究中,以克服C797S介导的耐药性。
EGFR扩增: EGFR扩增与T790M突变共存,可能与第三代EGFR TKIs的耐药性有关。
非针对药物靶点的耐药(Off-target Resistance)
MET过表达和/或扩增: MET扩增是第三代EGFR TKIs耐药性的一个常见机制,发生在约16%至18%的患者中。临床试验正在测试MET TKIs与EGFR TKIs的联合治疗,以克服MET扩增介导的耐药性。
HER2过表达和/或扩增 :HER2扩增发生在约2%至5%的耐药患者中,可能通过激活替代途径如MAPK和PI3K来介导耐药性。HER2靶向的ADCs和HER2 TKIs可能在克服HER2介导的耐药性方面具有潜力。
获得性致癌融合: 罕见的基因事件,如RET、ALK、BRAF、FGFR和ROS1的融合或染色体重排,也可以介导对第三代EGFR TKIs的耐药性。
02
▼
总结讨论
本文综述了EGFR突变NSCLC的当前治疗选择,并提供了第三代EGFR TKIs获得性耐药机制的概述,同时探索了有前景的新治疗策略。尽管第三代EGFR TKIs在治疗EGFR突变NSCLC方面取得了显著进展,但耐药问题仍然是一个挑战。未来的研究需要集中在改善患者生存结果的潜在途径上,包括开发新的TKIs、抗体-药物偶联物和免疫治疗策略。此外,循环肿瘤DNA(ctDNA)指导下的治疗优化可能为EGFR突变NSCLC患者的适应性治疗提供宝贵的指导,需要设计良好的前瞻性随机临床试验来验证这些策略的有效性。
ZHOU F, GUO H, XIA Y, et al. The changing treatment landscape of EGFR-mutant non-small-cell lung cancer. Nat Rev Clin Oncol. https://www.nature.com/articles/s41571-024-00971-2.[2024-11-29]. DOI:10.1038/s41571-024-00971-2.
编辑:赤芍
二审:薄荷
三审:清扬
排版:半夏
链接:http://www.lewenyixue.com/2024/12/17/Nature%20%E5%AD%90%E5%88%8A%20%7C%20%E5%91%A8%E5%BD%A9%E5%AD%98%E6%95%99%E6%8E%88%E7%89%B5%E5%A4%B4%EF%BC%9A/







赶快来坐沙发